人教版 (2019)必修 第二册第二节 化学反应的速率与限度练习题
展开
这是一份人教版 (2019)必修 第二册第二节 化学反应的速率与限度练习题,共10页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
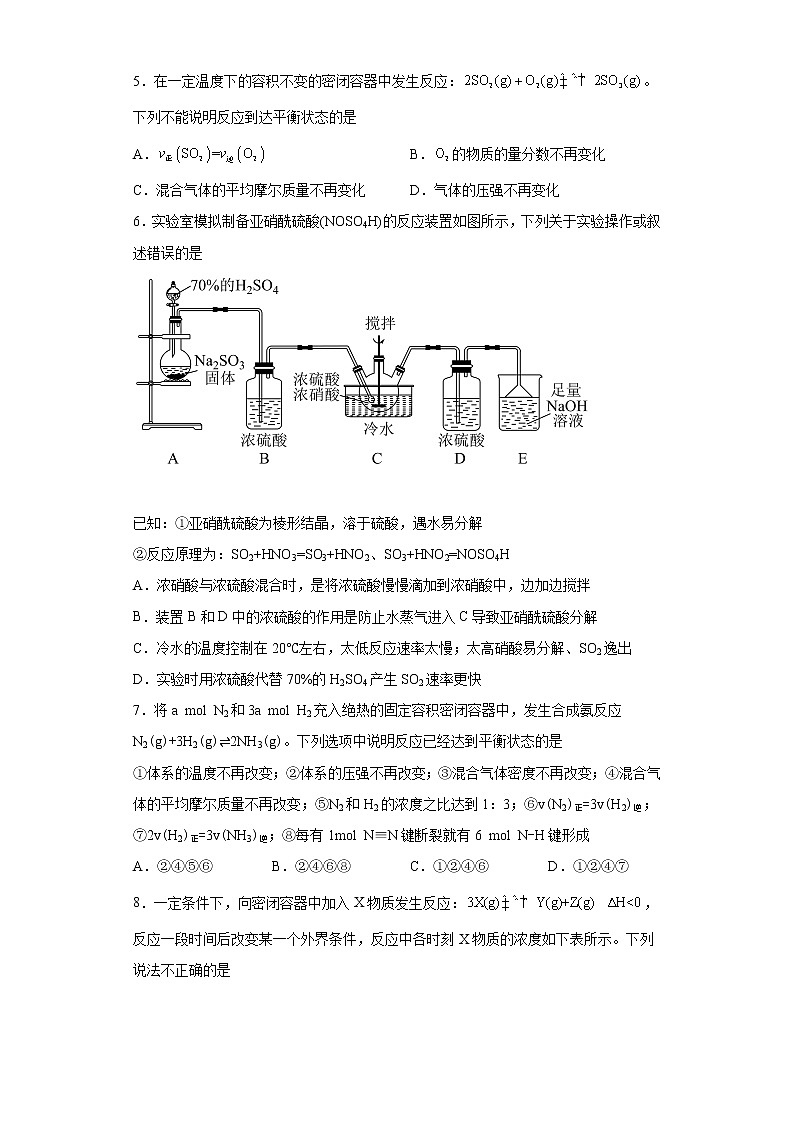
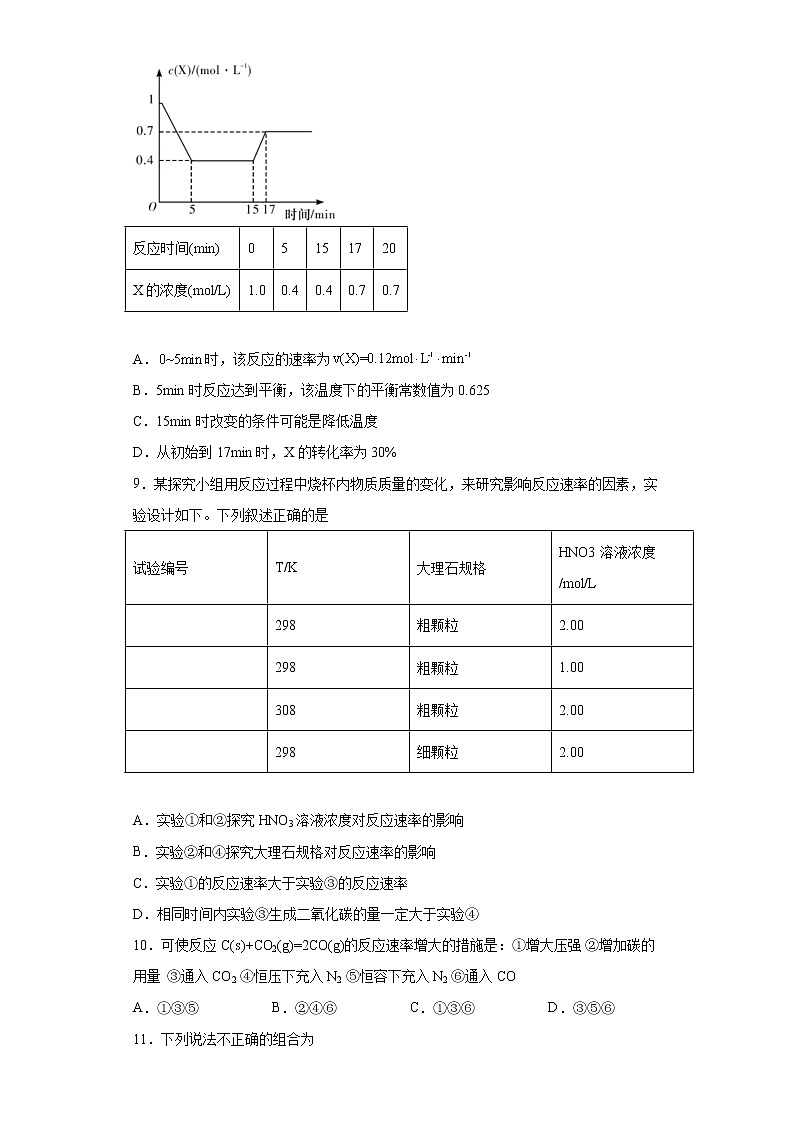
化学反应速率与限度专项训练一、单选题(15题,每题3分,共45分)1.化学在生活中的应用随处可见,下列措施不是为了改变化学反应速率的是A.将食物存放在冰箱中 B.加工馒头时添加膨松剂C.糕点包装袋内放置除氧剂 D.冶铁时将铁矿石粉碎2.下列方案设计、现象和结论都正确的是 目的方案设计现象和结论A探究金属钠在氧气中受热所剩固体的成分取少量固体粉末,加入2~3mL蒸馏水若无气体生成,则固体粉末为Na2O;若有气体生成,则固体粉末为Na2O2B探究KI与FeCl3反应的限度取5mL0.1mol·L-1KI溶液于试管中,加入1mL0.1mol·L-1FeCl3溶液,充分反应后滴入几滴KSCN溶液若溶液变红,则KI与FeCl3的反应有一定限度C探究Na2SO3固体样品是否变质取少量待测样品溶于蒸馏水,加入足量稀硫酸,再加入足量BaCl2溶液若有白色沉淀产生,则样品已经变质D检验某无色溶液中是否含有取少量该溶液于试管中,滴加稀氢氧化钠溶液,用湿润的红色石蕊试纸放试管口不变蓝,证明溶液中无铵根离子 A.A B.B C.C D.D3.已知4NH3(g)+5O2(g) 4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为A.4v(NH3)=5v(O2) B.5v(O2)=6v(H2O)C.2v(NH3)=3v(H2O) D.4v(O2)=5v(NO)4.反应在四种不同情况下的反应速率分别为:① ②③ ④下列有关反应速率的比较中正确的是A.④<③=②<① B.④>③>②>① C.④>③=②>① D.①>②>③>④5.在一定温度下的容积不变的密闭容器中发生反应:。下列不能说明反应到达平衡状态的是A. B.的物质的量分数不再变化C.混合气体的平均摩尔质量不再变化 D.气体的压强不再变化6.实验室模拟制备亚硝酰硫酸(NOSO4H)的反应装置如图所示,下列关于实验操作或叙述错误的是
已知:①亚硝酰硫酸为棱形结晶,溶于硫酸,遇水易分解②反应原理为:SO2+HNO3=SO3+HNO2、SO3+HNO2=NOSO4HA.浓硝酸与浓硫酸混合时,是将浓硫酸慢慢滴加到浓硝酸中,边加边搅拌B.装置B和D中的浓硫酸的作用是防止水蒸气进入C导致亚硝酰硫酸分解C.冷水的温度控制在20℃左右,太低反应速率太慢;太高硝酸易分解、SO2逸出D.实验时用浓硫酸代替70%的H2SO4产生SO2速率更快7.将a mol N2和3a mol H2充入绝热的固定容积密闭容器中,发生合成氨反应N2(g)+3H2(g)⇌2NH3(g)。下列选项中说明反应已经达到平衡状态的是①体系的温度不再改变;②体系的压强不再改变;③混合气体密度不再改变;④混合气体的平均摩尔质量不再改变;⑤N2和H2的浓度之比达到1:3;⑥v(N2)正=3v(H2)逆;⑦2v(H2)正=3v(NH3)逆;⑧每有1mol N≡N键断裂就有6 mol N-H键形成A.②④⑤⑥ B.②④⑥⑧ C.①②④⑥ D.①②④⑦8.一定条件下,向密闭容器中加入X物质发生反应:,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法不正确的是反应时间(min)05151720X的浓度(mol/L)1.00.40.40.70.7 A.时,该反应的速率为B.5min时反应达到平衡,该温度下的平衡常数值为0.625C.15min时改变的条件可能是降低温度D.从初始到17min时,X的转化率为30%9.某探究小组用反应过程中烧杯内物质质量的变化,来研究影响反应速率的因素,实验设计如下。下列叙述正确的是试验编号T/K大理石规格HNO3溶液浓度/mol/L 298粗颗粒2.00 298粗颗粒1.00 308粗颗粒2.00 298细颗粒2.00 A.实验①和②探究HNO3溶液浓度对反应速率的影响B.实验②和④探究大理石规格对反应速率的影响C.实验①的反应速率大于实验③的反应速率D.相同时间内实验③生成二氧化碳的量一定大于实验④10.可使反应C(s)+CO2(g)=2CO(g)的反应速率增大的措施是:①增大压强 ②增加碳的用量 ③通入CO2 ④恒压下充入N2 ⑤恒容下充入N2 ⑥通入COA.①③⑤ B.②④⑥ C.①③⑥ D.③⑤⑥11.下列说法不正确的组合为①化学反应速率为0.8mol·L-1·s-1是指1s时某物质的浓度为0.8mol·L-1②同一化学反应,相同条件下用不同物质表示的反应速率,数值越大,表示化学反应速率越快③升温时吸热反应速率增大,放热反应速率减小④一定量的锌与过量的稀硫酸反应制取氢气,滴入少量硫酸铜与醋酸钠均能够提高反应速率⑤增大反应物的浓度,能够增大活化分子的百分数,所以反应速率增大⑥100mL2mol·L-1盐酸与锌片反应,加入适量的氯化钠溶液,反应速率不变A.①②③④⑤⑥ B.①②③④ C.①②③⑤⑥ D.①③④⑤12.某温度下按如图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 的硫酸溶液,将产生的收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成273 K、101 kPa条件下的体积为44.8 mL),在该温度下,下列说法不正确的是A.可以通过测定锌粒减小质量来测定反应速率B.忽略锥形瓶内溶液体积的变化,用来表示10 s内该反应的速率为0.01 C.忽略锥形瓶内溶液体积的变化,用来表示10 s内该反应的速率为0.01 D.用来表示10 s内该反应的速率为0.004 13.下列各图是温度(或压强)对2A(s)+2B(g)⇌2C(g)+D(g) ΔH>0的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是A. B.C. D.14.反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是A.该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数B.该反应中,反应物的总键能小于生成物的总键能C.25℃、101kPa下,将和置于密闭容器中充分反应生成放热akJ,其热化学方程式为 D.使用催化剂可以改变活化能和反应历程15.已知:N2O4(g)2NO2(g) ΔH>0,现将1 mol N2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是A. B. C. D. 二、填空题(4大题,55分)16(12分).将等物质的量的A、B混合放于2L的密闭容器中,发生反应3A(g)+B(g)⇌xC(g)+2D(g)。经5min后,测得D的浓度为0.5mol·L-1,c(A)∶c(B)=3∶5,v(C)=0.1mol·L-1·min-1。则:(1)x=___________。(2)A在5min末的浓度是___________。(3)前5min内B的反应速率v(B)=___________,D的平均反应速率v(D)=___________。(4)5min末A的转化率为___________。17(13分).在容积为的密闭容器中进行如下反应:,开始时为为末达到平衡,测得为,用表示的化学反应速率为。试回答下列问题:(1)末的物质的量浓度为___________,平衡后A的转化率为___________。(2)内用表示的化学反应速率为___________。(3)化学方程式中为___________。(4)反应达到平衡时压强与起始压强之比为___________。18(15分).根据反应4FeS2+11O22Fe2O3+8SO2,试回答下列问题。(1)常选用哪些物质来表示该反应的化学反应速率___________。(2)当生成SO2的速率为0.64 mol·L-1·s-1时,则氧气减少的速率为___________。(3)如测得4 s后O2的浓度为2.8 mol·L-1,此时间内SO2表示的速率为0.4 mol·L-1·s-1,则开始时氧气的浓度为___________。(4)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)=xC(g)+2D(g),经过5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1,A在5 min末的浓度是___________,B的平均反应速率是___________,x的值是___________。19(15分).用酸性KMnO4溶液与H2C2O4(草酸)溶液反应研究影响反应速率的因素,一实验小组欲通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:(1)检验如图装置气密性的最简便方法为:___________。(2)写出该反应的离子方程式___________。(3)该实验探究的是___________(填外部因素)对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是___________>___________(填实验序号)。(4)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,___________mol·L-1(假设混合溶液的体积为50mL)。(5)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定___________来比较化学反应速率。(6)小组同学发现反应速率变化如图乙,其中t1—t2时间内速率变快的主要原因可能是:①反应放热,②___________。
参考答案1.B2.B3.D4.C5.A6.D7.D8.C9.A10.C11.A12.C13.A14.C15.B16.(1)2(2)0.75mol/L(3) 0.1mol·L-1·min-1 (4)50%17.(1) 1.5mol/L 25% (2)0.2mol/(L•min)(3)2(4)6:518.(1)O2 、SO2(2)0.88 mol·L-1·s-1(3)5.0 mol·L-1(4) 0.75 mol/L 0.05 mol·L-1·min -1 2 19.(1)先关闭分液漏斗的活塞,再轻轻向外拉(或向内压)注射器的活塞,松手后恢复原位,表明气密性良好(2)2MmO+5H2C2O4 +6H+=2Mn2+ + 10CO2↑+8H2O(3) 浓度 ② ① (4)5.210-3(5)通过测定KMnO4完全退色所需的时间(6)反应生成的Mn2+对该反应有催化作用,随着反应的进行生成的锰离子越多,则反应速率越快
相关试卷
这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度课后测评,共15页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第二节 化学反应的速率与限度课堂检测,共23页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度一课一练,共16页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。










