

所属成套资源:整册化学2019人教新版选择性必修1试卷达标检测题
- 第1课时 盖斯定律-2022版化学选择性必修1人教版(2019) 同步练习 (Word含解析) 试卷 1 次下载
- 第2课时 反应热的计算-2022版化学选择性必修1人教版(2019) 同步练习 (Word含解析) 试卷 1 次下载
- 第1课时 化学反应速率-2022版化学选择性必修1人教版(2019) 同步练习 (Word含解析) 试卷 1 次下载
- 第2课时 影响化学反应速率的因素 活化能-2022版化学选择性必修1人教版(2019) 同步练习 (Word含解析) 试卷 2 次下载
- 第3课时 影响化学平衡的因素-2022版化学选择性必修1人教版(2019) 同步练习 (Word含解析) 试卷 1 次下载
人教版 (2019)第一章 化学反应的热效应第一节 反应热第1课时同步测试题
展开这是一份人教版 (2019)第一章 化学反应的热效应第一节 反应热第1课时同步测试题,共16页。试卷主要包含了“焓”是指等内容,欢迎下载使用。
第1课时 反应热 焓变
基础过关练
题组一 放热反应与吸热反应
1.(2021安徽皖南名校期中联考)下列民俗、诗句、谚语等包含吸热反应的是( )
A.民间焰火之最——确山打铁花
B.千锤万凿出深山,烈火焚烧若等闲
C.只要功夫深,铁杵磨成针
D.冰,水为之,而寒于水
2.利用如图所示装置可以很方便地测得某反应是放热反应还是吸热反应。将镁片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题:
(1)有关反应的离子方程式是 ,试管中看到的现象是 。
(2)U形管中液面A (填“上升”或“下降”),原因是 ,说明此反应是 (填“放热”或“吸热”)反应。
(3)由实验推知,MgCl2和H2的总能量 (填“大于”“小于”或“等于”)Mg和HCl的总能量。
题组二 焓变与反应热的概念
3.(2020吉林友好学校联合体高二上期中)“焓”是指( )
A.物质所具有的内能
B.反应热的变化
C.化学键所具有的能量
D.物质的一种化学性质
4.(2020福建漳平一中高二上月考)下列反应属于氧化还原反应,而且ΔH>0的是( )
A.铝片与稀H2SO4的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的木炭与CO2的反应
D.甲烷在O2中的燃烧反应
5.(2020陕西宝鸡金台高二上期中)对于放热反应2H2(g)+O2(g) 2H2O(l),下列说法正确的是( )
A.产物H2O所具有的总能量高于反应物H2和O2所具有的总能量
B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量
C.反应物H2和O2所具有的总能量等于产物H2O所具有的总能量
D.反应物H2和O2比产物H2O稳定
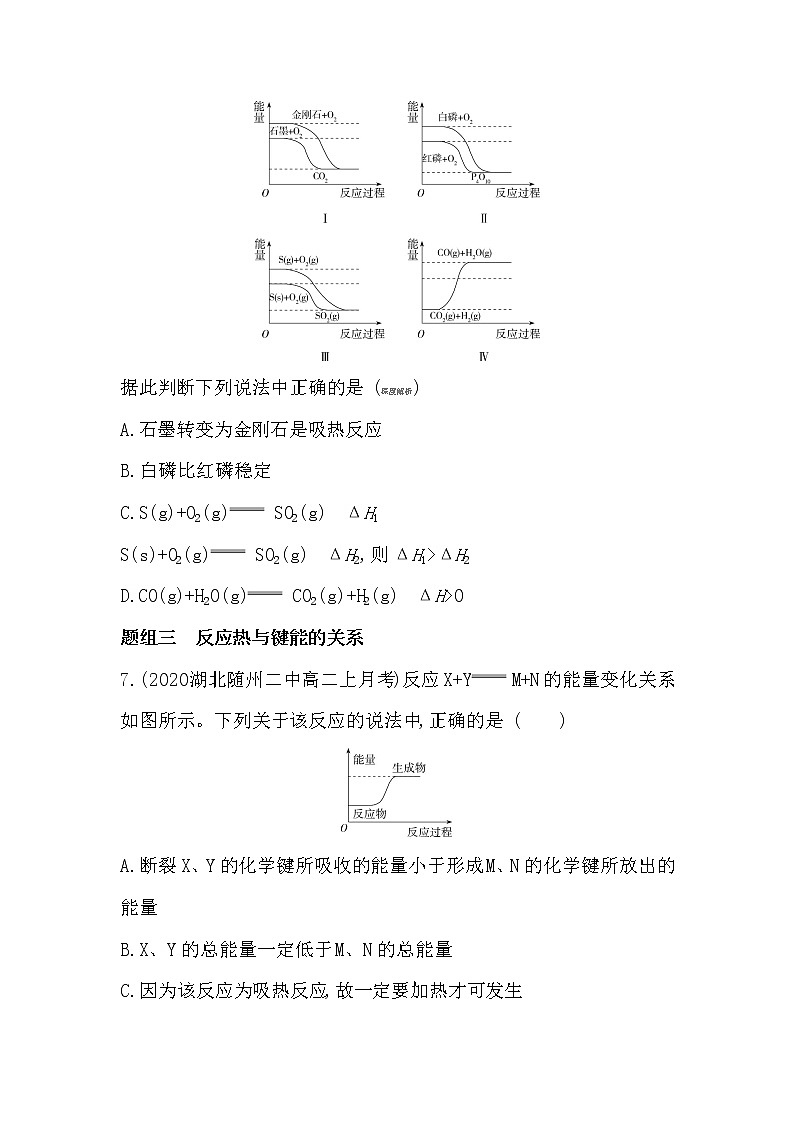
6.下列图像分别表示有关反应的反应过程与能量变化的关系。
据此判断下列说法中正确的是(深度解析)
A.石墨转变为金刚石是吸热反应
B.白磷比红磷稳定
C.S(g)+O2(g) SO2(g) ΔH1
S(s)+O2(g) SO2(g) ΔH2,则ΔH1>ΔH2
D.CO(g)+H2O(g) CO2(g)+H2(g) ΔH>0
题组三 反应热与键能的关系
7.(2020湖北随州二中高二上月考)反应X+Y M+N的能量变化关系如图所示。下列关于该反应的说法中,正确的是( )
A.断裂X、Y的化学键所吸收的能量小于形成M、N的化学键所放出的能量
B.X、Y的总能量一定低于M、N的总能量
C.因为该反应为吸热反应,故一定要加热才可发生
D.X的能量一定低于M的,Y的能量一定低于N的
8.(2021山东聊城高二上期中)已知断裂1 ml化学键所需的能量:键为942 kJ、OO键为500 kJ、N—N键为154 kJ,O—H键为452.5 kJ,则断裂1 ml N—H键所需的能量是( )
A.194 kJ B.316 kJ
C.391 kJ D.658 kJ
9.根据键能数据计算CH4(g)+4F2(g) CF4(g)+4HF(g)的反应热ΔH为( )
A.-1 940 kJ·ml-1 B.+1 940 kJ·ml-1
C.-485 kJ·ml-1 D.+485 kJ·ml-1
10.化学键的键能是形成(或断裂)1 ml化学键时释放(或吸收)的能量。以下是部分共价键键能的数据:H—S键:364 kJ·ml-1;S—S键:266 kJ·ml-1;SO键:522 kJ·ml-1;H—O键:463 kJ·ml-1。试根据这些数据计算下面这个反应的反应热:2H2S(g)+SO2(g) 3S(s)+2H2O(l) ΔH=-Q kJ·ml-1,反应物SO2的1个分子中含2个SO键,反应产物中的S实为S8,实际分子是一个八元环状分子(即),则Q= 。
题组四 中和反应反应热的测定
11.量热计直接测出的是( )
A.质量的变化 B.能量的变化
C.温度的变化 D.电流的变化
12.关于中和反应反应热的测定实验,下列说法正确的是( )
A.为了使反应进行得更完全,可以使酸或碱适当过量
B.为了使反应充分,可以向酸(碱)中分次加入碱(酸)
C.中和反应反应热测定的实验结果与所用酸、碱的用量和种类均无关
D.用铜丝代替玻璃搅拌棒,会使中和反应反应热的测定值偏大
13.(2021河北重点高中阶段性测试)用一定浓度的NaOH溶液与稀盐酸进行中和反应反应热的测定实验时,测得生成1 ml液态水时的ΔH>-57.3 kJ·ml-1,产生这种偏差的原因不可能是( )
A.实验用NaOH溶液的浓度过大
B.实验时搅拌速度慢
C.分2~3次把NaOH溶液倒入盛有稀盐酸的小烧杯中
D.用量取完稀盐酸的量筒直接量取氢氧化钠溶液
14.实验是化学学习的基础,某实验小组在同样的实验条件下,用同样的实验仪器和方法步骤进行两组中和反应反应热测定的实验,实验试剂及其用量如表所示。请完成以下填空。
(1)甲同学预计ΔH1≠ΔH2,其依据是 。
(2)若实验测得①中终了温度为28.4 ℃,则该反应的ΔH1= (保留一位小数)(已知盐酸、NaOH溶液密度近似为1.0 g·cm-3,比热容c=4.18×10-3 kJ·g-1·℃-1)。
(3)在中和反应反应热的测定实验中,若温度计在测定酸溶液的温度后未洗涤就直接测量碱溶液的温度,则测得的ΔH (填“偏大”“偏小”或“不变”)。
15.某实验小组用0.50 ml/L NaOH溶液和0.50 ml/L硫酸溶液进行中和反应反应热的测定。实验装置如图所示。
(1)仪器a的名称是 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,测得起止温度差的平均值为4.0 ℃。 近似认为0.50 ml/L NaOH溶液和0.50 ml/L硫酸溶液的密度都是1 g/cm3,实验后所得溶液的比热容c=4.18 J/(g·℃)。 则计算得ΔH= (取小数点后一位)。
(3)上述实验结果与-57.3 kJ/ml有偏差,产生偏差的原因可能是 (填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
能力提升练
题组一 从微观(化学键)和宏观(内能)角度理解反应热
1.(2021山东聊城期中,)中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示。
下列说法不正确的是( )
A.整个过程实现了光能向化学能的转化
B.过程Ⅱ放出能量并形成了O—O键
C.总反应为2H2O 2H2↑+O2↑
D.过程Ⅲ属于分解反应也是吸热反应
2.(双选)(2021山东师范大学附中第一次学业测评,)化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是( )
A.图1所示的装置能将化学能转变为电能
B.图2可表示中和反应的能量变化情况
C.化学反应中的能量变化都表现为热量的变化
D.化学反应中能量变化的主因是化学键的断裂与形成
3.(2020天津七校高二上期中联考,)单斜硫和正交硫是硫的两种同素异形体,下列说法正确的是( )
A.S(s,单斜) S(s,正交) ΔH3=-0.33 kJ/ml
B.单斜硫比正交硫稳定
C.相同物质的量的正交硫比单斜硫所含的能量高
D.由①可知断裂1 ml O2和1 ml单斜硫中的共价键所吸收的能量比形成1 ml SO2中的共价键所放出的能量多297.16 kJ
题组二 焓变的定性分析和定量计算
4.()生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000倍,在大气中的寿命可达740年,以下是几种化学键的键能:
下列说法中正确的是( )
A.过程N2(g) 2N(g)放出能量
B.过程N(g)+3F(g) NF3(g)放出能量
C.反应N2(g)+3F2(g) 2NF3(g)的ΔH>0
D.NF3吸收能量后如果没有化学键的断裂与形成,仍可能发生化学反应
5.(2020陕西宝鸡金台高二上期中,)通常人们把拆开1 ml某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(ΔH)。已知H—H键键能为436 kJ/ml,Cl—Cl键键能为243 kJ/ml,H—Cl键键能为431 kJ/ml,则HCl(g) 12H2(g)+12Cl2(g)的ΔH为( )
A.+183 kJ/ml B.-183 kJ/ml
C.+91.5 kJ/ml D.-91.5 kJ/ml
6.()SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1 ml S(s)转化为气态硫原子吸收能量280 kJ,断裂1 ml F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。则反应S(s)+3F2(g) SF6(g)的反应热ΔH为(深度解析)
A.-1 780 kJ·ml-1 B.-1 220 kJ·ml-1
C.-450 kJ·ml-1 D.+430 kJ·ml-1
7.(2020江西九江一中高二上期中,)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 ml化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如图所示;现提供以下化学键的键能:P—P键键能为198 kJ·ml-1、P—O键键能为360 kJ·ml-1、氧气分子内氧原子间的键能为498 kJ·ml-1,则P4(s)+3O2(g) P4O6(s)的反应热ΔH为( )
A.+1 638 kJ·ml-1 B.-1 638 kJ·ml-1
C.-126 kJ·ml-1 D.+126 kJ·ml-1
答案全解全析
基础过关练
1.B 确山打铁花是红热的铁被锻打溅出的“铁花”,不是吸热反应,A错误;千锤万凿出深山,烈火焚烧若等闲,包含高温煅烧石灰石的反应,为吸热反应,B正确;只要功夫深,铁杵磨成针,是物理变化,C错误;水变成冰是放热过程,D错误。
2.答案 (1)Mg+2H+ Mg2++H2↑ 镁片溶解,有气泡产生
(2)下降 反应放出的热量使锥形瓶内气压增大 放热
(3)小于
解析 镁片与盐酸的反应是放热反应,是由于反应物的总能量高于生成物的总能量,放出的热量使锥形瓶内气压增大,导致U形管左端液面下降,右端液面上升。
3.A 焓是与内能有关的物理量,是物质所具有的能量,不表示反应热的变化、化学键所具有的能量。
4.C 有元素化合价变化的反应为氧化还原反应;ΔH>0的反应为吸热反应。铝片与稀H2SO4的反应、甲烷在O2中的燃烧反应是氧化还原反应,但属于放热反应;Ba(OH)2·8H2O与NH4Cl的反应为吸热反应,但不属于氧化还原反应;灼热的木炭与CO2的反应,属于氧化还原反应,且属于吸热反应。
5.B 反应2H2(g)+O2(g) 2H2O(l)是放热反应,则说明反应物氢气和氧气的总能量高于生成物水的总能量。
6.A A项,由题图可知石墨的能量比金刚石的低,因此由石墨转变为金刚石是吸热反应,正确;B项,由题图可知白磷具有的能量比红磷的高,能量越低越稳定,错误;C项,由题图可知,|ΔH1|>|ΔH2|,由于ΔH1、ΔH2均小于零,故ΔH1<ΔH2,错误;D项,由题图可知,反应CO(g)+H2O(g) CO2(g)+H2(g)为放热反应,ΔH<0,错误。
反思升华
解答本题应看清起点、终点,分析曲线的变化趋势,理解物质稳定性与键能及物质所具有能量的关系。一般认为键能越大,化学键越牢固,物质具有的能量越低,该物质越稳定。另外应注意比较ΔH大小时应考虑正、负号。
7.B 图示反应物的总能量比生成物的总能量低,为吸热反应,则断裂X、Y的化学键所吸收的能量高于形成M、N的化学键所放出的能量,A错误;X、Y的总能量低于M、N的总能量,B正确;吸热反应不一定需要加热,如氢氧化钡与氯化铵晶体的反应,为常温下发生的吸热反应,C错误;无法判断X的能量是否低于M的,Y的能量是否低于N的,D错误。
8.C 依据题图分析,反应为N2H4(g)+O2(g) N2(g)+2H2O(g),反应的焓变ΔH=-534 kJ·ml-1,反应的焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,设断裂1 ml N—H键吸收的能量为x kJ,则(154+4x+500)kJ·ml-1-(942+4×452.5)kJ·ml-1=-534 kJ·ml-1,解得:x=391。
9.A 由“ΔH=反应物键能之和-生成物键能之和”可知:ΔH=(414×4+155×4-489×4-565×4) kJ·ml-1=-1 940 kJ·ml-1。
10.答案 150
解析 反应可以改成:2H2S(g)+SO2(g) 38S8(s)+2H2O(l)。根据公式:ΔH=反应物的键能总和-生成物的键能总和=4×364 kJ·ml-1+2×522 kJ·ml-1-3×266 kJ·ml-1-4×463 kJ·ml-1=-150 kJ·ml-1。
11.C 量热计通过测出中和反应反应前后的温度差,再利用公式计算得到中和反应的反应热,故选C。
12.A 为了使反应进行得更完全,可以使酸或碱适当过量,A正确;向酸(碱)中分次加入碱(酸),会导致热量损失较多,使实验误差过大,B不正确;中和反应反应热测定的实验结果与所用酸、碱的用量无关,但是与所用酸、碱的种类有关,C不正确;用铜丝代替玻璃搅拌棒,铜丝是热的良导体,造成热量散失过多,会使中和反应反应热的测定值偏小,D不正确。
13.A NaOH溶液浓度过大,稀释过程释放热量,导致测得生成1 ml液态水时的ΔH<-57.3 kJ·ml-1,A符合题意;实验时搅拌速度慢,导致热量散失较多,测得生成1 ml液态水时的ΔH>-57.3 kJ·ml-1,B不符合题意;分2~3次把NaOH溶液倒入盛有稀盐酸的小烧杯中,导致热量散失较多,测得生成1 ml液态水时的ΔH>-57.3 kJ·ml-1,C不符合题意;用量取完稀盐酸的量筒直接量取氢氧化钠溶液,氢氧化钠部分被反应,导致测得生成1 ml液态水时的ΔH>-57.3 kJ·ml-1,D不符合题意。
14.答案 (1)CH3COOH是弱酸,其电离过程会吸收热量
(2)-55.2 kJ·ml-1 (3)偏大
解析 (1)CH3COOH是弱酸,其电离过程会吸收热量,所以测得的ΔH1≠ΔH2。
(2)反应中溶液总质量约为100 g,温度变化为28.4 ℃-25.1 ℃=3.3 ℃,反应中生成水的物质的量为0.5 ml·L-1×0.05 L=0.025 ml,则该反应的ΔH1=-100×4.18×10-3× kJ·ml-1≈-55.2 kJ·ml-1。
(3)在实验过程中,温度计测定酸溶液的温度后未用水洗涤就直接测量碱溶液的温度,则会使测得的碱溶液的温度偏高,最后测定实验中温度差变小,ΔH偏大。
15.答案 (1)环形玻璃搅拌棒 (2)-53.5 kJ/ml (3)acd
解析 (1)仪器a的名称是环形玻璃搅拌棒。
(2)ΔH=-80×4.18×10-3× kJ/ml≈-53.5 kJ/ml。
(3)-57.3 kJ/ml<-53.5 kJ/ml,则ΔH偏大。a项,实验装置保温、隔热效果差,则温差偏小,ΔH偏大;b项,用量筒量取NaOH溶液的体积时仰视刻度线读数,NaOH溶液体积偏大,释放的热量偏多,ΔH偏小;c项,分多次把NaOH溶液倒入盛有硫酸的小烧杯中,在加入过程中导致热量损失,ΔH偏大;d项,用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,因温度计上附着的NaOH溶液与硫酸反应放热,导致硫酸的起始温度偏高,最终温度差值偏小,ΔH偏大。
能力提升练
1.D 由题图可知,利用太阳光在催化剂表面实现水分解为氢气和氧气,光能转化为化学能,故A正确;过程Ⅱ生成了O—O键,释放能量,B正确;该过程的总反应是水分解为氢气和氧气,C正确;由题图可知,过程Ⅲ为H2O2的分解反应,放出能量,D错误。
2.BD 图1所示的装置中没有构成闭合回路,不能将化学能转化为电能,A错误;中和反应为放热反应,因此反应物的总能量大于生成物的总能量,与图2相符,B正确;在化学反应中,释放或吸收的能量可以是电能、光能,不一定都是热能,C错误;在化学反应中,一定有旧的化学键断裂和新的化学键形成,断键吸收能量,成键释放能量,因此化学反应中能量变化的主因是化学键的断裂与形成,D正确。
3.A 由题图可知,单斜硫能量大于正交硫,则单斜硫转化为正交硫放出热量,焓变=(296.83-297.16)kJ/ml=-0.33 kJ/ml,所以S(s,单斜) S(s,正交) ΔH3=-0.33 kJ/ml,A正确;物质所含能量越低越稳定,相同物质的量的单斜硫所含能量大于正交硫所含能量,所以正交硫较稳定,B、C错误;由①可知断裂1 ml O2和1 ml单斜硫中的共价键所吸收的能量比形成1 ml SO2中的共价键所放出的能量少297.16 kJ,D错误。
4.B A项,由N2(g) 2N(g)断裂化学键,需吸收能量。B项,N(g)+3F(g) NF3(g)是形成化学键的过程,放出能量。C项,ΔH=(941.7+154.8×3-283.0×6)kJ/ml=-291.9 kJ/ml。D项,化学反应的实质是化学键的断裂和形成。
5.C 根据ΔH=反应物总键能-生成物总键能,可得ΔH=431 kJ/ml-12×436 kJ/ml-12×243 kJ/ml=+91.5 kJ/ml。
6.B 利用ΔH=反应物的键能之和-生成物的键能之和进行计算。ΔH=280 kJ·ml-1+3×160 kJ·ml-1-6×330 kJ·ml-1=-1 220 kJ·ml-1,B项正确。
反思升华
利用键能计算ΔH的方法
(1)计算公式:ΔH=反应物的总键能-生成物的总键能。
(2)利用键能计算反应热的关键是弄清物质中化学键的种类和数目。
7.B 反应热ΔH=反应物总键能-生成物总键能,所以反应P4(s)+3O2(g) P4O6(s)的反应热ΔH=6×198 kJ·ml-1+3×498 kJ·ml-1-12×360 kJ·ml-1=-1 638 kJ·ml-1。
化学键
C—H
C—F
H—F
F—F
键能/
kJ·ml-1
414
489
565
155
反应物
起始温度/℃
终了温
度/℃
中和反应
反应热/
kJ·ml-1
酸溶液
NaOH溶液
①0.5 ml·L-1 HCl溶液50 mL、0.55 ml·L-1NaOH溶液50 mL
25.1
25.1
ΔH1
②0.5 ml·L-1 CH3COOH溶液50 mL、0.55 ml·L-1 NaOH溶液50 mL
25.1
25.1
ΔH2
化学键
F—F
N—F
键能(kJ/ml)
941.7
154.8
283.0
相关试卷
这是一份人教版 (2019)选择性必修1第一节 反应热精品第1课时练习题,文件包含11反应热第1课时反应热焓变原卷版-高二化学同步素养目标精品讲义人教版选择性必修1docx、11反应热第1课时反应热焓变解析版-高二化学同步素养目标精品讲义人教版选择性必修1docx等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第一节 反应热同步练习题,共12页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份1.1.1反应热焓变寒假作业 高二化学人教版(2019)选择性必修1,共15页。试卷主要包含了单选题,共18小题,填空题,共4小题,计算题,共1小题等内容,欢迎下载使用。













