





化学选择性必修2第二节 分子晶体与共价晶体备课课件ppt
展开
这是一份化学选择性必修2第二节 分子晶体与共价晶体备课课件ppt,共18页。PPT课件主要包含了1组成微粒,分子晶体,非金属氢化物,非金属单质,非金属氧化物,物理性质,判断正误,范德华力,范德华力和氢键,分子的密堆积等内容,欢迎下载使用。
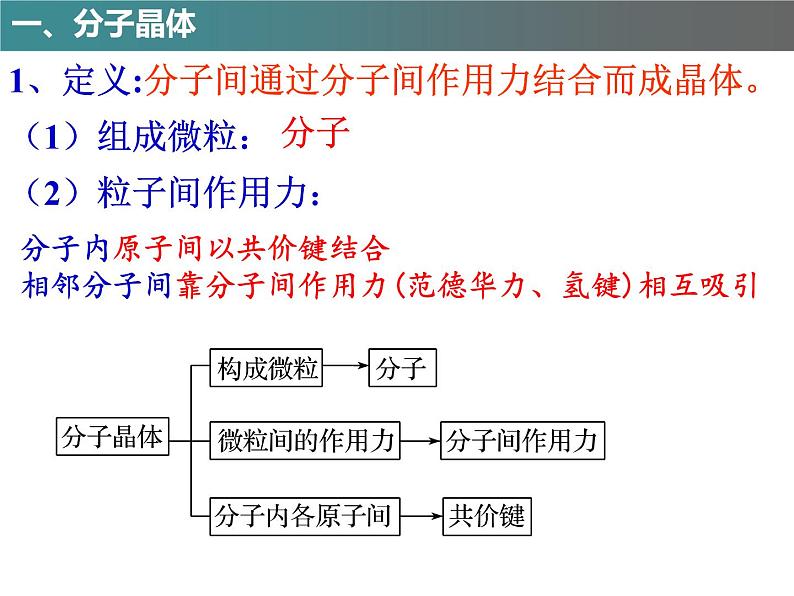
(2)粒子间作用力:
分子内原子间以共价键结合相邻分子间靠分子间作用力(范德华力、氢键)相互吸引
1、定义:分子间通过分子间作用力结合而成晶体。
2、常见的典型分子晶体 (1)所有 :如H2O、H2S、NH3、CH4、HX(卤化氢)等。 (2)部分 :如X2(卤素单质)、O2、H2、S8、P4、C60、稀有气体等。 (3)部分 :如CO2、SO2、NO2、P4O6、P4O10等。 (4)几乎所有的 :如H2SO4、HNO3、H3PO4、H2SiO3等。 (5)绝大多数有机物:如苯、四氯化碳、乙醇、冰醋酸、蔗糖等。
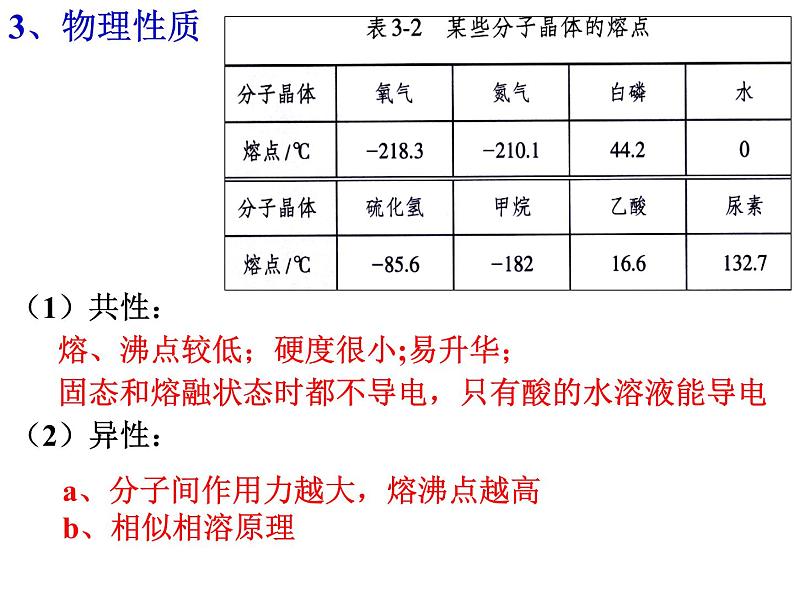
(1)共性: 熔、沸点较低;硬度很小;易升华; 固态和熔融状态时都不导电,只有酸的水溶液能导电 (2)异性:
a、分子间作用力越大,熔沸点越高 b、相似相溶原理
(1)组成分子晶体的微粒是分子,在分子晶体中一定存在共价键和分子间作用力 ( ) (2)分子晶体熔化时一定破坏范德华力,有些分子晶体还会破坏氢键 ( ) (3)分子晶体熔化或溶于水均不导电 ( ) (4)分子晶体的熔、沸点越高,分子晶体中共价键的键能越大 ( ) (5)水分子间存在着氢键,故水分子较稳定 ( ) (6)NH3极易溶于水的原因一是NH3、H2O均为极性分子,二是NH3和H2O之间形成分子间氢键 ( )
2、下列各组物质各自形成晶体,均属于分子晶体的化合物是 ( ) A.NH3、HD、C10H18 B.PCl3、CO2、H2SO4 C.SO2、C60、P2O5 D.CCl4、Na2S、H2O2
3、医院在进行外科手术时,常用HgCl2稀溶液作为手术刀的消毒剂,已知HgCl2有如下性质: ①HgCl2晶体熔点较低; ②HgCl2熔融状态下不导电; ③HgCl2在水溶液中可发生微弱电离。下列关于HgCl2的叙述中正确的是 ( ) A.HgCl2晶体属于分子晶体 B.HgCl2属于离子化合物 C.HgCl2属于电解质,且属于强电解质 D.HgCl2属于非电解质
1、分子晶体的判断方法(1)依据物质的类别判断 部分非金属单质、部分非金属氧化物、所有非金属氢化物、几乎所有的酸、绝大多数有机物都是分子晶体。(2)依据组成晶体的粒子及粒子间作用判断 组成分子晶体的微粒是分子,粒子间的作用力是分子间作用力。(3)依据物质的性质判断 分子晶体的硬度小,熔、沸点低,在熔融状态或固体时均不导电。
4、下列分子晶体的熔、沸点由高到低的顺序是( ) ①HCl ②HBr ③HF ④CO ⑤N2 ⑥H2 A.①②③④⑤⑥ B.③②①⑤④⑥ C.③②①④⑤⑥ D.⑥⑤④③②①
2.分子晶体熔、沸点高低的判断(1)组成和结构相似,不含氢键的分子晶体, 相对分子质量越大,范德华力越强,熔、沸点越高,如I2>Br2>Cl2>F2,HI>HBr>HCl。(2)组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,熔、沸点越高,如CH3OH>CH3CH3。(3)含有分子间氢键的分子晶体的熔、沸点反常升高,如H2O>H2Te>H2Se>H2S。
(4)对于有机物中的同分异构体,支链越多,熔、沸点越低,如CH3CH2CH2CH2CH3> > (5)烃、卤代烃、醇、醛、羧酸等有机物:一般随分子中碳原子数的增加,熔、沸点升高,如C2H6>CH4, C2H5Cl>CH3Cl,CH3COOH>HCOOH。
5.比较下列化合物熔、沸点的高低(填“>”或“
相关课件
这是一份化学选择性必修2第二节 分子晶体与共价晶体习题ppt课件,文件包含321分子晶体与共价晶体第1课时分子晶体习题精练-2022-2023学年高二化学同步课件精讲及习题精练人教版2019选择性必修2原卷版docx、321分子晶体与共价晶体第1课时分子晶体习题精练-2022-2023学年高二化学同步课件精讲及习题精练人教版2019选择性必修2解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体一等奖习题ppt课件,共28页。PPT课件主要包含了CO2晶体,冰晶体,分子晶体的特征和性质,分子晶体,资料链接,认识CO2晶体,分子晶体的特性,分子晶体的判断方法,分子晶体熔沸点的比较等内容,欢迎下载使用。
这是一份高中化学第二节 分子晶体与共价晶体优秀ppt课件,共20页。PPT课件主要包含了你知道吗,思考与交流,某些分子晶体的熔点,C60的晶体结构,气体分子,水分子,水分子笼是多种多样的等内容,欢迎下载使用。










