2022届高三化学高考备考一轮复习化学化学平衡图像专项训练
展开
这是一份2022届高三化学高考备考一轮复习化学化学平衡图像专项训练,共28页。试卷主要包含了单选题,原理综合题等内容,欢迎下载使用。
一、单选题(15题)
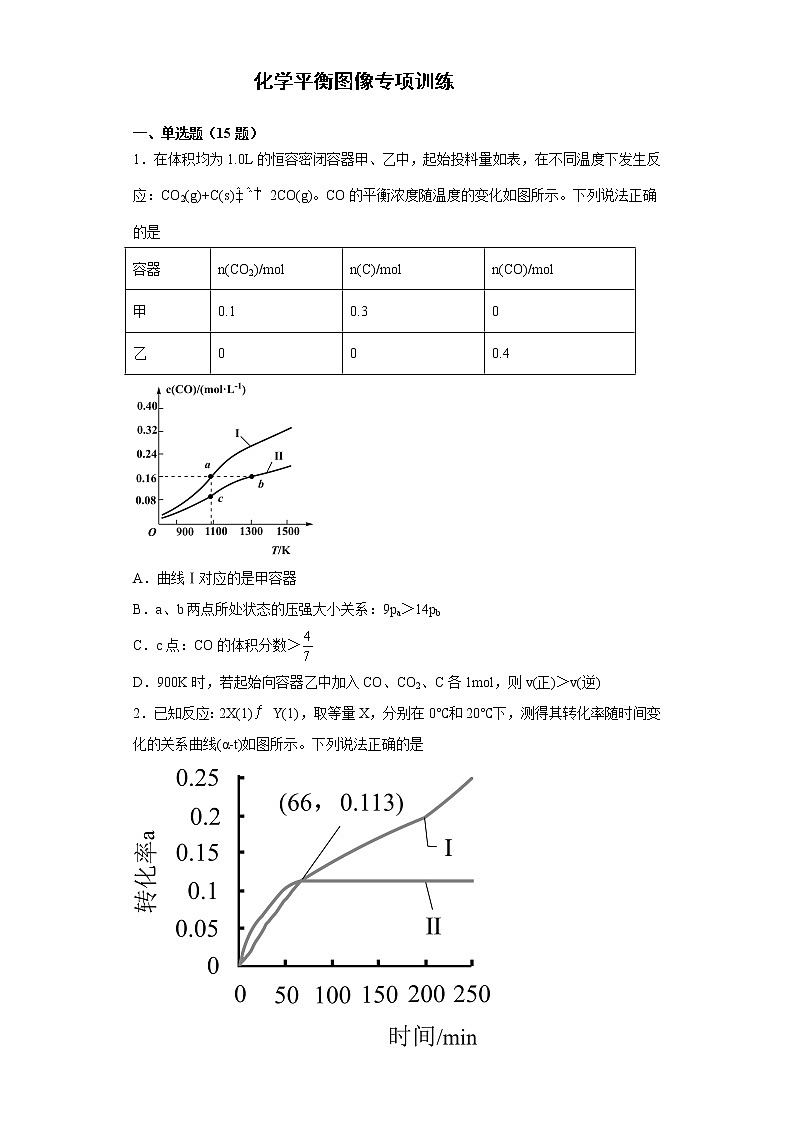
1.在体积均为1.0L的恒容密闭容器甲、乙中,起始投料量如表,在不同温度下发生反应:CO2(g)+C(s)2CO(g)。CO的平衡浓度随温度的变化如图所示。下列说法正确的是
A.曲线Ⅰ对应的是甲容器
B.a、b两点所处状态的压强大小关系:9pa>14pb
C.c点:CO的体积分数>
D.900K时,若起始向容器乙中加入CO、CO2、C各1ml,则v(正)>v(逆)
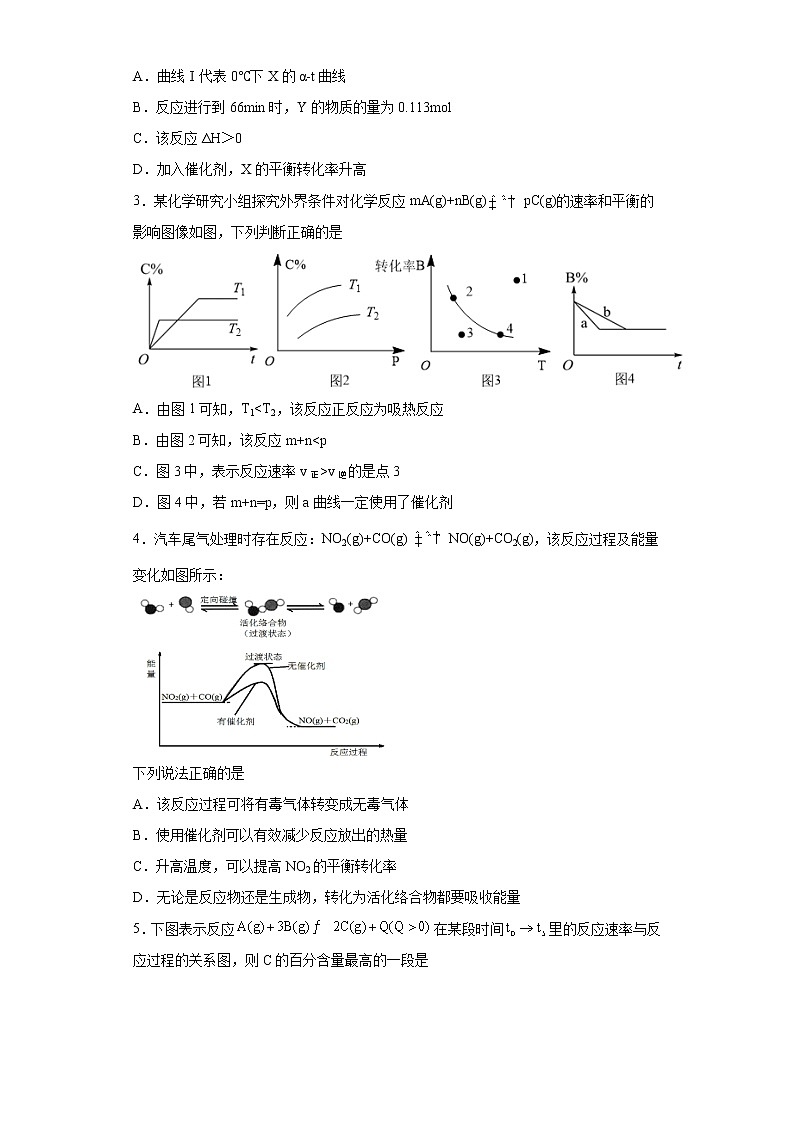
2.已知反应:2X(1)Y(1),取等量X,分别在0℃和20℃下,测得其转化率随时间变化的关系曲线(α-t)如图所示。下列说法正确的是
A.曲线Ⅰ代表0℃下X的α-t曲线
B.反应进行到66min时,Y的物质的量为0.113ml
C.该反应ΔH>0
D.加入催化剂,X的平衡转化率升高
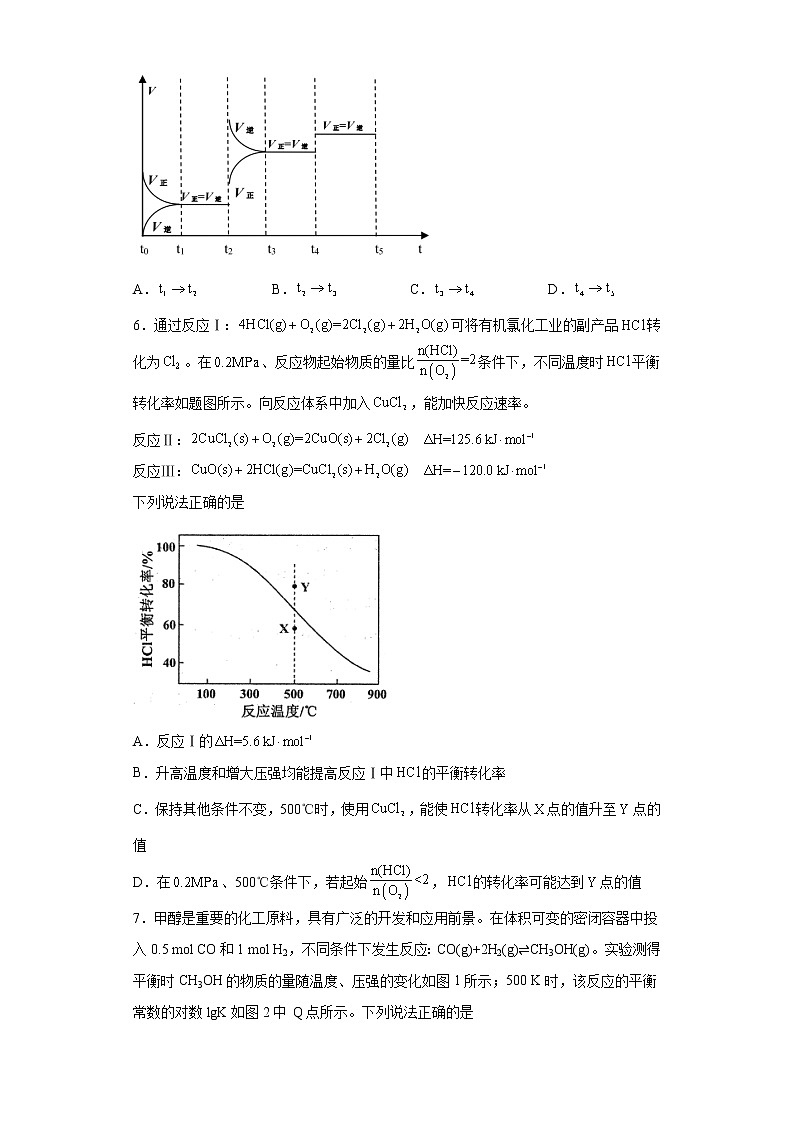
3.某化学研究小组探究外界条件对化学反应mA(g)+nB(g)pC(g)的速率和平衡的影响图像如图,下列判断正确的是
A.由图1可知,T10,故反应在高温下自发。
(2)
利用氢气与二氧化碳催化反应合成乙烯,是实现低碳转型的一条途径。在0.1MPa、120℃条件下,以的投料比充入体积固定的密闭容器中,发生反应:,平衡时水蒸气的物质的量百分数为50.0%。请回答:
①反应的平衡常数表达式为或;故答案为:或。
②以的投料比充入体积固定的密闭容器中,假设分解加入4ml氢气和1ml二氧化碳,达到平衡时,建立三段式,,解得x= ,的转化率为;故答案为:68.2%。
(3)
①根据总反应和第二步反应得到第一步反应为;故答案为:。
②A.反应Ⅰ是快速放热,反应Ⅱ是慢速吸热,说明反应Ⅰ的活化能小于反应Ⅱ,且,故A错误;B.增大氨碳比有利于提高尿素产率,过量氨气与反应Ⅱ生成的水反应,促进平衡正移,会生成更多的尿素,故B正确;C.实际生产中若选择曲线a,氨碳比在4.0时二氧化碳转化率已经很大,再提高氨碳比,虽然二氧化碳转化率增大,但氨气经济价值比二氧化碳经济价值大,因此增大氨碳比不划算,因此氨碳比应控制在4.0左右,故C正确;D.根据总反应增加水碳比,可以理解为二氧化碳量不变,水的量增大,平衡逆向移动,二氧化碳转化率减小,因此根据图像得到曲线a的水碳比小于曲线b,减小水碳比,水蒸气量减少,有利于平衡正向移动,利于尿素生成,故D错误;综上所述,答案为:BC。
③如果某催化剂可以同等程度地加速反应Ⅰ和Ⅱ,反应速率加快,生成氨基甲酸铵达到最高值时间缩短,短时间放出的热量大,使得温度较高,平衡正向移动,因此生成氨基甲酸铵的量比原来增加,因此加入该催化剂后从0h到t1时的氨基甲酸铵物质的量变化曲线 ;故答案为: 。
19.
(1)-90.8
(2) 吸收 原料气中N2相对易得,适度过量有利于提高H2的转化率 N2在催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率 BD
(3) > 0.05
(4)2NH+2e-=2 NH3+H2↑或2NH3+2e-=H2↑+2NH
【解析】
(1)
根据表中键能数据,可得∆H=反应物的键能总和-生成物的键能总和=946.0 kJ·ml-1+436.0 kJ·ml-1-390.8 kJ·ml-16=-90.8 kJ/ml。
(2)
i.根据模拟示意图可知,图②到图③的过程表示的是化学键断裂的过程,化学键断裂需要吸收热量,所以该过程表示的是吸热过程。
ii.原料中N2相对H2易得,且合成氨反应是可逆反应,适度N2过量有利于提高H2的转化率,N2在催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率。
iii.A.合成氨反应是可逆的放热反应,根据勒夏特列平衡移动原理,升高温度并不能提高平衡转化率,但能加快化学反应速率和提高催化剂活性,故A错误;
B.由于NH3有较强的分子间作用力,可将其液化,不断将液氨移去,有利于化学平衡向正反应方向移动,故B正确;
C.当温度、体积一定时,在原料气中添加少量惰性气体,并不能改变N2和H2的浓度,并不利于提高平衡转化率,故C错误;
D.制备原料气过程中会产生其他气体杂质,为了防止催化剂中毒和安全事故发生,因此原料气须经过净化处理,故D正确;
答案BD。
(3)
i.合成氨反应是放热反应,温度越高,混合物中氨的物质的量分数越低,所以M点对应的温度小于N点对应的温度,温度越高,平衡常数越小,故KM>KN。
ii.由M点的坐标可知此时总压是50MPa,氨的物质的量分数是60。由投入氮气和氢气的物质的量比是1︰3,它们反应时N2(g)+3H2(g)⇌2NH3(g),消耗的物质的量比也是1︰3,所以平衡时剩余的氮气和氢气的物质的量比也是1:3。则混合气体中剩余的40分子中,N2分子10,H2分子占30,则根据分压=总压×物质的量分数,可得P(N2)= 50MPa10=5 MPa,P(H2)= 50MPa=15 MPa ,P(NH3) ==30 MPa,则Kp= 。
(4)
用Pt电极对液氨进行电解,阴极发生还原反应,则移向阴极的阳离子NH或NH3分子得电子被还原成氢气,则阴电极反应式为2NH+2e-=2 NH3+H2↑或2NH3+2e-=H2↑+2NH。
相关试卷
这是一份备考2024届高考化学一轮复习强化训练第七章化学反应速率和化学平衡第5讲化学反应速率与化学平衡的图像专项训练_多反应平衡体系,共8页。试卷主要包含了3 kJ·ml-1,1 等内容,欢迎下载使用。
这是一份2023-2024届高三化学高考备考一轮复习化学平衡计算专项训练,共24页。试卷主要包含了单选题,原理综合题等内容,欢迎下载使用。
这是一份2024届高三化学高考备考一轮复习训练--化学反应速率与化学平衡,共25页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。










