

高中化学人教版 (2019)选择性必修2第二节 分子的空间结构第1课时学案
展开
这是一份高中化学人教版 (2019)选择性必修2第二节 分子的空间结构第1课时学案,共15页。学案主要包含了分子结构的测定,多样的分子空间结构,价层电子对互斥模型等内容,欢迎下载使用。
必备知识·自主学习
一、分子结构的测定
1.分子结构的最早测定方法:早年的科学家主要靠对物质的化学性质进行系统总结得出规律,再推测分子的结构。
2.现代的分子结构测定方法:科学家应用红外光谱、晶体X射线衍射等现代仪器方法测定分子的结构。
3.红外光谱工作原理
(1)原理:红外线透过分子时,分子会吸收跟它的某些化学键振动频率相同的红外线,再记录到图谱上呈现吸收峰。通过和已有谱图库比对,或通过量子化学计算,可以得知分子中含有何种化学键或官能团的信息。
(2)红外光谱仪原理示意图
4.质谱法:相对分子质量的测定
用高能电子流轰击样品分子,使分子失去电子变成带正电荷的分子离子和碎片离子。分子离子和碎片离子各自具有不同的相对质量,它们在磁场的作用下到达检测器的时间因相对质量而先后有别,其结果被记录为质谱图。
如甲苯分子的质谱图:
读谱:相对分子质量=最大质荷比,甲苯的相对分子质量为92。
(1)(思维升华)红外光谱可以推断化学键或官能团的种类,能否确认化学键或官能团的个数?
提示:不能。
(2)未知物质A的质谱图为
由图可看出,质荷比的最大值是该物质的相对分子质量,知该物质的相对分子质量是多少?
提示:16。
二、多样的分子空间结构
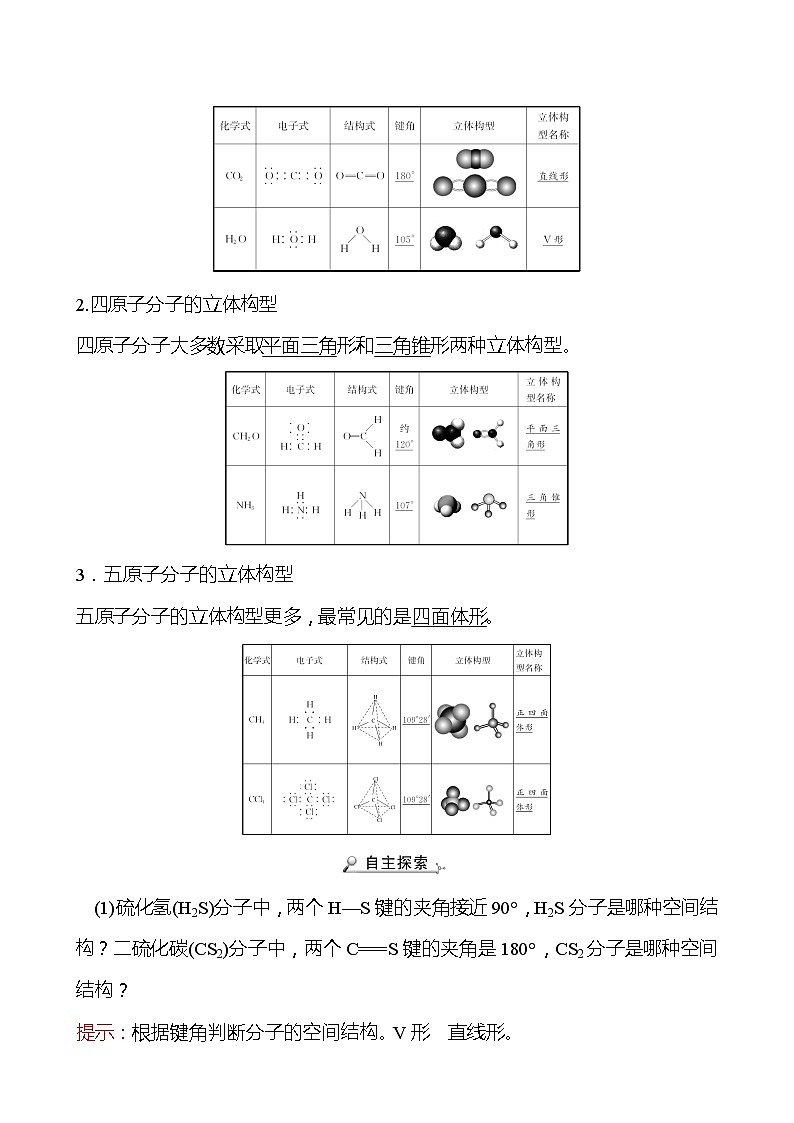
1.三原子分子的立体构型
三原子分子的立体构型有直线形和V形两种。
2.四原子分子的立体构型
四原子分子大多数采取平面三角形和三角锥形两种立体构型。
3.五原子分子的立体构型
五原子分子的立体构型更多,最常见的是四面体形。
(1)硫化氢(H2S)分子中,两个H—S键的夹角接近90°,H2S分子是哪种空间结构?二硫化碳(CS2)分子中,两个C===S键的夹角是180°,CS2分子是哪种空间结构?
提示:根据键角判断分子的空间结构。V形 直线形。
(2)(情境思考)科学家研制出可望成为高效火箭推进剂的N(NO2)3如图所示。
已知该分子中N—N—N键角都是108.1°,试推测四个氮原子围成的空间是空间正四面体吗?
提示:不是。由于N—N—N键角都是108.1°,所以四个氮原子围成的空间不是正四面体而是三角锥形。
三、价层电子对互斥模型
1.价层电子对互斥模型:
分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。
2.价层电子对:
VSEPR的“价层电子对”是指分子中中心原子与结合原子间的σ键电子对和中心原子上的孤电子对。
3.价层电子对确定方法:
价层电子对数=σ键电子对数+中心原子的孤电子对数。其中,σ键电子对数=B原子的个数(以ABx型分子为例,σ键电
子对数=x),孤电子对数= eq \f(1,2) (a-xb)
(1)a表示中心原子的价电子数。
对于主族元素:a=原子的最外层电子数。
对于阳离子:a=中心原子的价电子数-离子的电荷数。
对于阴离子:a=中心原子的价电子数+离子的电荷数(绝对值)。
(2)x表示与中心原子结合的原子数。
(3)b表示与中心原子结合的原子最多能接受的电子数,氢为1,其他原子=8-该原子的价电子数。
4.VSEPR模型与分子或离子的空间结构:
σ键电子对数+孤电子对数=价层电子对数VSEPR模型分子或离子的空间结构。
【想一想】将下列VSEPR模型、分子或离子和立体构型用短线连起来:
VSEPR模型 分子或离子 立体构型
A.正四面体 ①BF3 a.直线形
B.直线形 ②NH eq \\al(\s\up1(+),\s\d1(4)) b.平面三角形
C.平面三角形 ③SO eq \\al(\s\up1(2-),\s\d1(3)) c.正四面体
D.四面体 ④BeCl2 d.三角锥形
提示:A—②—c,B—④—a,C—①—b,D—③—d
关键能力·合作学习
知识点 利用价层电子对互斥模型判断分子或离子的空间结构
1.价层电子对互斥模型要点:
(1)对于ABx型分子中,几何构型主要取决于中心原子A价层电子对的相互排斥。价层电子对数=σ键电子对数+中心原子的孤电子对数。
(2)中心原子的价层电子对数和立体构型的关系
(3)价层电子对之间相互排斥作用大小
孤电子对—孤电子对>孤电子对—成键电子对>成键电子对—成键电子对
2.用价层电子对互斥模型判断共价分子或离子立体构型
(1)确定中心原子的价层电子对数
①对于ABx型分子,σ键电子对=B原子的个数,如H2O的中心原子是O,有2对σ键电子对。
②中心原子上的孤电子对数= eq \f(1,2) (a-xb),其中a为中心原子的价电子数,x为B原子的个数,b为B最多能接受的电子数。
③对于阳(或阴)离子来说,a为中心原子的价电子数减去(或加上)离子的电荷数。
④中心原子价层电子对数=σ键电子对数+中心原子的孤电子对数
(2)根据中心原子价层电子对数确定VSEPR模型
(3)略去孤电子对,确定分子构型
3.价层电子对之间的斥力大小
(1)由于孤电子对比成键电子对更靠近中心原子的原子核,因而价层电子对之间的斥力大小顺序:孤电子对与孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对与成键电子对之间的斥力。
(2)孤电子对数越多,与成键电子对斥力越大,成键原子所形成的键角越小。例如H3O+和H2O键角大小,H3O+中O只有一个孤电子对,而H2O中O有两个孤电子对,所以H3O+的键角大于H2O分子的键角。
(3)结构相同的物质,元素的电负性越大,吸引电子的能力越强,成键电子对距离中心原子较近,成键电子对之间的斥力越大,键角越大。例如NH3、PH3、AsH3中,中心原子都是sp3杂化,都有1对孤电子对,NH3分子的中心原子N的电负性大,成键电子对距离中心原子较近,键角越大,所以这三种物质键角由大到小的顺序为NH3>PH3>AsH3。
(1)(思维升华)BCl3、NF3的价层电子对数、VSEPR模型、分子空间结构是怎样的?
提示:BCl3的价层电子对数有3对,VSEPR模型为平面三角形,分子空间结构为平面三角形;NF3的价层电子对数为4对,VSEPR模型为四面体形,分子空间结构为三角锥形。
(2)VSEPR模型与分子的空间结构一定相同吗?二者之间有何规律存在?
提示:VSEPR模型与分子的空间结构不一定一致,分子的空间结构指的是成键电子对的空间结构,不包括孤电子对(未用于形成共价键的电子对)。两者是否一致取决于中心原子上有无孤电子对,当中心原子上无孤电子对时,两者的空间结构一致;当中心原子上有孤电子对时,两者的空间结构不一致。
【典例】用价层电子对互斥模型可以判断许多分子或离子的空间结构,有时也能用来推测键角大小,下列判断正确的是( )
A.SO eq \\al(\s\up1(2-),\s\d1(3)) 中心原子的价层电子对数为3,是三角锥形结构
B.BF3键角为120°,SnBr2的键角大于120°
C.CH2O是平面三角形的分子
D.PCl3、PCl5都是三角锥形的分子
【思维建模】解答有关分子构型问题的思维流程如下:
【解析】选C。SO eq \\al(\s\up1(2-),\s\d1(3)) 的中心原子的价层电子对数为4,成键电子对数为3,孤电子对数是1,A错误;BF3分子中心原子价层电子对数=3+ eq \f(1,2) (3-3×1)=3,是平面三角形结构,键角为120°,SnBr2是V形结构,键角小于120°,B错误;CH2O是平面三角形的分子,C正确;PCl3是三角锥形的分子,PCl5分子中心原子价层电子对数=5+ eq \f(1,2) (5-5×1)=5,孤电子对数是0,是三角双锥结构,D错误。
利用价层电子对互斥模型判断分子或离子的空间结构规律
(1)若ABn型分子中,A与B之间通过两对或三对电子(即通过双键或三键)结合而成,只计算构成σ键的电子对数。
(2)价层电子对之间相互排斥作用大小的一般规律:孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对。孤电子对数越多,对成键电子对的排斥力越大,键角也减小。如CH4、NH3和H2O分子中的键角依次减小。
【母题追问】CH2O是平面正三角形吗?
提示:不是。CH2O是等腰三角形。
硼砂有广泛的用途,可用作清洁剂、化妆品、杀虫剂,也可用于配制缓冲溶液和制取其他硼化合物等。市售硼砂往往已经部分风化。硼砂毒性较高,世界各国多禁用其作食品添加物。人体若摄入过多的硼,会引发多脏器的蓄积性中毒。硼砂是含结晶水的四硼酸钠,以硼砂为原料,可以得到BF3、BN和硼酸等重要化合物,请根据模型回答有关问题:
(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示,则在Xm-中的2号硼原子的价层电子对数为________;m=________(填数字)。
(2)硼可以与氮形成BN,其中B的化合价为________,请解释原因:____________________________。
(3)BF3和过量NaF作用可生成NaBF4,BF eq \\al(\s\up1(-),\s\d1(4)) 的空间结构为________;NaBF4的电子式为________________________________________。
提示:(1)根据图示可知,2号B原子的价层电子对数为3,且无孤电子对;根据图示可知,该阴离子的化学式为[H4B4O9]m-,其中H显+1价,B显+3价、O显-2价,所以m=2。(2)由于电负性:N>B,所以BN中B显+3价。(3)BF eq \\al(\s\up1(-),\s\d1(4)) 的空间结构为正四面体形,NaBF4的电子式为。
答案:(1)3 2
(2)+3 N的电负性大于B的电负性
(3)正四面体形
三言两语话重点
1.分子结构测定的两种方法:
(1)红外光谱仪测定化学键或官能团信息。
(2)质谱法测定分子的相对分子质量。
2.必记的三个等量关系(以ABx型分子为例)
(1)价层电子对数=σ键电子对数+中心原子的孤电子对数
(2)σ键电子对数=B原子的个数
(3)孤电子对数= eq \f(1,2) (a-xb)
3.五种常见的空间结构
(1)直线形:孤电子对数为零
(2)V形:孤电子对数为1或2
(3)平面三角形:孤电子对数为零
(4)三角锥形:孤电子对数为1
(5)正四面体形:孤电子对数为零
课堂检测·素养达标
1.下列关于分子的空间结构及价层电子对互斥模型(VSEPR模型)的叙述中不正确的是( )
A.可以通过红外光谱推断乙醇分子中含有碳碳键、碳氧键及碳氢键及羟基官能团
B.分子中价电子对相互排斥决定了分子的空间结构
C.中心原子上的孤电子对也要占据中心原子周围的空间并互相排斥
D.分子中键角越大,价电子对相互排斥力越大,分子越稳定
【解析】选D。红外光谱可以测定分子中化学键及官能团,A正确;空间结构与价电子对相互排斥有关,所以分子中价电子对相互排斥决定了分子的空间结构,B正确;中心原子上的孤电子对也要占据中心原子周围的空间并互相排斥,且孤电子对间的排斥力>孤电子对和成键电子对间的排斥力,C正确;分子的稳定性与键角没有关系,D错误。
2.(2021·岳阳高二检测)用价层电子对互斥模型(VSEPR)可以预测许多分子或离子的空间结构,有时也能用来推测键角大小,下列判断错误的是( )
A.SO2、HI都是直线形的分子
B.NO eq \\al(\s\up1(-),\s\d1(3)) 为平面三角形分子
C.BF3、SO3都是平面三角形的分子
D.NCl3是三角锥形的分子
【解析】选A。SO2中价层电子对数=2+ eq \f(1,2) ×(6-2×2)=3且含有1对孤电子对,所以SO2为V形结构,HI为直线形结构,A错误;NO eq \\al(\s\up1(-),\s\d1(3)) 中N原子的价层电子对数=3+ eq \f(1,2) ×(5-2×3+1)=3,没有孤电子对,空间结构为平面三角形,B正确;BF3、SO3中中心原子价层电子对数都是3且不含孤电子对,所以这两种分子都是平面三角形结构,C正确;NCl3中价层电子对数=3+ eq \f(1,2) ×(5-3×1)=4,且含有1对孤电子对,所以NCl3为三角锥形结构,D正确。
3.下列分子或离子的中心原子上未用于成键的价电子对最多的是( )
A.H2O B.HCl C.NH eq \\al(\s\up1(+),\s\d1(4)) D.PCl3
【解析】选A。A项氧原子有两对未成键的价电子对;B项HCl分子属于AB型分子,没有中心原子;C项NH eq \\al(\s\up1(+),\s\d1(4)) 的中心原子的价电子全部参与成键;D项磷原子有一对未成键的价电子对。
【补偿训练】
下列分子或离子的中心原子,带有一对孤电子对的是( )
A.H2O B.BeCl2 C.CH4 D.PCl3
【解析】选D。四种物质的电子式依次为。H2O有两对孤电子对,BeCl2和CH4没有孤电子对,PCl3有一对孤电子对。
4.(2021·青岛高二检测)下列各组分子中所有原子都可能处于同一平面的是( )
A.CH4、CS2、BF3 B.CO2、H2O、NH3
C.C2H4、C2H2、C6H6 D.CCl4、BeCl2、PH3
【解析】选C。CH4和CCl4为正四面体形分子,NH3和PH3为三角锥形分子,这几种分子中所有原子不可能都在同一平面上。CS2、CO2、C2H2和BeCl2为直线形分子,C2H4为平面形分子,C6H6为平面正六边形分子,这些分子中所有原子都处于同一平面。
5.(教材二次开发·教材习题改编)下列分子或离子中,中心原子的价层电子对的空间结构为正四面体形且分子或离子的空间结构为V形的是( )
A.NO eq \\al(\s\up1(-),\s\d1(2)) B.PH3
C.H3O+ D.OF2
【解析】选D。NO eq \\al(\s\up1(-),\s\d1(2)) 空间结构呈直线形,A错误;PH3为三角锥形,B错误;H3O+空间结构呈三角锥形,C错误;OF2中心原子的价层电子对的空间结构为正四面体形且分子或离子的空间结构为V形,D正确。
6.(2021·衡水高二检测)下列叙述正确的是( )
A.CH4中C—H间的键角为109°28′,NH3中N—H间的键角为107°,H2O中O—H间的键角为105°,说明孤电子对与成键电子对间的斥力大于成键电子对与成键电子对间的斥力
B.SO eq \\al(\s\up1(2-),\s\d1(4)) 的立体结构是正四边形
C.BF3分子中各原子均达到8e-稳定结构
D.CH eq \\al(\s\up1(+),\s\d1(3)) 的立体结构是三角锥形
【解析】选A。孤电子对与成键电子对间的斥力大于成键电子对与成键电子对间的斥力,A正确;SO eq \\al(\s\up1(2-),\s\d1(4)) 的立体结构是正四面体形,B错误;B原子不满足8e-稳定结构,C错误;CH eq \\al(\s\up1(+),\s\d1(3)) 的立体结构是平面三角形,D错误。
【补偿训练】
下列粒子的价层电子对数正确的是(点“·”的原子为中心原子)( )
A.C,·H4 4 B.C,·O2 1
C.B,·F3 2 D.S,·O3 2
【解析】选A。CH4中,n= eq \f(4+1×4,2) =4,A正确;CO2中,n= eq \f(4+0×2,2) =2,B错误;BF3中,n= eq \f(3+1×3,2) =3,C错误;SO3中,n= eq \f(6+0×3,2) =3,D错误。
素养新思维
7.通常,不同的分子具有不同的空间构型。例如C60是足球形状、S8分子像皇冠等。
(1)四原子分子都为平面三角形或三角锥形吗?
提示:不是。H2O2分子的构型类似于一本打开的书,两个氧原子在两页书的交接处,两个氢原子分别在翻开的书的两页上;白磷(P4)分子为正四面体形。
(2)立体构型相同的分子,其键角完全相同吗?
提示:不一定。如P4和CH4均为正四面体形,但P4的键角是60°,CH4的键角为109°28′。
(3)根据价层电子对互斥模型,判断SCl2的VSEPR模型和SCl2的立体构型。
提示:四面体形、V形。分子或
离子
孤电子
对数
价层电
子对数
VSEPR
模型名称
分子或离子的
空间结构名称
CO2
0
2
直线形
直线形
SO2
1
3
平面三角形
V形
CO eq \\al(\s\up1(2-),\s\d1(3))
0
3
平面三角形
平面三角形
H2O
2
4
四面体形
V形
NH3
1
4
四面体形
三角锥形
CH4
0
4
正四面体形
正四面体形
价层电
子对数
2
3
4
5
6
立体
构型
直线形
平面三
角形
正四面体
三角双锥
正八面体









