

高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质第3课时学案
展开
这是一份高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质第3课时学案,共7页。
一、电负性
1.有关概念与意义
(1)键合电子:元素相互化合时,原子中用于形成化学键的电子称为键合电子。
(2)电负性:用来描述不同元素的原子对键合电子吸引力的大小。电负性越大的原子,对键合电子的吸引力越大。
(3)电负性大小的标准:以氟的电负性为4.0和锂的电负性为1.0作为相对标准。
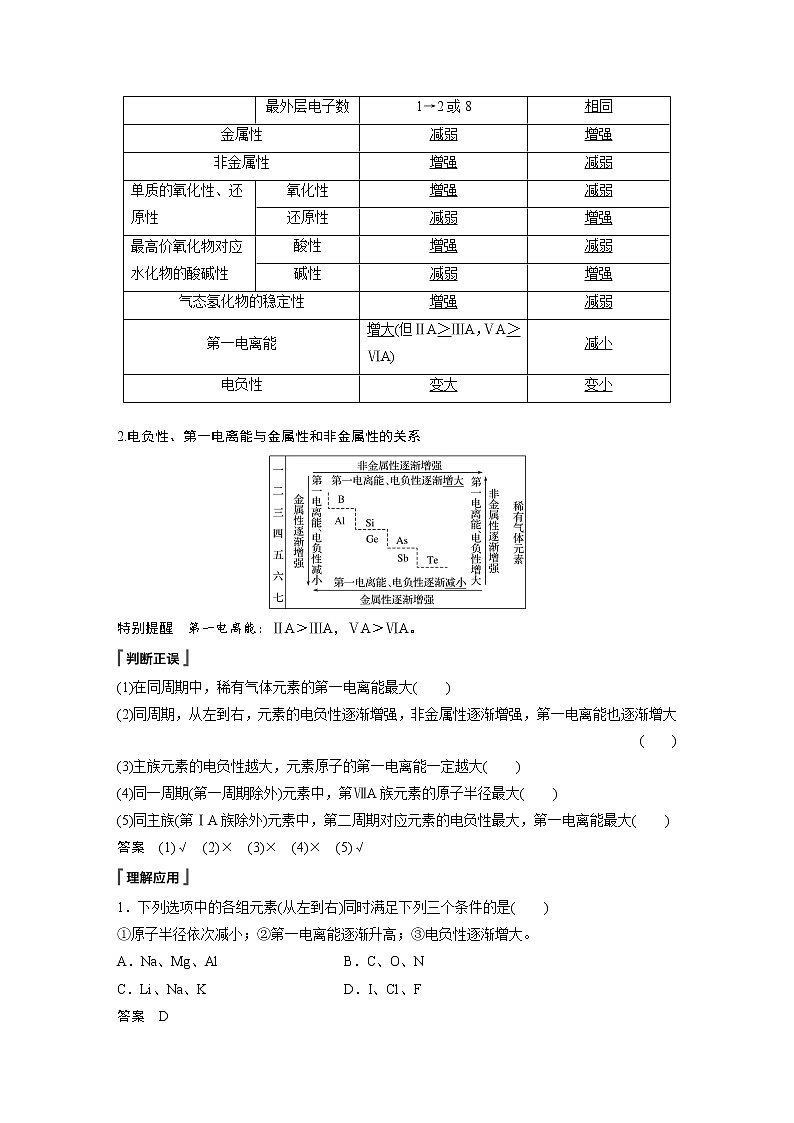
2.递变规律
(1)同周期,自左到右,元素的电负性逐渐增大,元素的非金属性逐渐增强、金属性逐渐减弱。
(2)同主族,自上到下,元素的电负性逐渐减小,元素的金属性逐渐增强、非金属性逐渐减弱。
3.应用
(1)判断元素的金属性和非金属性强弱
①金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性,又有非金属性。
②金属元素的电负性越小,金属元素越活泼;非金属元素的电负性越大,非金属元素越活泼。
(2)判断元素的化合价
①电负性数值小的元素在化合物中吸引电子的能力弱,元素的化合价为正值。
②电负性数值大的元素在化合物中吸引电子的能力强,元素的化合价为负值。
(3)判断化合物的类型
如H的电负性为2.1,Cl的电负性为3.0,Cl的电负性与H的电负性之差为3.0-2.1=0.9Al,P>S,①错误;同周期主族元素从左到右,电负性逐渐增大,②正确;同周期主族元素从左到右,原子半径逐渐减小,③错误;对于电子层结构相同的离子,原子序数越大,离子半径越小,同周期金属元素形成的简单阳离子半径从左到右逐渐减小,④错误;Na→Cl,最高正化合价由+1→+7,⑤正确;同周期主族元素形成简单离子转移的电子数,从左到右,金属元素逐渐增多,非金属元素逐渐减少,⑥错误。综上可知,D项正确。
1.下列各元素电负性大小顺序正确的是( )
A.K>Na>Li B.F>O>S
C.As>P>N D.C>N>O
答案 B
解析 K、Na、Li为同主族元素,从下到上电负性逐渐增强,应为KS>P,不能说明X元素的非金属性比Y元素强,C正确;电负性是元素的原子在化合物中吸引电子的能力的标度,非金属性强的电负性大,能说明X元素的非金属性比Y元素强,D错误;判断物质熔、沸点高低先看晶体类型,不能说明X元素的非金属性比Y元素强,E正确;水溶液的酸性:HCl>HF 、HCl> H2S,而非金属性ClS,不能说明X元素的非金属性比Y元素强,F正确;X与Y形成的化合物YmXn中X元素显负价,可以说明X元素的非金属性比Y元素强,G错误。
6.元素的电负性(用γ表示)和元素的化合价一样,也是元素的一种性质。下表给出了14种元素的电负性:
已知:两成键元素间电负性差值大于1.7时,一般形成离子键;两成键元素间电负性差值小于1.7时,一般形成共价键。
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是________________________________________________________________________
________________________________________________________________________。
(2)估计钙元素的电负性的取值范围:________
相关学案
这是一份高中化学人教版 (2019)选择性必修2第一章 原子结构与性质第二节 原子结构与元素的性质第3课时学案,共7页。
这是一份高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质第3课时导学案,共7页。
这是一份高中化学第3节 烃第2课时学案










