
2021学年第2节 几种简单的晶体结构模型精品导学案
展开1.金属晶体
(1)金属原子通过金属键形成的晶体称为金属晶体。
(2)金属键是指金属阳离子和自由电子之间的强的相互作用。
(3)由于自由电子为整个金属所共有,所以金属键没有方向性和饱和性,因此可以看做等径圆球的堆积。
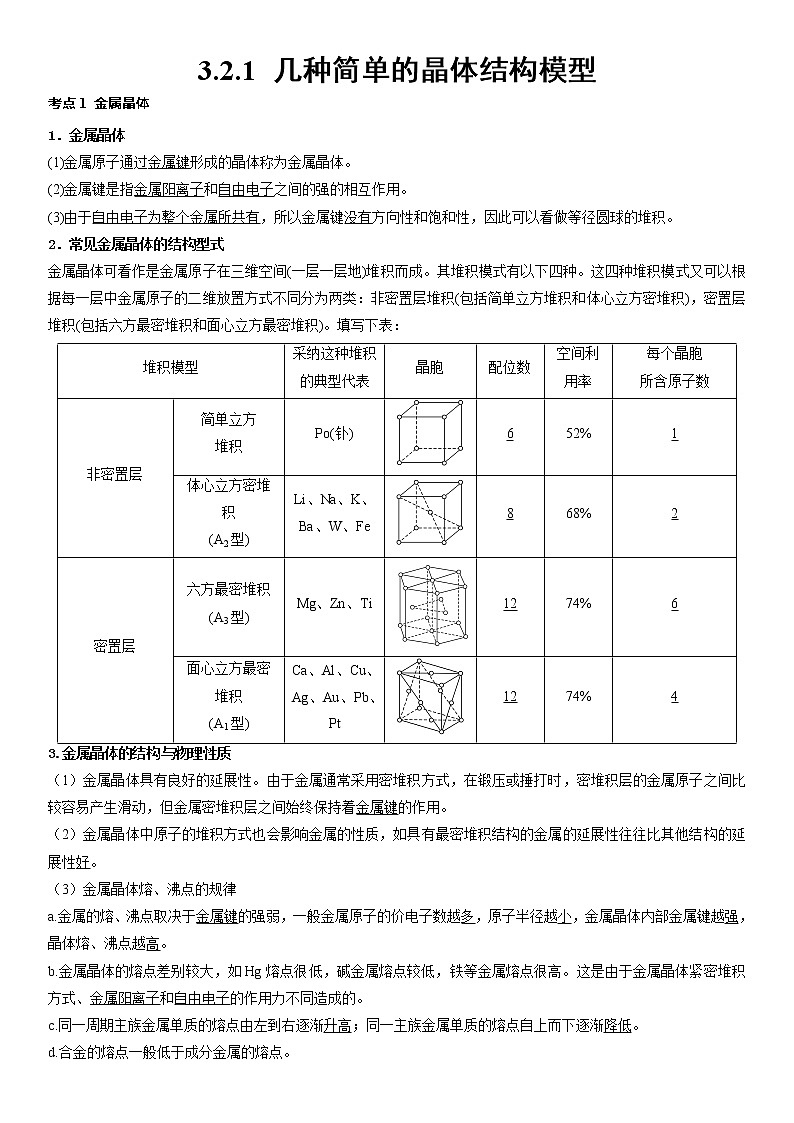
2.常见金属晶体的结构型式
金属晶体可看作是金属原子在三维空间(一层一层地)堆积而成。其堆积模式有以下四种。这四种堆积模式又可以根据每一层中金属原子的二维放置方式不同分为两类:非密置层堆积(包括简单立方堆积和体心立方密堆积),密置层堆积(包括六方最密堆积和面心立方最密堆积)。填写下表:
3.金属晶体的结构与物理性质
(1)金属晶体具有良好的延展性。由于金属通常采用密堆积方式,在锻压或捶打时,密堆积层的金属原子之间比较容易产生滑动,但金属密堆积层之间始终保持着金属键的作用。
(2)金属晶体中原子的堆积方式也会影响金属的性质,如具有最密堆积结构的金属的延展性往往比其他结构的延展性好。
(3)金属晶体熔、沸点的规律
a.金属的熔、沸点取决于金属键的强弱,一般金属原子的价电子数越多,原子半径越小,金属晶体内部金属键越强,晶体熔、沸点越高。
b.金属晶体的熔点差别较大,如Hg熔点很低,碱金属熔点较低,铁等金属熔点很高。这是由于金属晶体紧密堆积方式、金属阳离子和自由电子的作用力不同造成的。
c.同一周期主族金属单质的熔点由左到右逐渐升高;同一主族金属单质的熔点自上而下逐渐降低。
d.合金的熔点一般低于成分金属的熔点。
考点2离子晶体
离子晶体
(1)概念:阴、阳离子通过离子键结合而形成的晶体。
(2)结构特点:
①构成微粒:阴离子和阳离子,离子晶体中不存在单个分子。
②微粒间的作用力:离子键。
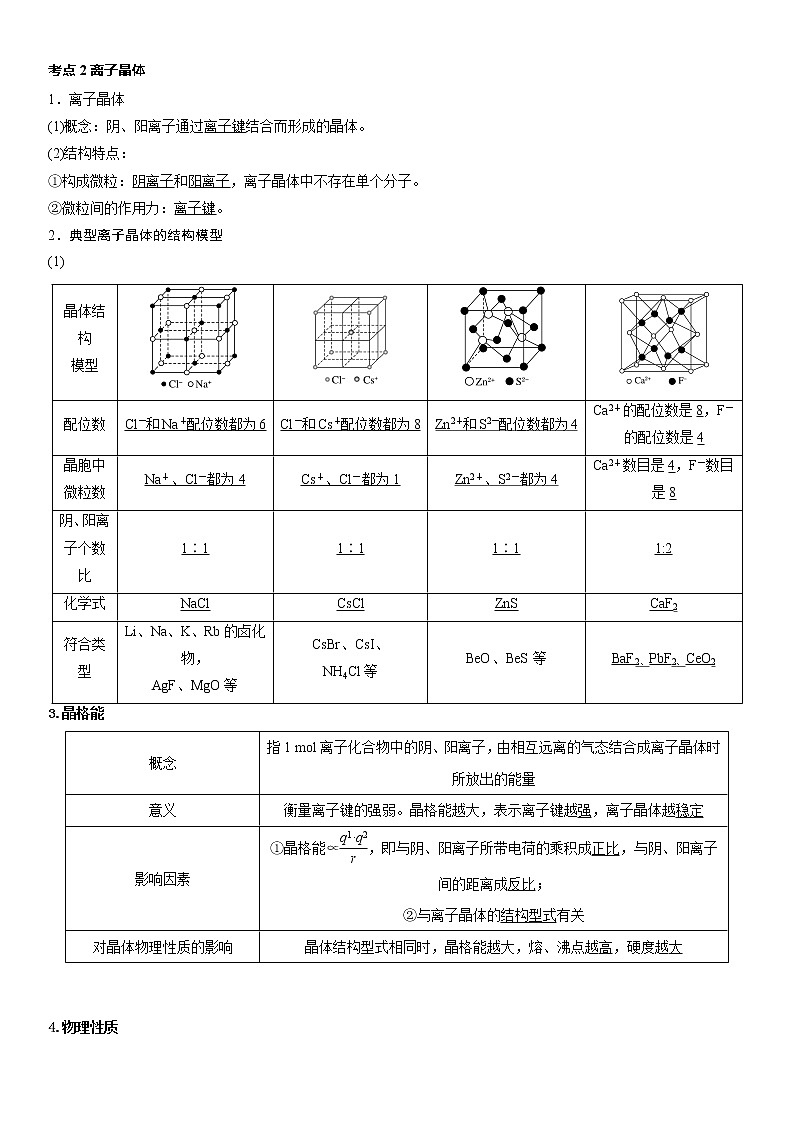
2.典型离子晶体的结构模型
(1)
3.晶格能
4.物理性质
例题精析
【例题1】金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷的多少及半径大小相关。由此判断下列说法正确的是( )
A.金属镁的硬度大于金属铝 B.碱金属单质的熔、沸点从Li到Cs逐渐增大
C.金属镁的熔点大于金属钠 D.金属镁的硬度小于金属钙
【答案】C
【例题2】金属的下列性质中和金属晶体无关的是( )
A.良好的导电性 B.反应中易失电子
C.良好的延展性 D.良好的导热性
【答案】B
【例题3】金属晶体中金属原子有三种常见的堆积方式,a、b、c分别代表这三种晶胞的结构,其晶胞a、b、c内金属原子个数比为( )
A.3∶2∶1 B.11∶8∶4
C.9∶8∶4 D.21∶14∶9
【答案】A
【例题4】下列说法中正确的是( )
A.固态能导电的晶体一定是金属晶体
B.固态不能导电,水溶液能导电的晶体一定是离子晶体
C.熔融状态能导电的晶体一定是离子晶体
D.固态不导电而熔融态能导电的晶体一定是离子晶体
【答案】D
【例题5】根据表格数据回答下列有关问题:
(1)已知NaBr、NaCl、MgO等离子晶体的核间距离和晶格能如下表所示:
①NaBr晶体比NaCl晶体晶格能____(填“大”或“小”),主要原因是___________。
②MgO晶体比NaCl晶体晶格能大,主要原因是_____________________________。
③NaBr、NaCl和MgO晶体中,熔点最高的是________。
(2)Cu2O的熔点比Cu2S的_________(填“高”或“低”),请解释原因:____________________________。
(3)NaF的熔点______(填“>”“<”或“=”)BFeq \\al(-,4)的熔点,其原因是_____________________________________________________________。
【答案】(1)①小 NaBr比NaCl离子的核间距大 ②氧化镁晶体中的阴、阳离子的电荷数绝对值大,并且离子的核间距小 ③MgO
(2)高 O2-半径小于S2-的半径, Cu2O的离子键强于Cu2S的离子键,所以Cu2O的熔点比Cu2S的高
(3)> 两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低
【例题6】(1)元素铜的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是___________。
(2)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。
(3)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,如图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为________,该功能陶瓷的化学式为____________。
(4)某晶体结构模型如图所示。该晶体的化学式是____________,在晶体中1个Ti原子、1个C原子周围距离最近的O原子数目分别为_______个、______个。
【答案】(1)CuCl (2)16 (3)2 BN (4)CTiO3 6 12
课堂运用
【基础】
1.下列说法中,不正确的是( )
A.金属晶体中一定含有金属键 B.在含有阳离子的化合物的晶体中,一定含有阴离子
C.含有金属元素的离子不一定是阳离子 D.金属晶体中原子的堆积方式都是最密堆积
2.下列性质适合于离子晶体的是( )
A.熔点1 070 ℃,易溶于水,水溶液能导电
B.熔点10.31 ℃,液态不导电,水溶液能导电
C.能溶于CS2,熔点112.8 ℃,沸点444.6 ℃
D.熔点97.81 ℃,质软,导电,密度0.97 g·cm-3
3.氟在自然界中常以CaF2的形式存在。下列关于CaF2的表述正确的是( )
A.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
B.F-的半径小于Cl-,则CaF2的熔点低于CaCl2
C.阴、阳离子数目之比为2∶1的物质,均与CaF2晶体构型相同
D.Ca2+与F-间只存在静电吸引
4.下列关于NaCl晶体结构的说法中正确的是( )
A.NaCl晶体中,阴、阳离子的配位数相等 B.NaCl晶体中,每个Na+周围吸引1个Cl-
C.NaCl晶胞中的质点代表一个NaCl D.NaCl晶体中存在单个的NaCl分子
5.关于晶格能的叙述中正确的是( )
A.晶格能是气态原子形成1 ml离子晶体所释放的能量
B.晶格能仅与形成晶体的离子半径有关
C.晶格能是指相邻的离子间的静电作用
D.晶格能越大的离子晶体,其熔点越高、硬度越大
【巩固】
1.列关于金属晶体的叙述正确的是( )
A.钙的熔、沸点低于钾
B.常温下,金属单质都以晶体形式存在
C.含有阳离子的化合物晶体,不一定含有阴离子
D.金属离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
2.下列物质的熔点依次升高的是( )
A.Mg、Na、K B.Na、Mg、Al
C.Na、Rb、Ca D.铝、铝硅合金
3.下列大小关系正确的是( )
A.晶格能:NaCl
C.熔点:NaI>NaBr D.熔、沸点:KCl>NaCl
4.碱金属卤化物是典型的离子晶体,它们的晶格能与eq \f(1,d0)成正比(d0是晶体中最邻近的异电性离子的核间距)。下列说法错误的是( )
A.晶格能的大小与离子半径成反比
B.阳离子相同阴离子不同的离子晶体,阴离子半径越大,晶格能越小
C.阳离子不同阴离子相同的离子晶体,阳离子半径越小,晶格能越大
D.金属卤化物晶体中,晶格能越小,氧化性越强
【拔高】
1.铜和金可形成合金,请回答下列问题:
(1)金属铜采取如图所示的堆积方式,可称为________________堆积,则Cu晶体中Cu原子的配位数为________。
(2)元素金(Au)处于周期表中的第6周期,与Cu同族,Au原子最外层电子排布式为________;一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为________;该晶体中,原子之间的作用力是________,若该晶胞的边长为a cm,则该合金密度为______ g·cm-3(阿伏加德罗常数的值为NA)。
(3)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为________。
2.铜及其化合物具有广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子的基态核外电子排布式为 ,S、O、N三种元素的第一电离能由大到小的顺序为 。
(2)Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NH3中心原子的杂化轨道类型为 ,[Cu(NH3)4](NO3)2中存在的化学键除了极性共价键外,还有 。
(3)CuSO4溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1 ml CN-中含有的π键数目为 (用NA表示阿伏加德罗常数的值)。与CN-互为等电子体的离子有 (写出一种即可)。
(4)CuSO4的熔点为560 ℃,Cu(NO3)2的熔点为115 ℃,CuSO4熔点更高的原因可能是 。
(5)已知Cu2O晶胞结构如图所示,该晶胞离子坐标参数A为(0,0,0),B为(1,0,0),C为(,,),则D离子的坐标参数为 ,它代表 (填离子符号)。
(6)金属铜是面心立方最密堆积方式,则晶体中铜原子的配位数是 ,每个晶胞中Cu原子的空间利用率是 。
答案:
【基础】
1.D 2. A 3.A 4.A 5.D
【巩固】
1.D 2.B 3.B 4.D
【拔高】
1. (1)面心立方最密 12 (2)6s1 3∶1 金属键 eq \f(389,NAa3) (3)H8AuCu3
2.((1)1s22s22p63s23p63d9或[Ar]3d9 N>O>S (2)sp3 配位键、离子键 (3)2NA (4)CuSO4和Cu(NO3)2均为离子晶体,S所带电荷比N多,故CuSO4的晶格能较大,熔点较高 (5)(,,) Cu+ (6)12 74%
堆积模型
采纳这种堆积的典型代表
晶胞
配位数
空间利
用率
每个晶胞
所含原子数
非密置层
简单立方
堆积
P(钋)
6
52%
1
体心立方密堆积
(A2型)
Li、Na、K、Ba、W、Fe
8
68%
2
密置层
六方最密堆积(A3型)
Mg、Zn、Ti
12
74%
6
面心立方最密堆积
(A1型)
Ca、Al、Cu、Ag、Au、Pb、Pt
12
74%
4
晶体结构
模型
配位数
Cl-和Na+配位数都为6
Cl-和Cs+配位数都为8
Zn2+和S2-配位数都为4
Ca2+的配位数是8,F-的配位数是4
晶胞中
微粒数
Na+、Cl-都为4
Cs+、Cl-都为1
Zn2+、S2-都为4
Ca2+数目是4,F-数目是8
阴、阳离子个数比
1∶1
1∶1
1∶1
1:2
化学式
NaCl
CsCl
ZnS
CaF2
符合类型
Li、Na、K、Rb的卤化物,
AgF、MgO等
CsBr、CsI、
NH4Cl等
BeO、BeS等
BaF2、PbF2、CeO2
概念
指1 ml离子化合物中的阴、阳离子,由相互远离的气态结合成离子晶体时所放出的能量
意义
衡量离子键的强弱。晶格能越大,表示离子键越强,离子晶体越稳定
影响因素
①晶格能∝eq \f(q1·q2,r),即与阴、阳离子所带电荷的乘积成正比,与阴、阳离子间的距离成反比;
②与离子晶体的结构型式有关
对晶体物理性质的影响
晶体结构型式相同时,晶格能越大,熔、沸点越高,硬度越大
熔、沸点
较高
硬度
较大,但较脆
溶解性
一般水中易溶,非极性溶剂中难溶
导电性
固态时不导电,熔融状态或在水溶液中能导电
NaBr
NaCl
MgO
离子的核间距/pm
290
276
205
晶格能/kJ·ml-1
787
3 890
晶格能/kJ·ml-1
离子半径/pm
①
LiF LiCl LiBr LiI
1 031 845 807 752
Li+ Na+ K+
60 95 133
②
NaF NaCl NaBr NaI
915 787 736 686
F- Cl- Br- I-
136 181 195 216
③
KF KCl KBr KI
812 699 689 632
高中化学鲁科版 (2019)选择性必修2第3章 不同聚集状态的物质与性质第2节 几种简单的晶体结构模型第2课时学案设计: 这是一份高中化学鲁科版 (2019)选择性必修2第3章 不同聚集状态的物质与性质第2节 几种简单的晶体结构模型第2课时学案设计,共9页。
鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型学案: 这是一份鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型学案,共9页。
化学选择性必修2第2节 几种简单的晶体结构模型学案: 这是一份化学选择性必修2第2节 几种简单的晶体结构模型学案,共11页。学案主要包含了金属晶体,离子晶体等内容,欢迎下载使用。













