





所属成套资源:【新教材】高中化学苏科版选择性必修2同步精品课件
苏教版 (2019)选择性必修2第三单元 共价键 共价晶体课前预习课件ppt
展开
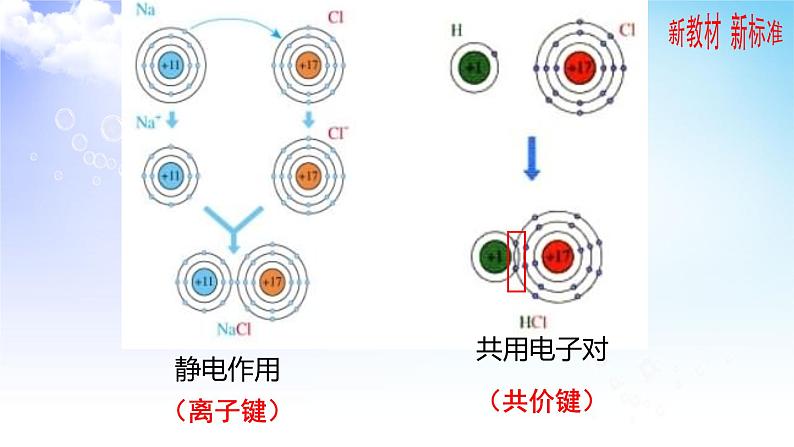
这是一份苏教版 (2019)选择性必修2第三单元 共价键 共价晶体课前预习课件ppt,共19页。PPT课件主要包含了氯化钠晶体,氯化氢气体,静电作用,离子键,共用电子对,共价键,共价键的形成过程,共价键的特征,共价键的饱和性,共价键的方向性等内容,欢迎下载使用。
思考:NaCl和HCl都是氯化物,为什么物理性质存在差异呢?
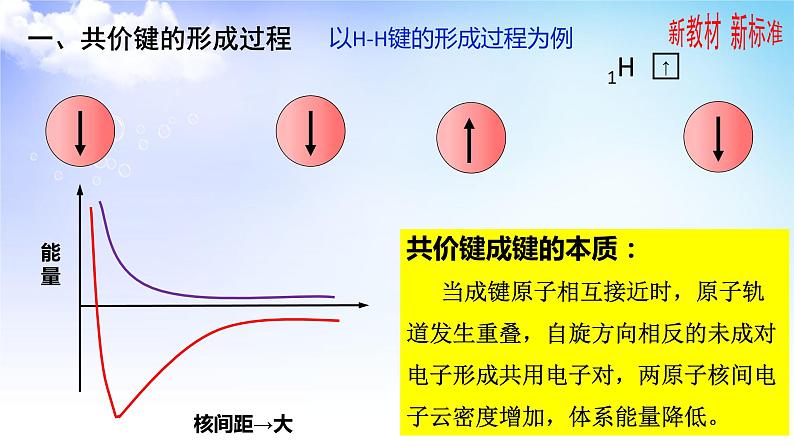
以H-H键的形成过程为例
共价键成键的本质: 当成键原子相互接近时,原子轨道发生重叠,自旋方向相反的未成对电子形成共用电子对,两原子核间电子云密度增加,体系能量降低。
形成的共价键数 =未成对电子数
在成键过程中,每种元素的原子有几个未成对电子通常就只能形成几个共价键,所以在共价分子中每个原子形成共价键数目是一定的。
在形成共价键时,两个参与成键的原子轨道总是尽可能沿着电子出现机会最大的方向重叠成键,而且原子轨道重叠越多,电子在两核间出现的机会越多,体系的能量下降也就越多,形成的共价键越牢固。
按照共用电子对是否发生偏移
①s-s型(H2的形成)
s轨道与s轨道重叠形成的共价键无方向性
(以H2、HCl、Cl2的形成过程为例)
②s-p型(HCl的形成)
③p-p型(Cl2的形成)
σ键:原子轨道以“头碰头”的方式重叠,重叠后电子云形状为轴对称。
π键:原子轨道以“肩并肩”的方式重叠,重叠后电子云形状为镜面对称。
分析氮气的形成过程,讨论氮气中氮原子的原子轨道是如何重叠形成共价键的。
π键不能单独存在,可存在双键或三键中。
氮气分子含有1个σ键和2个π键。
1.σ键(“头碰头”)
2.π键(“肩并肩”)
重叠程度小,能量较高,易断裂。
重叠程度大,能量较低,不易断裂。
乙烷: 个σ键 乙烯: 个σ键 个π键 乙炔: 个σ键 个π键
共用电子对不发生偏移的共价键。
2. 极性键和非极性键
共用电子对发生偏移的共价键
①一般情况下: 同种元素原子 →非极性共价键 不同种元素原子→极性共价键。
②极性共价键成键原子电负性差值越大,共用电子对的偏移程度越大,共价键的极性越强。
思考:NH3与H+是如何形成NH4+的?
由一个原子提供一对电子与另一个接受电子对的原子形成共价键,这类共价键称为配位键.
表示:常用“→ ”表示配位键,箭头指向接受孤电子对的原子。
相关课件
这是一份人教版 (2019)选择性必修2第一节 共价键说课课件ppt,共37页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
这是一份苏教版 (2019)选择性必修2第三单元 共价键 共价晶体公开课ppt课件,共20页。PPT课件主要包含了先变小后变大,共价键的本质,共价键的形成条件,共价键的表示方法,共价键的类型,活动与探究,σ键和π键的比较,强度大不易断裂,强度较小易断裂,有机物中的共价键等内容,欢迎下载使用。
这是一份高中化学苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第三单元 盐类的水解多媒体教学课件ppt,共17页。PPT课件主要包含了盐类的水解,水解的特点,水解的规律,课堂练习等内容,欢迎下载使用。










