





青岛专版中考化学总复习第一部分主题八物质的构成课件鲁教版
展开这是一份青岛专版中考化学总复习第一部分主题八物质的构成课件鲁教版,共44页。PPT课件主要包含了主题八物质的构成,考点梳理过关,原子的构成,原子结构的稳定性,辨一辨►,想一想►,构成物质的粒子,相对原子质量,元素符号,元素周期表等内容,欢迎下载使用。
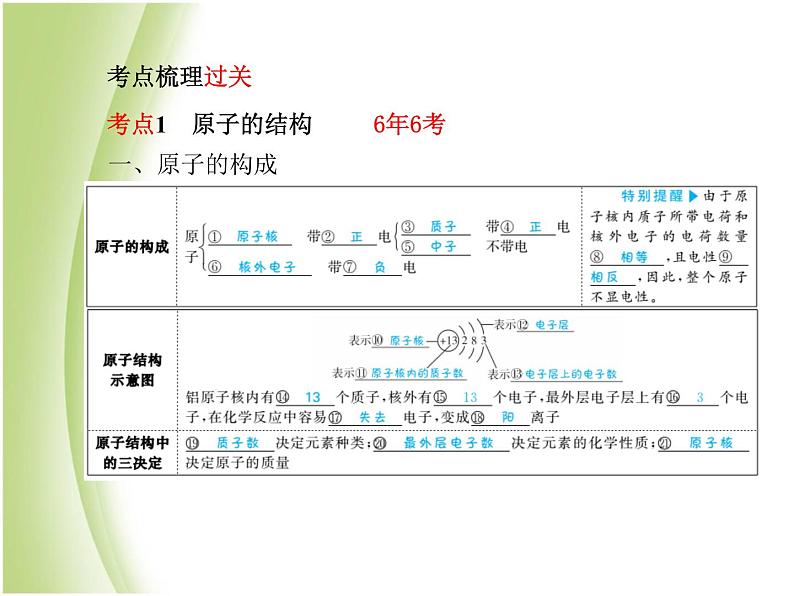
考点1 原子的结构 6年6考
1.原子中一定含有中子。 ( × )2.同种原子,原子核内的质子数与中子数不一定相等。( √ )3.不同的原子,原子核内的质子数不同,中子数可能相同。 ( √ )4.分子一定比原子大。 ( × )5.原子是最小的粒子。 ( × )
几千万年前地球上的一条恐龙体内某个原子有可能在你身体里吗?为什么?
有可能,因为化学变化过程中,原子不发生改变。
1.最外层是8个电子结构的原子一定是稳定结构。( √ )2.稳定结构的原子最外层一定是8个电子。 ( × )3.最外层电子数相等的原子一定具有相似的化学性质。( × )
由图示分析,原子变成离子,哪些方面没有变化,哪些方面发生了变化?
考点2 元素、元素符号和元素周期表 6年6考
一、元素1.元素的概念
2.元素与原子之间的关系
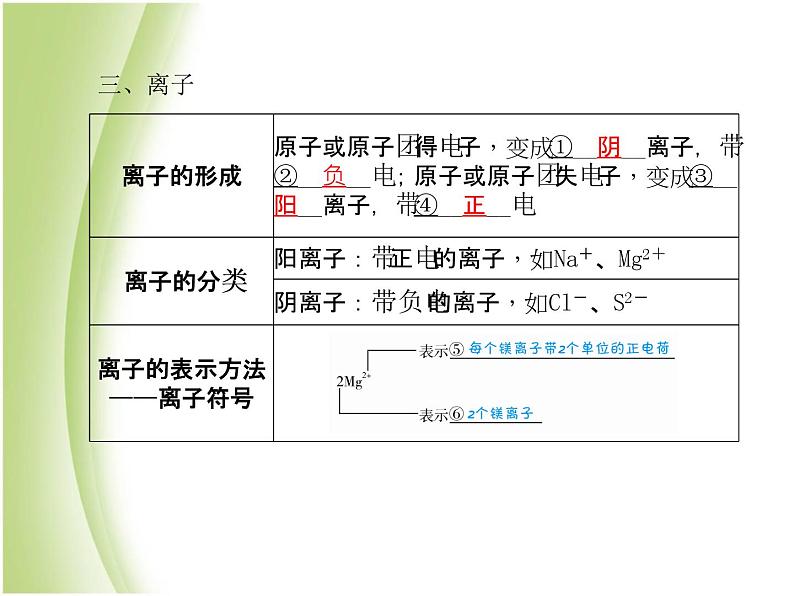
1.使用元素符号、化学式等化学用语,是为了增加化学科学的神秘色彩。 ( × )2.不同种元素最本质的区别是电子数不同。 ( × )3.同种元素的原子,核电荷数一定相同;而核电荷数相同的粒子不一定属于同种元素。 ( √ )4.同种元素的离子因所带的电荷数不同,性质也不同,如Fe2+和Fe3+。 ( √ )
类型1 元素、元素符号和元素周期表
认识元素周期表中的信息,明确元素周期表中的规律是掌握该考点的关键。(1)由元素周期表中的一格获取的信息有元素名称、原子序数、元素符号、相对原子质量。可判断元素的种类:金属元素,带“钅”字旁(汞、金除外);非金属元素,带“石”字旁、“氵”字旁和“气”字头。可进行相关计算:质子数=核电荷数=原子序数=核外电子数;中子数≈相对原子质量-质子数。(2)元素周期表中的规律:周期表中同一横行的元素,原子的电子层数相同;周期表中同一纵行的元素,原子最外层电子数相同,电子层数逐渐增多;同一周期(第一层除外)最外层电子数由1逐渐递增至8,由金属元素开始过渡到非金属元素再以稀有气体元素结束。
【例1】 [2016·北京中考]铬在元素周期表中信息如右图所示,下列有关铬元素的说法正确的是( A )A.原子序数是24B.属于非金属元素C.一个铬原子核外有28个电子D.相对原子质量为52.00g
思路点拨►由元素周期表中的信息可知,铬的原子序数为24;铬元素带“钅”字旁,属于金属元素;在原子中,原子序数=质子数=核外电子数,所以铬原子核外有24个电子;相对原子质量的单位是“1”而不是“g”,通常省略不写。
变式运用►1.[2017·邵阳中考]2017年5月9日,中国科学院发布了113号、115号、117号及118号四种元素的中文名称,其中一种元素在元素周期表中的信息如图所示,下列有关该元素说法错误的是( )A.相对原子质量为288 B.核内有115个质子C.是非金属元素 D.核内有173个中子
C 由元素周期表一格“镆元素”的相关性质可知,镆元素的相对原子质量为288,A正确;在原子中质子数等于原子序数,镆元素为115号元素,因而其核内的质子数为115,B正确;由“镆”元素的元素名称可知,该元素为金属元素,C错误;相对原子质量≈质子数+中子数,因而镆原子的中子数≈288-115=173,D正确。
2.[2017·连云港中考]右图是元素周期表的一部分。下列说法正确的是( )A.硼为金属元素 B.碳的原子序数是12.01C.铝是地壳中含量最高的元素 D.三种原子中质量最大的是铝
D 根据所学知识和题中信息知,硼为非金属元素,故A错误;碳的原子序数是6,故B错误;铝不是地壳中含量最高的元素,故C错误;三种原子中质量最大的是铝,故D正确。
【例2】 [2017·威海中考]学习完“原子的构成”之后,萍萍同学形成了以下认识,其中错误的是( C )A.原子由居于中心的原子核和核外电子构成B.核外电子在离核远近不同的区域中运动C.原子核的质量和电子的质量相差不大D.原子核的体积与整个原子的体积相比要小很多
思路点拨►原子由居于中心的原子核和核外电子构成;核外电子在离核远近不同的区域中运动,同一区域内,电子的能量相近;原子核由质子和中子构成,一个质子的质量约等于一个中子的质量,都是一个电子质量的1836倍;原子核在原子中所占体积极小,其半径约为原子半径的十万分之一。
变式运用►3.[2017·泰州中考]科学家最近研发出用铝镓合金制备氧气的新工艺。镓原子的质子数为31,相对原子质量为70,则稼原子的核外电子数为( )A.31 B.39 C.70 D.101
A 因为在原子中,核电荷数=质子数=核外电子数,由题意知镓原子的质子数为31,则镓原子的核外电子数为31,故选A。
(1)明确元素种类由原子核内质子数决定。(2)元素的化合价由原子得失电子的数目决定,得几个电子即为负几价,失几个电子即为正几价。(3)金属元素最外层电子数少于4个,在化学反应中易失去电子,变成阳离子;非金属元素最外层电子数多于或等于4个,在化学反应中易得到电子,变成阴离子。(4)在原子中,核电荷数=核外电子数;在离子中,如果核电荷数>核外电子数,则为阳离子,如果核电荷数<核外电子数,则为阴离子。
类型3 原子结构示意图
【例3】 [2017·成都中考]如图是X、Y两种微粒的结构示意图。下列说法正确的是( D )A.X为原子,Y为离子B.X、Y均属于非金属元素C.X在反应中可失去6个电子D.X与Y形成化合物的化学式为YX
思路点拨►X、Y的质子数=核外电子总数,所以都为原子;金属元素一般带有“钅”字旁,Y镁属于金属元素;X的最外层电子数大于4,容易得电子;X为氧元素、Y为镁元素,形成化合物的化学式为MgO,即为YX。解题方法►原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层。若最外层电子数≥4,在化学反应中易得到电子,若最外层电子数<4,在化学反应中易失去电子。
变式运用►4.[2017·福建中考]模型是联系宏观与微观的桥梁。(1)右图是钠原子结构示意图。①x的数值为__8__。②“11”指的是__钠原子的质子数为11(合理即可)__。③钠原子在化学反应中易失去1个电子,形成__Na+__(填离子符号)。(2)下图是氢分子和氧分子运动的示意图。①在A、B和C中,能比较得出“温度越高,分子运动速率越快”的是__BC__(填标号)。
②从图中可见,影响分子运动速率的因素除温度外,还与__分子种类(合理即可)__有关。③举一个能说明“温度升高,分子运动速率加快”的生活事例:__湿衣服在阳光下比在阴凉处干得快(合理即可)__。
(1)①根据钠元素的核电荷数为11,可知钠原子的核外电子数=核内质子数=11,可以计算出x=8;②由钠原子的结构示意图可知,“11”是指钠原子的质子数为11,或钠原子的核电荷数为11;③钠原子在化学反应中易失去1个电子,钠原子有11个质子,只剩10个电子,形成带一个单位正电荷的阳离子,符号为Na+;(2)①分析图示可知,AB对比可以得出相同温度下分子越小运动速率越快,BC对比可知温度越高,分子运动速率越快;②由图知影响分子运动速率的因素有分子种类(或分子大小等)和温度;③能说明“温度升高,分子运动速率加快”的生活常见的事例是湿衣服在阳光下比在阴凉处干得快。
【例4】下列物质由离子构成的是( B ) A.蒸馏水 B.氯化钠C.金刚石 D.C60
思路点拨►蒸馏水由水分子构成;氯化钠由钠离子和氯离子构成;金刚石由碳原子构成;C60由C60分子构成。
类型4 物质的构成
变式运用►5.[2017·沈阳中考]下列由分子构成的是( ) A.水 B.镁 C.金刚石 D.氢氧化钠
A 水由水分子构成;镁由镁原子构成;金刚石由碳原子构成;氢氧化钠由钠离子和氢氧根离子构成。
命题点1 原子的结构
1.[2017·青岛]已知元素周期表中第三周期各元素原子结构示意图如下,下列分析错误的是( )
B 题图中原子的核外都有三个电子层;Na+和Mg2+的核外电子数相同,都是10;Na与S形成化合物的化学式为Na2S;在化学反应中氯原子容易得到电子。
A.以上原子的核外都有三个电子层B.Na+和Mg2+的核外电子数不相同C.Na与S形成化合物的化学式为Na2SD.在化学反应中氯原子容易得到电子
B 铁由铁原子构成;氯化钠由钠离子和氯离子构成;二氧化碳由二氧化碳分子构成;金刚石由碳原子直接构成。
2.[2017·青岛]下列物质中,由离子构成的是( )A.铁 B.氯化钠C.二氧化碳 D.金刚石
B 铝是由铝原子构成的;氢气是由氢分子构成的;金刚石是由碳原子构成的;氯化钠是由钠离子和氯离子构成的。
3.[2016·青岛]下列物质中,由分子构成的是( )A.铝 B.氢气 C.金刚石 D.氯化钠
B 在原子中,质子数=核外电子数,因为碘元素的原子核外电子数是53,故碘元素的原子核内质子数也是53。
4.[2014·青岛]人体必需的微量元素——碘(I),具有“智力元素”之称。健康成人体内的碘元素含量为25mg~53mg。已知碘元素的原子核外电子数为53,则原子核内质子数为( )A.28 B.53 C.74 D.103
C 在原子中,质子数与核外电子数相等;而在离子中因电子的得失使之与质子数不相等,其中阳离子中核外电子数<质子数,阴离子中核外电子数>质子数。A项中质子数=核外电子数,是原子;B项中质子数=核外电子数,是原子;C项中质子数>核外电子数,是阳离子;D项中质子数<核外电子数,是阴离子。
5.[2012·青岛]下列粒子结构示意图中表示阳离子的是( )
A 金属于金属单质,是由金原子直接构成的;氧气属于气态非金属单质,是由氧分子构成的;二氧化硫是由二氧化硫分子构成的;食盐是氯化钠的俗称,是由钠离子和氯离子构成的。
6.[2012·青岛]下列物质由原子直接构成的是( )A.金 B.氧气C.二氧化硫 D.食盐
猜押预测►1.[2017·西宁中考]下图A、B是两种粒子的结构示意图,回答下列问题。(1)若A是某阴离子的结构示意图,则x可能是下列中的__a__(填字母序号)。 a.8 b.10 c.11 d.12(2)若B表示某原子的结构示意图,则y=__7__。 (3)若A中x=12,则A、B所表示的元素形成化合物的名称为__氯化镁__。
7.[2016·青岛]青岛是一座美丽的滨海城市,海洋资源非常丰富。如图为海水中富含的钠元素和氯元素在元素周期表中的部分信息,下列有关说法不正确的是( )A.氯是一种非金属元素B.钠元素的相对原子质量是22.99C.钠原子的中子数为11D.氯元素的原子序数为17
命题点2 元素、元素符号和元素周期表
C 氯元素的偏旁是“气”,可见氯属于非金属元素,A正确;根据元素周期表中的一格获取的信息可知,钠原子的相对原子质量为22.99,B正确;根据元素周期表中的一格获取的信息可知,钠元素的原子序数为11,即核内质子数为11,而不是中子数,C错误;根据元素周期表中的一格获取的信息可知,氯元素的原子序数为17,D正确。
C 原子的核外电子层数等于该元素所处的周期数,由于镁原子与硫原子具有相同的核外电子层数,所以镁元素与硫元素属于同一周期;原子在形成离子的过程中改变的是核外电子数,而核内质子数不发生改变,所以镁离子的核内质子数还是12;硫原子的最外层电子数为6,大于4,在化学反应中容易得到两个电子;由图中元素周期表的信息可知,硫元素的原子序数为16。
8.[2015·青岛]根据下图有关信息判断,下列说法错误的是( )A.在元素周期表中,镁元素和硫元素属于同一周期B.镁离子核内有12个质子C.在化学反应中,硫原子容易失去2个电子D.硫元素的原子序数为16
C 豆类、动物肝脏中的“铁”、“锌”不是以单质、分子、原子等形式存在的,这里所指的“铁”、“锌”强调的是存在的元素,与具体形态无关。
9.[2015·青岛]豆类、动物肝脏中含有丰富的铁和锌,这里的“铁”、“锌”是指( )A.原子 B.分子 C.元素 D.单质
C 同一纵行属于同一族,故铍和镁属于同一族;第二、三周期元素的原子最外层电子数从左到右依次增多;铝的原子序数=质子数=13,而中子数≈相对原子质量-质子数,由于没有提供相对原子质量,因此不能得知其中子数;Na+和Mg2+都失去了最外层电子,其核外电子数相同,都是10。
10.[2014·青岛]按元素周期表(局部)提供的信息,下列有关判断错误的是( )
A.铍(Be)和镁属于同一族B.第二、三周期元素的原子最外层电子数从左到右依次增多C.铝原子的核内中子数为13D.Na+和Mg2+的核外电子数相同盐
A 由图示可知,硅原子的原子序数=质子数=14;由硅元素的偏旁是“石”,可见硅属于非金属元素;地壳中含量最高的元素是氧元素;元素符号下方的数字是原子的相对原子质量,硅元素的相对原子质量为28.09,相对原子质量的单位为“1”,一般省略不写。
11.[2012·青岛]硅元素在现代信息技术产业中有着广泛的应用,它在元素周期表中的信息如图所示。则下列说法正确的是( )A.硅原子的质子数为14B.硅元素属于金属元素C.地壳中含量最高的元素是硅D.硅元素的相对原子质量是28.09g
12.[2013·青岛]“化学的主要工作是耕耘元素周期表”。下表为元素周期表中部分元素的相关信息,请利用下表回答相关问题。
(1)锂原子的核电荷数为__3__。(2)16号元素的原子在化学反应中比较容易__得__(填“得”或“失”)电子,该元素属于__非金属__(填“金属”或“非金属”)元素。
(3)写出表中关于8号元素的一条信息__8号元素的原子最外层电子数为6(或在化学反应中该原子比较容易得到电子等)__。(4)在金属活动性顺序表中镁的活动性比铝的活动性强,试从原子结构的角度说明其原因:__镁原子最外层电子数比铝少,在化学反应中镁原子更易失去电子__。
(1)根据元素周期表中的信息可知,锂原子的原子序数=核电荷数=3;(2)16号元素是硫,属于非金属元素,在化学反应中易得到2个电子变成阴离子;(3)8号元素的原子最外层电子数是6,在化学反应中易得到2个电子变成阴离子;(4)由元素周期表可以看出,镁原子的最外层电子数是2,铝原子的最外层电子数是3,在化学反应中镁原子更易失去电子,因此在金属活动性顺序表中镁的活动性比铝的活动性强。
猜押预测►2.下表是元素周期表中第2、3周期的元素,请回答有关问题。
(1)下列各组具有相似化学性质的元素是__BC__(填字母序号); A.Na、Cl B.O、S C.F、Cl D.Cl、Ar(2)写出一条第三周期元素原子的核外电子排布规律__同一周期的元素的原子,核外电子层数相同(合理即可)__;(3)第7号元素与第12号元素的原子形成化合物的化学式为__Mg3N2__;
相关课件
这是一份青岛专版中考化学总复习第一部分主题十八气体的制取和净化课件鲁教版,共15页。PPT课件主要包含了考点梳理过关,尾气处理,典型例题分析等内容,欢迎下载使用。
这是一份青岛专版中考化学总复习第一部分主题四溶液课件鲁教版,共43页。PPT课件主要包含了考点梳理过关,考点3乳化现象,乳化现象,概念与公式,计算类型,典型例题分析,重点实验突破,典例分析,命题挖掘►,六年真题全练等内容,欢迎下载使用。
这是一份青岛专版中考化学总复习第一部分主题十五化学与社会发展课件鲁教版,共44页。PPT课件主要包含了考点梳理过关,清洁高效的氢能,典型例题分析,六年真题全练等内容,欢迎下载使用。












