





泰安专版中考化学总复习第一部分第10讲海水中的化学第2课时溶解度课件
展开第10讲 海水中的化学 第2课时 溶解度
考点1 溶解度 6年1考一、固体溶解度
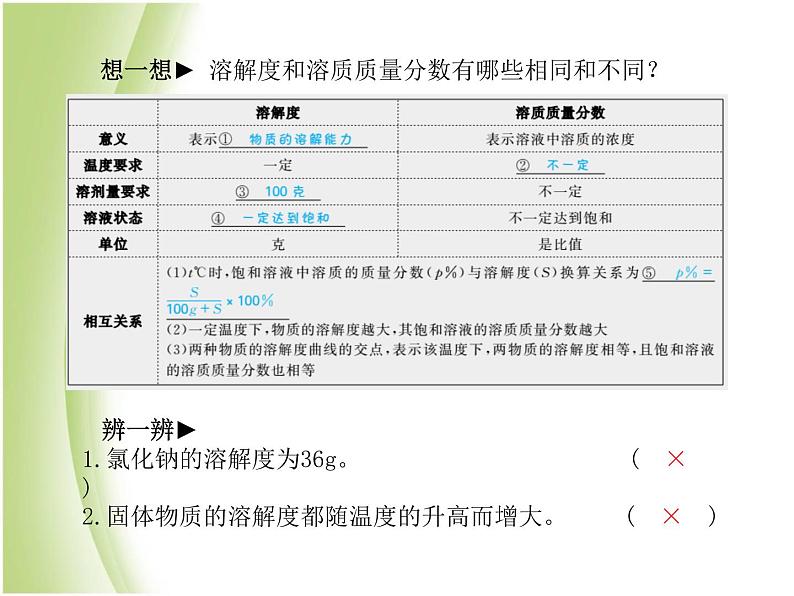
想一想► 溶解度和溶质质量分数有哪些相同和不同?
辨一辨► 1.氯化钠的溶解度为36g。 ( × ) 2.固体物质的溶解度都随温度的升高而增大。 ( × )
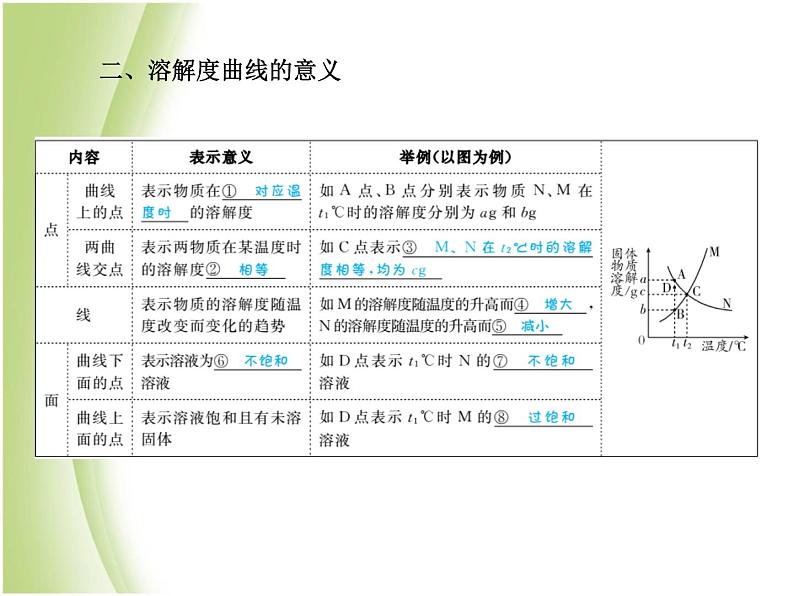
考点2 溶解度曲线及其应用 6年5考一、溶解度曲线的定义与应用
类型 溶解度及溶解度曲线
【例】[2016·随州中考]20℃时,将等质量的甲、乙两种固体分别加入盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两物质的溶解度曲线如图3。请结合图示判断,下列说法错误的是 ( C )A.P点表示30℃时甲、乙两物质的溶解度相等B.图3中N表示的是乙的溶解度曲线C.图1中甲一定是饱和溶液,乙一定是不饱和溶液D.图2中甲、乙两溶液中溶质质量分数一定相等
思路点拨►通过分析溶解度曲线图可知,P点表示30℃时甲、乙两物质的溶解度相等;图1中20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,甲有固体剩余,说明在20℃时,甲的溶解度小于乙,从图3中的溶解度曲线可以看出,N表示乙的溶解度曲线;图1中甲溶液中有固体剩余,所以甲一定是饱和溶液,乙溶液中没有固体剩余,所以乙可能是饱和溶液;图2中均无固体剩余,说明全部溶解,相同质量的溶剂溶解了相同质量的溶质,依据溶质质量分数=溶质质量/溶质质量+溶剂质量×100%,所以图2中甲、乙两溶液中溶质的质量分数一定相等。
变式运用►1.KCl与KNO3在不同温度的溶解度数据如下表。则下列说法正确的是 ( )A.KNO3比KCl的溶解度大B.两物质的溶解度相等的温度在20℃~30℃之间C.在20℃时,10g水中加入5gKCl可得到33.3%的KCl溶液D.在50℃时,两物质各5g分别加入10g水中,充分溶解,均有固体剩余
B 没有指明温度,无法比较溶解度的大小,故A错误;分析表中数据可知,20℃时KCl的溶解度大于KNO3的溶解度,30℃时KCl的溶解度小于KNO3的溶解度,故两物质的溶解度相等的温度在20℃~30℃之间,故B正确;20℃时KCl的溶解度是33g,相当于100g水中最多溶解氯化钾33g,则10g水中加入5gKCl,最多能溶解3.3gKCl,溶液中溶质的质量分数为3.3g/(3.3g+10g)×100%≈24.8%,故C错误;50℃时KCl的溶解度是41g,相当于100g水中最多溶解氯化钾41g,则10g水中最多溶解氯化钾4.1g,50℃时硝酸钾的溶解度是88g,相当于100g水中最多溶解硝酸钾88g,则10g水中最多溶解硝酸钾8.8g,故两物质各5g分别加入10g水中,充分溶解后,氯化钾有固体剩余,硝酸钾无固体剩余,故D错误。
2.[2014·佛山中考]如图为KNO3的溶解度曲线图,现有M状态下的KNO3溶液65g,若要将该溶液经过处理后,刚好得到该温度下的饱和溶液,下列处理方法正确的是 ( )A.在t2℃时,将65g溶液倒出去32.5gB.将65g溶液蒸发掉32.5g的水,再冷却到t2℃C.在t2℃时,向65g溶液中加入15gKNO3固体并充分溶解D.将65g溶液的温度从t2℃降低到t1℃
C 由图可知,M状态下的KNO3溶液相当于130g溶液中含有硝酸钾30g,则65g溶液中含有溶质的质量是15g,水的质量是50g,若要将该溶液处理后刚好得到该温度下的饱和溶液,温度不变,可采取增加溶质或恒温蒸发溶剂的方法。由于溶液具有均一性,所以在t2℃时,将65g溶液倒出去32.5g不能改变溶液的状态;t2℃时硝酸钾的溶解度是60g,即100g水中最多溶解60g硝酸钾,要将65g溶液蒸发掉一部分水,再冷却到t2℃,刚好得到该温度下的饱和溶液,设蒸发水的质量为x,则有100g/60g=(50-x)/15g,解得x=25g;若采取增加溶质的方法,加入15gKNO3固体并充分溶解,溶质的质量变为30g,水的质量不变,仍为50g,则恰好饱和;将65g溶液的温度从t2℃降低到t1℃,改变了温度,不符合题意。
对溶解度的考查主要结合溶解度表或者是溶解度曲线进行考查,主要命题方式是通过表或曲线上的信息确定所得溶液是否为饱和溶液。1.[2014·泰安,23题,5分]KNO3和NaCl在不同温度时的溶解度如表。请回答下列问题:
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图,图中能表示KNO3溶解度曲线的是 A (填“A”或“B”);(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解度,则温度的取值范围是 20℃~30℃ ;
(3)某兴趣小组做了以下实验:上述实验过程中得到的溶液一定属于不饱和溶液的是 ①③④ (填数字序号),将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体 59.1 g;(4)硝酸钾中含有少量氯化钠时,可通过 降温结晶 (填“蒸发结晶”或“降温结晶”)的方法提纯。
解析:(1)根据表格提供的数据可以看出,硝酸钾的溶解度随温度升高变化很大,氯化钠的溶解度随温度变化增大不如硝酸钾明显,故A表示硝酸钾的溶解度曲线;(2)在20℃~30℃之间时硝酸钾和氯化钠具有相同的溶解度;(3)20℃时硝酸钾的溶解度为31.6g,20℃时将25g硝酸钾溶于100g水中得到的溶液①为不饱和溶液,再加入25g硝酸钾时得到的溶液②为饱和溶液且有50g-31.6g=18.4g硝酸钾剩余,将②溶液升温到50℃,因50℃时硝酸钾的溶解度为85.5g,因此得到的溶液③为不饱和溶液,再加入30g得到的溶液④仍为不饱和溶液,此时溶液中溶解的硝酸钾为80g,再降温到20℃时得到的溶液⑤是饱和溶液且析出硝酸钾晶体80g-31.6g=48.4g,故属于不饱和溶液的是①③④;硝酸钾在10℃时的溶解度为20.9g,将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体80g-20.9g=59.1g;(4)由于硝酸钾的溶解度随温度的升高而明显增大,而氯化钠的溶解度受温度影响很小,因此提纯混有少量氯化钠的硝酸钾应采用降温结晶的方法。
猜押预测►1.下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)。(1)以上两种物质溶解度的变化受温度影响较小的是 NaCl。(2)50℃时,KNO3的溶解度是 85.5 g/100g水。(3)KNO3溶液中含有少量NaCl时,可通过 降温结晶(或冷却热饱和溶液) 的方法提纯。(4)对(3)析出的晶体和剩余溶液描述正确的是 A (填写编号)。A.剩余溶液一定是KNO3饱和溶液B.剩余溶液一定不含有NaClC.剩余的溶液一定是纯净物D.析出的晶体中只含有KNO3
解析:(1)从表中数据可知,硝酸钾的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小;(2)从表中可知,50℃时KNO3的溶解度为85.5g/100g水;(3)因为硝酸钾的溶解度受温度影响较大,所以KNO3溶液中含有少量NaCl时,可通过降温结晶(或冷却热饱和溶液)的方法提纯KNO3;(4)饱和溶液是指在一定温度下,不能再溶解这种溶质的溶液,既然有晶体析出,剩余的溶液一定是该溶质的饱和溶液。
试题一般通过比较溶解度大小、结晶问题、饱和溶液判断及饱和溶液的溶质质量分数等方面来考查溶解度曲线的应用。
命题点2 溶解度曲线
2.[2012·泰安,22题,3分]如图是甲、乙两种固体物质的溶解度曲线。下列有关叙述正确的是 ( )A.0℃时,甲物质的溶解度为40gB.10℃时,甲、乙两种物质的溶解度相等C.30℃时,甲物质饱和溶液的质量分数为60%D.除去甲物质中少量乙物质可采取蒸发的方法
B 0℃时,甲的溶解度为20g,故A错误;曲线中交点表示该温度时两种物质的溶解度相等,所以10℃时,甲、乙两种物质的溶解度相等,故B正确;30℃时,甲物质饱和溶液的质量分数为60g/(60g+100g)×100%=37.5%,故C错误;把溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,把溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂,由于甲物质溶解度随温度变化比较大,所以用降温结晶的方法,故D错误。
3.[2013·泰安,22题,3分]如图是A、B、C三种固体物质的溶解度曲线。下列分析不正确的是 ( )A.50℃时,三种物质的溶解度由大到小的顺序是A>B>CB.50℃时,把50gA放入50g水中能形成75gA的饱和溶液
C.将C的饱和溶液变为不饱和溶液,可采用降温的方法D.分别将三种物质的饱和溶液从50℃降至20℃时,所得溶液溶质质量分数大小关系是B>C=A
D 50℃时,三种物质的溶解度由大到小的顺序是A>B>C,故A正确;50℃时A的溶解度是50g,所以把50g A放入50g水中最多溶解25g,能形成75g A的饱和溶液,故B正确;C的溶解度随温度的降低而增大,所以将C的饱和溶液变为不饱和溶液,可采用降温的方法,故C正确;A、B的溶解度随温度的降低而减小,C的溶解度随温度的降低而增大,所以分别将三种物质的饱和溶液从50℃降至20℃时,A、B析出晶体,依然是饱和溶液,此时B的溶解度大于A,C变为不饱和溶液,溶质的质量分数与降温前相等,20℃时A的溶解度与C的溶解度相等,根据饱和溶液中溶质的质量分数=溶解度/(溶解度+100g)×100%可知,降温后所得溶液中溶质质量分数大小关系是B>A>C,故D错误。
4.[2016·泰安,12题,2分]如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是 ( )A.t1℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲B.t2℃时,20g丙溶解于50g水中能形成70g溶液
C.分别将三种物质的饱和溶液从t3℃降温至t2℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙D.若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D t1℃时,甲的溶解度小于丙的溶解度,等质量的甲、丙饱和溶液中所含溶质的质量分数为丙>甲,但此题不知溶液是否饱和,故A错误;t2℃时,丙的溶解度是30g,将20g丙加入到50g水中只溶解15g,充分搅拌后,所形成溶液的质量为15g+50g=65g,故B错误;甲、乙物质的溶解度随温度的降低而减小,丙物质的溶解度随温度的降低而增大,t3℃时,甲、乙、丙三种物质的饱和溶液降温到t2℃时,乙物质的溶解度最大,甲次之,丙物质应该是t3℃时的溶解度,所以所得的溶液中溶质的质量分数的大小关系为乙>甲>丙,故C错误;甲物质的溶解度随温度的升高而增大,所以要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂或添加溶质的方法,故D正确。
5.[2017·泰安,8题,2分]t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。则下列说法正确的是 ( )
A.烧杯①的溶液一定是不饱和瑢液B.烧杯①的溶液是硝酸钾溶液C.烧杯②的溶液升温到t2℃时,烧杯底部还有部分物质不溶解D.若烧杯①和烧杯②的溶液都升温到t2℃时,溶质的质量分数相等
D 烧杯①的底部无固体剩余,溶液可能是不饱和溶液,也可能恰好饱和,A错误;t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后,烧杯①的底部有固体剩余,烧杯②的底部有固体剩余,所以t1℃时,烧杯①中的物质的溶解度大于烧杯②中的物质的溶解度,所以烧杯①的溶液是氯化钾溶液,B错误;t2℃时,硝酸钾的溶解度等于氯化钾的溶解度,此时烧杯①中的物质完全溶解,所以在t2℃时,两溶液中溶质的质量分数相等,C错误,D正确。
猜押预测►2.如图为甲、乙两种固体物质在水中的溶解度曲线。下列说法错误的是 ( )A.甲物质的溶解度随温度的升高而增大B.在t1℃时,甲、乙两物质的溶解度相等C.在t2℃时,N点表示甲物质的不饱和溶液D.在t1℃时,100g乙物质的饱和溶液中溶质的质量是25g
D 从甲的溶解度曲线可以看出,甲物质的溶解度随温度的升高而增大,且受温度的影响较大;在t1℃时,甲、乙两物质的溶解度曲线相交,故甲、乙两物质的溶解度相等;在t2℃时,N点在甲的溶解度曲线的下方,因此N点表示甲物质的不饱和溶液;在t1℃时,乙的溶解度是25g,故在100g水中最多溶解25g乙,则100g乙物质的饱和溶液中溶质的质量小于25g。
试题一般结合溶解度曲线中某物质的溶解度变化趋势确定结晶的方法或确定除杂的方法。6.[2015·泰安,23题,5分]食盐在生产和生活中具有广泛的用途,是一种重要的资源,海水中储量很丰富。(1)海水晒盐的原理是 利用阳光和风使海水中的水分蒸发掉,使氯化钠结晶出来 ;
(2)晒盐过程中得到粗盐和卤水,卤水的主要成分及其溶解度的变化如图。t2℃时,MgCl2的溶解度为 100 g;将t2℃时MgCl2、KCl和MgSO4三种物质的饱和溶液分别降温至t1℃时,析出的晶体是 MgCl2、KCl (填物质化学式);
(3)将纯净的氯化钠固体配制成溶液,20℃时,向4个盛有50g水的烧杯中,分别加入一定质量的氯化钠并充分溶解,4组实验数据如下表:若将②中得到的溶液稀释成质量分数为0.9%的生理盐水,需加水的质量是 941 g。关于上述实验的叙述不正确的是 D (填序号)。A.①②所得溶液是该温度下的不饱和溶液B.③④所得溶液溶质的质量分数相等C.20℃时,氯化钠的溶解度为36gD.20℃时,将④恒温蒸发25g水,过滤得18g固体
解析:(1)食盐的溶解度受温度变化的影响小,从海水中获得食盐主要利用阳光和风使海水中的水分蒸发掉,使氯化钠结晶出来。(2)由图示可知t2℃时,MgCl2的溶解度为100g,将t2℃的MgCl2、KCl和MgSO4三种物质的饱和溶液降温至t1℃时,只要溶解度减小的都能析出晶体,由图示可知MgCl2、KCl的溶解度变小,都能析出晶体;(3)根据加水稀释前后溶质质量不变可知0.9%的生理盐水中溶质的质量为9g,因此溶液质量为9g/0.9%=1000g,因此需加水的质量为1000g-59g=941g;分析题中四组溶液,由③④组溶液可知50g水中最多溶解18g食盐,因此①②为不饱和溶液,③④为饱和溶液,故A正确;③④都是该温度下的饱和溶液,因此溶质质量分数相同,故B正确;20℃时,③中溶液正好为饱和溶液且50g水中溶解了18g食盐,所以20℃时,氯化钠的溶解度为36g,故C正确;20℃时,氯化钠的溶解度为36g,50g水中最多溶解氯化钠的质量为18g,未溶解的氯化钠的质量为20g-18g=2g,20℃时,将④恒温蒸发25g水,析出氯化钠的质量为9g,过滤得到的固体的质量为9g+2g=11g,故D错误。
猜押预测►3.[2015·陕西中考]将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列有关量随时间变化趋势的图像不正确的是 ( )
D 硝酸钾的溶解度随温度的升高而增大,随温度的降低而减小,将热的硝酸钾饱和溶液冷却到室温,有硝酸钾晶体析出,溶液中溶质的质量减小,析出硝酸钾晶体的质量从零开始,逐渐增多;其溶剂的质量不变,溶质质量分数逐渐减小,故A、B、C均正确,D错误。
泰安专版中考化学总复习第一部分第12讲化学与健康课件: 这是一份泰安专版中考化学总复习第一部分第12讲化学与健康课件,共27页。PPT课件主要包含了考点梳理过关,典型例题运用,六年真题全练等内容,欢迎下载使用。
泰安专版中考化学总复习第一部分第9讲常见的酸和碱第2课时酸和碱的性质课件: 这是一份泰安专版中考化学总复习第一部分第9讲常见的酸和碱第2课时酸和碱的性质课件,共36页。PPT课件主要包含了考点梳理过关,典型例题运用,类型2酸碱中和反应,实验聚焦突破,探究过程,实验分析,典例分析,六年真题全练,命题点2中和反应等内容,欢迎下载使用。
泰安专版中考化学总复习第一部分第11讲金属第2课时金属的化学性质课件: 这是一份泰安专版中考化学总复习第一部分第11讲金属第2课时金属的化学性质课件,共60页。PPT课件主要包含了考点梳理过关,典型例题运用,实验聚焦突破,典例分析,六年真题全练等内容,欢迎下载使用。












