




所属成套资源:河南省中考化学复习课件PPT专题
河南省中考化学复习第7讲常见的酸和碱课件
展开
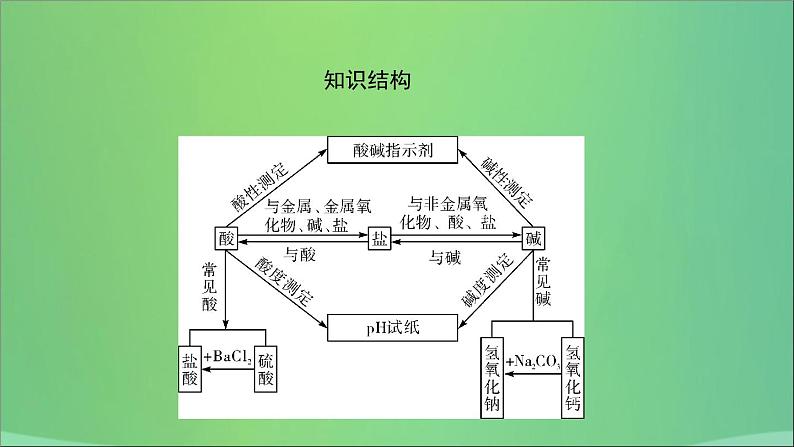
这是一份河南省中考化学复习第7讲常见的酸和碱课件,共60页。PPT课件主要包含了知识结构,HCl,H2SO4,刺激性,黏稠油状,有白雾出现,干燥剂,浓硫酸,玻璃棒,不变色等内容,欢迎下载使用。
考点1常见酸的性质和用途
1. 定义:解离时产生的阳离子全部是H+的化合物,即酸→H++酸根离子,如:HCl、H2SO4等。
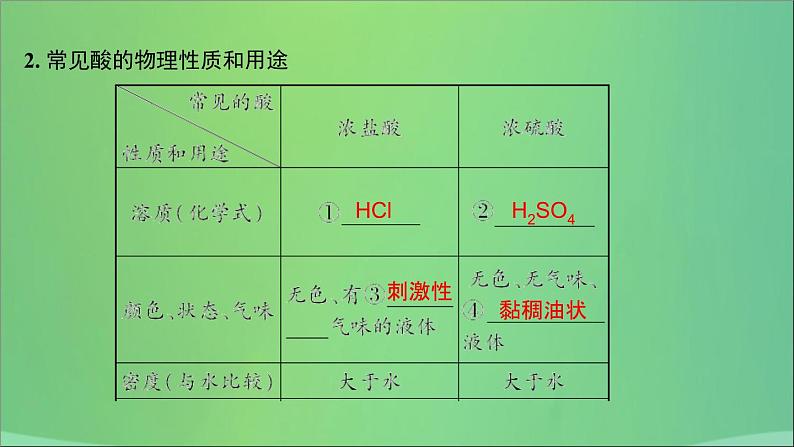
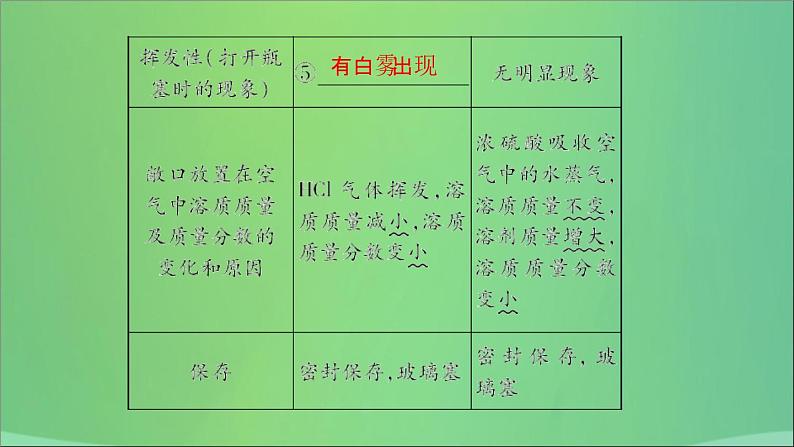
2. 常见酸的物理性质和用途
其他常见的酸除盐酸、硫酸外,还有硝酸(HNO3)、醋酸(CH3COOH)等。
3. 浓硫酸的特性(1)吸水性:浓硫酸具有吸水性,在实验室中常用它作________。(2)强腐蚀性(也称为脱水性):浓硫酸有强烈的腐蚀性。它能夺取纸张、木材、布料、皮肤(都由含碳、氢、氧等元素的化合物组成)里的水分,生成黑色的炭。此过程属于化学变化。【注意】如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
(3)强氧化性:浓硫酸与金属反应时一般生成水而不是氢气,因而实验室制H2时不用浓硫酸。(4)浓硫酸的稀释在稀释浓硫酸时,一定要把________沿器壁慢慢注入________里,并用________不断________。切不可将水倒入浓硫酸中。如果将水注入浓硫酸中,由于水的密度较小,水会浮在浓硫酸上面,溶解时放出的热量能使水立刻沸腾,使硫酸液滴向四周飞溅,造成危险。【温馨提示】稀释浓硫酸口诀:酸入水,沿器壁,缓慢倒,不断搅。
4. 酸的化学性质(酸五条)
2FeCl3+3H2O
Fe2(SO4)3+3H2O
Na2SO4+2H2O
CaSO4+2H2O
CaCl2+H2O+CO2↑
Na2SO4+H2O+CO2↑
BaSO4↓+2HCl
AgCl↓+HNO3
考点2常见碱的性质和用途
1. 定义:解离时产生的阴离子全部为OH-的化合物。
2. 氢氧化钠和氢氧化钙的比较
CaO+H2O=== Ca(OH)2
【温馨提示】①有个性的碱:Cu(OH)2蓝色沉淀(难溶于水);Fe(OH)3红褐色沉淀(难溶于水);难溶性碱不能使指示剂变色。②在空气中易变质的碱:易溶性(或微溶性)碱久置于空气中均易变质。如NaOH、Ca(OH)2、Ba(OH)2等;变质原因是易与空气中的CO2反应,生成碳酸盐。如CO2+2NaOH=== Na2CO3+H2O。③非金属氧化物与碱反应时,碱必须可溶;非金属氧化物一般有CO2、SO3、SO2等。
4. 氢氧化钠、氢氧化钙的变质探究(详见实验突破)(1)氢氧化钠变质:2NaOH+CO2=== Na2CO3+H2O(2)氢氧化钙变质:Ca(OH)2+CO2=== CaCO3↓+H2O
考点3酸碱指示剂和pH
1. 酸碱与指示剂作用
【温馨提示】①巧学速记:石蕊“酸里红,碱里蓝”;酚酞“遇酸色不变,遇碱红艳艳”。②指示剂遇到酸溶液或碱溶液时,变色的是指示剂。③指示剂能判断溶液的酸碱性,但不能确定溶液一定是酸或碱。用指示剂不能测定溶液的酸碱度。
2. 溶液酸碱度的表示法——pH溶液的酸碱性常用pH来表示,pH的范围一般在________之间。测定pH最简单的方法是使用pH试纸。(1)溶液的酸碱性与pH的关系pH7,溶液显____性,pH越____,碱性越强。
(2)pH的测定方法 在白瓷板或玻璃片上放一片pH试纸,用玻璃棒蘸取待测液滴到pH试纸上,根据试纸显示的颜色与标准比色卡对照,即可得出待测溶液的pH,此法测得的pH为整数。【注意事项】①pH试纸不能直接浸入溶液,以免污染溶液;②pH试纸不能用水润湿,因为润湿试纸相当于稀释待检验的溶液,则会导致测量结果不准;③在半分钟内显色读数;④pH取整数。
(3)溶液酸碱度的应用①化工生产中,许多反应都必须在给出一定pH的溶液里才能进行。②农业生产中,通过调节pH来改良土壤酸碱性。③监测雨水pH,了解空气污染情况,以便采取必要措施。④测定人体pH,帮助人们了解身体健康状况。
考点4中和反应及其应用
1.定义:________和________作用生成________与________的反应叫做中和反应。2.实质:酸溶液中的________离子和碱溶液中的________离子结合成________。
3.应用:(1)改良土壤:如酸性土壤中可加入________(填名称)。(2)处理工厂废水:含有稀硫酸的废水可用________来中和,反应的方程式是______________________________________。(3)用于医药:中和胃酸可服用________性药物;被蚊虫叮咬处有蚁酸(HCOOH),可涂一些______物质(如________)减轻痛痒。
Ca(OH)2+H2SO4=== CaSO4+2H2O
规范书写1. 化学式书写酸:盐酸,________) 硫酸,________) 硝酸,________)碱:氢氧化钠,________) 氢氧化钙,________) 氨水,________)
2. 化学方程式书写Ⅰ.体现酸化学性质的反应
(1)金属+稀酸―→盐+H2↑①_________________________________________________________;___________________________________________________________②___________________________________________________________;_____________________________________________________________③__________________________________________________________;_____________________________________________________________
Fe+2HCl=== FeCl2+H2↑
Fe+H2SO4=== FeSO4+H2↑
Mg+2HCl=== MgCl2+H2↑
Mg+H2SO4=== MgSO4+H2↑
Zn+2HCl=== ZnCl2+H2↑
Zn+H2SO4=== ZnSO4+H2↑
(2)金属氧化物+稀酸―→盐+H2O④__________________________________________________________;_____________________________________________________________⑤__________________________________________________________;____________________________________________________________
Fe2O3+6HCl=== 2FeCl3+3H2O
Fe2O3+3H2SO4=== Fe2(SO4)3+3H2O
CuO+2HCl=== CuCl2+H2O
CuO+H2SO4=== CuSO4+H2O
(3)酸+碱―→盐+H2O⑥__________________________________________________________;____________________________________________________________⑦___________________________________________________________;______________________________________________________________⑧____________________________________________________________;______________________________________________________________⑨____________________________________________________________;_______________________________________________________________
HCl+NaOH=== NaCl+H2O
H2SO4+2NaOH=== Na2SO4+2H2O
2HCl+Ca(OH)2=== CaCl2+2H2O
H2SO4+Ca(OH)2=== CaSO4+2H2O
Mg(OH)2+2HCl=== MgCl2+2H2O
Mg(OH)2+H2SO4===MgSO4+2H2O
Al(OH)3+3HCl=== AlCl3+3H2O
2Al(OH)3+3H2SO4===Al2(SO4)3+6H2O
(4)酸+盐―→新酸+新盐⑩_________________________________________________________⑪__________________________________________________________⑫__________________________________________________________⑬__________________________________________________________⑭__________________________________________________________
2HCl+CaCO3=== CaCl2+H2O+CO2↑
2HCl+Na2CO3=== 2NaCl+H2O+CO2↑
HCl+AgNO3=== AgCl↓+HNO3
H2SO4+Ba(NO3)2===BaSO4↓+2HNO3
H2SO4+BaCl2=== BaSO4↓+2HCl
Ⅱ.体现碱化学性质的反应
(1)碱+非金属氧化物→盐+H2O①_________________________________________________________________________________________________________________________②_____________________________________________________________________________________________________________________________
2NaOH+CO2=== Na2CO3+H2O
CO2+Ca(OH)2=== CaCO3↓+H2O
2NaOH+SO2=== Na2SO3+H2O
Ca(OH)2+SO2===CaSO3+H2O
(2)碱+盐→新碱+新盐③_________________________________________________________________________________________________________________________④___________________________________________________________________________________________________________________________⑤____________________________________________________________
(3)碱+酸→盐+H2O(同酸)
2NaOH+CuSO4=== Na2SO4+Cu(OH)2↓
Ca(OH)2+CuSO4===CaSO4+Cu(OH)2↓
3NaOH+FeCl3===Fe(OH)3↓+3NaCl
3Ca(OH)2+2FeCl3===2Fe(OH)3↓+3CaCl2
Na2CO3+Ca(OH)2=== CaCO3↓+2NaOH
类型1常见酸的性质及用途
【例】(2017宜宾)通过构建知识网络,可以帮助我们理解知识间的内在联系。如图是稀硫酸与不同类别物质之间反应的知识网络图。回答下列问题:
(1)稀硫酸与锌反应的反应类型是____________。(2)可用稀硫酸与________、________(填化学式)等不同类的物质反应制取硫酸铜。(3)向氯化钡溶液中加入一定量的硫酸溶液,反应后过滤,滤液中一定含有的溶质是__________(填化学式,下空同),可能存在的溶质是________。
H2SO4或BaCl2
1. (2017河南说明与检测)醋酸(CH3COOH)是一种常见的酸,具有酸的通性。例如:醋酸与氢氧化钠溶液反应生成醋酸钠和水,化学方程式为CH3COOH+NaOH === CH3COONa+H2O。(1)氢氧化钾与氢氧化钠一样,也是一种常见的碱,具有碱的通性。请写出醋酸与氢氧化钾溶液发生中和反应生成盐的化学式:________________________。(2)醋酸与盐酸一样,能与活泼金属反应生成氢气。请写出醋酸与金属锌反应的化学方程式_____________________________________________。
2CH3COOH+Zn === (CH3COO)2Zn+H2↑
2. 物质的结构决定性质,性质反映结构。据此回答。(1)稀盐酸(HCl)和稀硫酸(H2SO4)具有相似的化学性质,原因是它们在电离时都产生了____________。(2)稀盐酸和稀硫酸都是无色透明的液体,为鉴别它们,小柯设计了如图四种方案(每种方案的两支试管中事先分别加入等量的上述两种酸)。其中可行的方案有________。
3. 硫酸和盐酸都是实验室常用的酸,它们有许多相似的性质。(1)稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因。(2)它们都能除去铁锈,将生锈的铁钉放入稀盐酸中,可看到铁锈逐渐消失,溶液颜色变为黄色。写出反应的化学方程式。(3)都能与碱发生中和反应。请写出硫酸与氢氧化钠反应的化学方程式。
类型2常见碱的性质及用途
【例】(2017河南说明与检测节选)烧碱(NaOH)是一种重要的化工原料,广泛用于制肥皂、造纸等工业。请回答下列有关问题。(1)在工业上通常用电解饱和食盐水溶液的方法制取烧碱,产物除烧碱外,还有H2和Cl2,请写出有关反应的化学方程式。
(2)烧碱放置在空气中会变质,请设计一个实验,在检验氢氧化钠变质的同时又能除去杂质。请用化学方程式来表示。(3)在烧碱溶液和稀盐酸进行中和反应实验时,一般需要在烧碱溶液中滴加酚酞溶液,酚酞溶液的作用是什么?最后得到的固体的构成微粒是_______________________________。
Ca(OH)2+Na2CO3 === CaCO3↓+2NaOH
通过酚酞溶液颜色的变化,证明烧碱和盐酸发生了中和反应。
1. (2017洛阳八校联考)现有一瓶敞口放置的氢氧化钠溶液,下列判断变质情况的实验操作正确的是( )A. 取溶液适量于试管中,滴加酚酞溶液B. 取溶液适量于试管中,滴加足量稀盐酸,再滴加酚酞溶液C. 取溶液适量于试管中,滴加足量氯化钡溶液,再滴加酚酞溶液D. 取溶液适量于试管中,滴加足量氯化钡溶液
2. 对知识的归纳和总结是学好化学的重要方法。在学习了碱的性质后,小明同学总结了氢氧化钙的四条化学性质(如图所示),即氢氧化钙与图中四类物质能够发生化学反应。
(1)图中M所属的物质类别是______。(2)氢氧化钙可由生石灰与水反应制得,该反应能________(填“吸收”或“放出”)热量。(3)利用图中氢氧化钙能与___________________反应的性质,可以解释“用石灰浆粉刷墙壁,干燥后墙面就变硬了”的现象。(4)利用图中④氢氧化钙与盐反应的性质中,可以除去氢氧化钠溶液中少量的氢氧化钙杂质,请写出该反应的化学方程式______________________________________。
Ca(OH)2+Na2CO3 === CaCO3↓+2NaOH
3. 为研究氢氧化钠、氢氧化钙两种溶液的化学性质,进行如下实验。
(1)A、D中酚酞均变________色,说明两种溶液都呈碱性。(2)B中溶液的pH________7(选填“>”“
相关课件
这是一份中考化学复习第7讲空气氧气课件,共41页。PPT课件主要包含了第7讲空气氧气,空气的主要成分,空气的成分,知识梳理答案,1大不易,酒精灯,Fe+,能保持铁丝持续燃烧所,需的温度,混合物等内容,欢迎下载使用。
这是一份中考总复习化学第7讲 盐 化学肥料课件,共37页。PPT课件主要包含了复习指导航标,关键能力提升,必备知识精讲,核心素养创新,·2·,·3·,·4·,·5·,知识点1常见的盐,·6·等内容,欢迎下载使用。
这是一份中考复习 第7单元 常见的酸和碱课件PPT,共16页。PPT课件主要包含了思考问题,CaOH2,KOH,NH3·H2O,总结酸的性质,生活知多D,碱→金属离子+OH-,OH-,酸→H++酸根离子等内容,欢迎下载使用。









