

初中化学沪教版 (上海)九年级第一学期3.2 溶液习题
展开这是一份初中化学沪教版 (上海)九年级第一学期3.2 溶液习题,共14页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
班级:__________ 姓名:__________ 分数:__________
一、单选题(每小题3分,共计24分)
1、下列实验方案不能达到实验目的的是
A.AB.BC.CD.D
2、放入水中,能形成溶液的物质是
A.面粉B.麻油C.食盐D.泥土
3、下列说法正确的是
A.通过电解水实验说明水由氢气和氧气组成的
B.100g98%的浓硫酸加入400g水稀释能得到19.6%的稀硫酸
C.电器着火用水扑灭,以降低可燃物的着火点
D.C、CO和CO2都具有可燃性和还原性
4、a、b、c三种固体物质的溶解度曲线如图所示。下列说法正确的是
A.t1℃时,a物质的溶解度是30g
B.t2℃时,b的饱和溶液中溶质的质量分数为50%
C.t3℃时,各取15ga、b、c三种物质分别加入到50g水中充分溶解,能得到饱和溶液的是c
D.t3℃时:a、b、c三种物质的饱和溶液均降温到t1℃,三种物质溶质质量分数大小关系为b>c>a
5、厨房中常用的调味品放入足量水中,不能形成溶液的是
A.白醋B.食盐C.蔗糖D.麻油
6、属于溶液的是
A.八宝粥B.汽水C.珍珠奶茶D.蒸馏水
7、下列依据实验目的设计的实验方案,正确的是
A.AB.BC.CD.D
8、属于溶液的是
A.蒸馏水B.矿泉水C.泥沙水D.油水
二、填空题(每小题4分,共计20分)
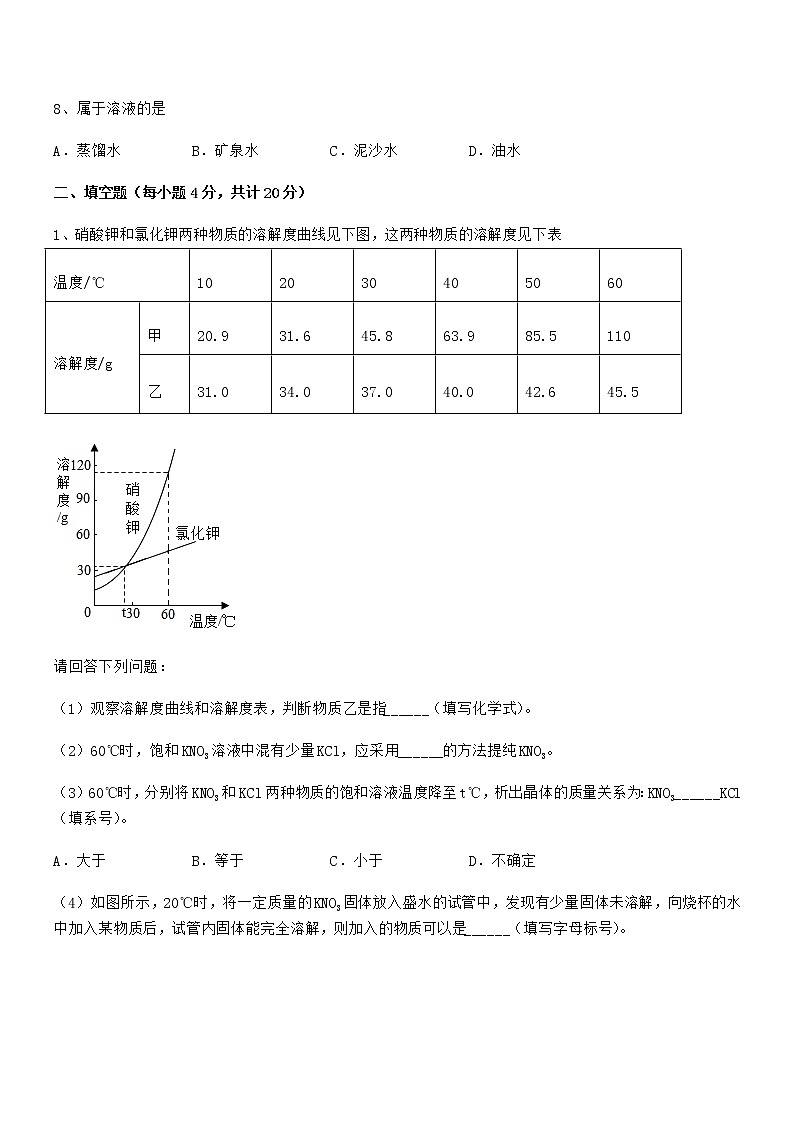
1、硝酸钾和氯化钾两种物质的溶解度曲线见下图,这两种物质的溶解度见下表
请回答下列问题:
(1)观察溶解度曲线和溶解度表,判断物质乙是指______(填写化学式)。
(2)60℃时,饱和KNO3溶液中混有少量KCl,应采用______的方法提纯KNO3。
(3)60℃时,分别将KNO3和KCl两种物质的饱和溶液温度降至t℃,析出晶体的质量关系为:KNO3______KCl(填系号)。
A.大于B.等于C.小于D.不确定
(4)如图所示,20℃时,将一定质量的KNO3固体放入盛水的试管中,发现有少量固体未溶解,向烧杯的水中加入某物质后,试管内固体能完全溶解,则加入的物质可以是______(填写字母标号)。
①冰块②生石灰③硝酸铵固体④干冰⑤浓硫酸⑥氢氧化钠固体
A.①③④B.②⑤⑥C.①③⑤D.②④⑥
(5)60℃时,将20gKC1固体放入50g水中,降温至20℃,析出晶体的质量是______。
2、水与溶液在生产生活中有广泛的用途。
(1)如图为A、B两种物质的溶解度曲线如图所示,请根据图回答下列问题:
①甲的溶解度受温度的影响比乙的溶解度受温度影响______(填“大”或“小”);若甲中含有少量的乙,提纯甲应采用的结晶方法是______。
②t2℃时,将60g的甲、乙分别加入到100g水中,充分溶解,能形成的饱和溶液是______物质。
③将t1C时甲、乙的饱和溶液升温到t2C,所得溶液的溶质质量分数的关系是甲______(填“﹥”“﹤”“=”)乙。
(2)欲配制50 g溶质质量分数为0.9%的氯化钠溶液,需溶质质量分数为11%的氯化钠溶液的质量为______(列式即可)。
3、根据硝酸钾的溶解度曲线(图一)回答下列问题
(1)20℃时,KNO3的溶解度是______。
(2)40℃时,将50gKNO3固体加入到100g水中,充分溶解后恢复到原温度,所得溶液中溶质与溶剂的质量比是______。
(3)60℃时,向10g水中加入 Xg KNO3固体形成溶液,再降温到20℃,析出固体的质量随时间的变化如图二所示。
Ⅰ、X的数值是______。
Ⅱ、60℃时形成是______(填“饱和”或“不饱和”)溶液。
Ⅲ、该溶液降温过程中,在60℃、40℃、20℃时对应的溶质质量分数分别为a、b、c则三者的大小关系是______。
Ⅵ、有关实验的说法正确的是______。
A.50℃时,溶液为不饱和溶液
B.40℃时,10gKNO3饱和溶液中含有31.6gKNO3
C.20℃时,若向烧杯中加入100g水,溶质的质量分数不会变
D.溶液从60℃降到20℃析出的固体比在60℃时恒温蒸发90g水析出的固体多
Ⅴ、实验结束后,通过降温结晶的方式不能回收到 XgKNO3固体,理由是______。
4、如图是甲、乙、丙三种固体物质的溶解度曲线,请根据下图回答下列问题:
(1)t2℃时甲物质的溶解度是___________;
(2)t3℃时,在50g水中至少加入___________g乙物质才能形成饱和溶液。
(3)丙物质的不饱和溶液想变成饱和溶液,可行的方法是___________。(答一点即可)
(4)将t2℃时甲、乙、丙三种物质的饱和溶液分别升温到t3℃(忽略水的蒸发),所得溶液溶质质量分数由大到小的顺序是___________。
5、如图是甲、乙、丙三种固体物质的溶解度曲线,根据图示回答:
(1)0℃时,三种物质中溶解度最小的是_____。
(2)将甲溶液由A点转变为B点,可采用的方法是______(填一种)。
(3)t2℃时,将80g丙的饱和溶液与20g水混合后所得溶液中溶质的质量分数为_______。
三、计算题(每小题4分,共计36分)
1、下图是我县某校同学在实验室配制100g溶质质量分数为10%的蔗糖(化学式为C12H22O11)溶液时的实验操作留影。请你也参与到实验中来。
(1)计算需要水的体积为_________mL。
(2)若在量取水时俯视读数,则所得溶液中溶质质量分数_________(填“偏大”、“偏小”、“不变”)。
(3)溶解时需要的玻璃仪器有__________。
(4)若使100g溶质质量分数10%的蔗糖溶液中溶质质量分数增大一倍,通常采用的操作方法是:①增加蔗糖,②蒸发水。请你任选其中一种方法并计算出具体数值_____(写出具体计算过程)。
2、200g盐酸溶液与100g16%的氢氧化钠溶液充分反应, NaOH + HCl = NaCl + H2O求:(相对原子质量: H-1 O-16 Na-23 Cl-35.5 )
(1)盐酸溶液中溶质的质量分数;
(2)所得溶液中溶质的质量分数。
3、实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验中非气态物质的总质量随时间变化如图所示。试分析并计算:
(1)生成氧气的总质量是______g。
(2)反应中二氧化锰的作用是______。
(3)过氧化氢溶液中溶质的质量分数。
4、小路向容器中加入85g过氧化氢溶液在一定条件下分解产生气体的质量变化如图所示。已知每68份质量的过氧化氢完全分解可产生36份质量的水和32份质量的氧气。
(1)最终产生氧气的总质量为_______g。
(2)求原过氧化氢溶液中过氧化氢的质量分数是多少? (质量分数是指混合物中某种物质质量占总质量的百分比)。
5、为了测定一种钢样品的含量,小明称取了12.8g钢样品,投入装有200.0g稀盐酸的烧杯中恰好完全反应(假设样品中的其他物质不与酸反应)。在实验过程中对烧杯(包括溶液和残余固体)进行称量,如下图所示。请计算:
(1)反应生成氢气的质量为_____g。
(2)钢样品中铁的质量分数为_____。
(3)所用稀盐酸的溶质的质量分数。 (写出计算过程)
6、某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的组成,取黄铜样品50g放入锥形瓶中,向其中分5次共加入250克稀硫酸,测得数据记录如下表:
(1)表中m=______g;
(2)黄铜样品中铜的质量分数______;
(3)求所用稀硫酸中溶质的质量分数?(写出计算过程)
7、现在 70g20%的硫酸铵溶液,试计算下列问题。
(1)若向上述溶液中加入 30g 水,求所得溶液中溶质的质量分数?
(2)若向上述溶液中加入10g 硫酸铵,完全溶解,求所得溶液中硫酸铵的质量分数?
8、某浓盐酸瓶上的标签如表所示,则:
(1)该瓶浓盐酸的质量为______克。
(2)取100mL 该浓盐酸与500 mL水均匀混合,所得稀盐酸的质量分数是多少?(结果精确到0.01%)
(3)欲配制100g质量分数为3.6%的稀盐酸,需该浓盐酸质量为多少克?
9、根据所学知识回答下列问题:
(1)要配置质量分数为4%的氯化钠溶液100g来选种,需要氯化钠的质量为___________,水的质量为___________。
(2)如果对100g 4%的NaCl溶液进行如下处理,求所得溶液中溶质质量分数。(假设每次增加的溶质皆完全溶解。以下各题要求写出计算过程,结果精确到0.1%)
①蒸发10g水,所得溶液的溶质质量分数是多少?___________
②增加5g氯化钠后,所得溶液的溶质质量分数是多少?___________
③增加5g氯化钠和5g水后,所得溶液的溶质质量分数是多少?___________
四、实验探究(每小题5分,共计20分)
1、仔细阅读下面的探究实验报告,请你参与评价或分析完成相关问题。
Ⅰ、(探究目的)探究溶解过程中的热现象
Ⅱ、(查阅资料)(1)物质溶解于水的过程中发生了两种变化:溶质分子(或离子)向水中扩散,这一过程要吸收热量;溶质分子(或离子)和水作用,生成水合分子(或水合离子),这一过程要放出热量。溶质不同,这两种过程吸收或放出的热量不同,从而使溶液的温度发生不同变化。(2)常况下,水的凝固点为0℃。
Ⅲ、(提出问题)怎样证明物质A溶解于盛在烧杯中的水后,烧杯中的溶液温度是升高还是降低呢?
Ⅳ、(猜想假设)(1)物质A溶解于盛在烧杯中的水里,如果扩散过程吸收的热量大于了水合过程放出的热量,烧杯中溶液温度则降低,会向外界______(填“吸收”或“释放”)热量;(2)物质A溶解于盛在烧杯中的水里,如果扩散过程吸收的热量______(填“大于”或“等于”或“小于”)水合过程放出的热量,烧杯中溶液温度则升高,会向外界释放热量。
Ⅴ、(实验探究)某同学设计了如图所示装置来探究证明上述猜想假设:将物质A倒入烧杯中,用玻璃棒搅拌,一段时间后,将烧杯提起,看木板是否与烧杯底部粘接在一起。
Ⅵ、(形成结论)(1)若木板与烧杯底部粘接在一起,证明物质A溶解于水时,扩散过程吸收的热量______(填“大于”或“小于”)水合过程放出的热量;
(2)若木板与烧杯底部不粘接在一起,证明物质A溶解于水时,扩散过程吸收的热量小于水合过程放出的热量。
Ⅶ、(反思交流)(1)用玻璃棒搅拌的目的是______。
(2)上述结论(2)是否严密______(填“是”或“不”),其理由是______。
2、我国药学家屠呦呦研制的抗疟疾药物青蒿素挽救了全球数百万人的生命。某化学兴趣小组为探究青蒿素的组成进行了如下实验。
(查阅资料)青蒿素是一种从植物中提取的有机化合物,燃烧时只有二氧化碳和水生成。
(猜想与假设)
猜想一:青蒿素由碳、氢元素组成。
猜想二:青蒿素由______元素组成。
(实验与探究)他们利用如图所示的实验装置进行探究:
实验步骤:
①检查装置气密性;
②打开分液漏斗的活塞,将H2O2溶液加入锥形瓶中,一段时间后,分别称量装置D、E的质量并记录;
③点燃C处的酒精灯,使青蒿素样品完全反应;
④反应结束后,再次称量装置D、E的质量并记录。
(1)装置A中发生反应的化学方程式是______;分液漏斗的优点是______。
(2)装置F的作用是______。
(解释与结论)若青蒿素样品为14.1g,其完全燃烧后,装置D增重9.9g,装置E增重33g(假设各装置均能充分吸收有关气体)。通过计算可确定猜想______正确。得出此结论的理论依据是______。
(3)请设计实验,证明反应后装置E中的溶液中还含有氢氧化钠______。
(4)取反应后装置E中的溶液50g,向其中加入50g溶质质量分数为7.3%的稀盐酸,恰好完全反应得到中性溶液。请计算蒸干该溶液得到的固体的质量______。
3、某化学小组从理论上初步探究“已知质量比的硝酸钾和氯化钠的混合物中提纯硝酸钾”。
(分析提纯方法)
硝酸钾和氯化钠在不同温度时的溶解度
(1)20℃时,NaCl的溶解度为_____。 将20g NaCl加入50g水中配制成_____g NaCl溶液。
(2)根据表中数据,绘制KNO3的溶解度曲线_____。
(3)根据KNO3的溶解度曲线,预测KNO3在70℃时的溶解度约为_____g。
(设计提纯步骤)
①选取样品(85gKNO3和5gNaCl的混合物)
②配制80℃时KNO3的饱和溶液(加水约50mL,水的密度约为1g•mL﹣1)
③降温至20℃
④得到晶体
(设计提纯方案)
(4)为了证明 ④中得到的晶体为纯净的KNO3,该小组同学结合已有知识,从理论上初步设计了以下方案;(不考虑不同溶质对溶解度的相互影响及实验过程中水和固体的损失等影响因素)
方案一 通过化学实验进行检验,取少量④中得到的晶体于试管中,加水配成溶液,滴加_____,观察实验现象没有_____产生,则不含NaCl。
方案二 计算析出KNO3晶体的质量约为_____g(精确到整数)与④中得到晶体的质量进行比较,若相等,则不含NaCl。
4、小黄同学观察到无色透明的葡萄糖溶液放置一段时间会变成黄色,设计如图装置进行实验探究。
(实验步骤)
①按实验编号分别在试管B中加入如下表的物质,排尽气球中的空气;
②连接A、B装置,通入氧气至气球重新鼓起时,关闭止水夹,测得试管B实验数据如下:
请根据以上信息回答问题:
(1)写出仪器M的名称_____。
(2)在实验开始前需要的操作是_____。
(3)实验1配制的溶液溶质质量分数为_____(水的密度为1.0g/mL)。
(4)写出装置A发生反应的化学方程式_____。
(5)通过实验1和2,你得到的结论是_____。
(6)小傅同学认为通过比较实验1、3和4,可得出pH越大葡萄糖溶液变色越快的结论。请指出此实验设计中的错误:_____。
选项
实验目的
实验方案
A
除去水中的异味和色素
用活性炭吸附
B
鉴别硬水和软水
取样,分别加入肥皂水,振荡
C
除去粗盐中的难溶性杂质
溶解,蒸发,结晶
D
探究分子之间有空隙
将水、酒精各50mL倒入100mL量筒中
选项
实验目的
实验方案
A
鉴别真假黄金
观察颜色
B
鉴别氢氧化钠和硝酸铵
取样,加水溶解,测溶液温度
C
除去CO2中少量的CO
通入氧气后点燃
D
鉴别N2和CO2
分别将燃着的木条伸入集气瓶中
温度/℃
10
20
30
40
50
60
溶解度/g
甲
20.9
31.6
45.8
63.9
85.5
110
乙
31.0
34.0
37.0
40.0
42.6
45.5
1
第1次
第2次
第3次
第4次
第5次
累计加入稀硫酸的质量/g
50
100
150
200
250
累计产生气体的质量/g
0.2
m
0.6
0.7
0.7
浓盐酸(HCI)500mL
浓度(质量分数)
36%
密度
1.2g/cm3
温度/℃
0
20
40
60
80
100
溶解度/g
KNO3
13.3
31.6
63.9
110
169
246
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
编号
试管B中加入的物质
温度
pH
变色情况
1
80mL蒸馏水
20g葡萄糖
20℃
7
7天后仍无明显变化
2
80mL蒸馏水
20g葡萄糖
60℃
7
7天后呈浅黄色
3
80mL蒸馏水+1mL稀硫酸
20g葡萄糖
20℃
3
7天后仍无明显变化
4
80mL蒸馏水+1mL氢氧化钠溶液
20g葡萄糖
20℃
11
7分钟后呈浅黄色
相关试卷
这是一份2022年最新人教版九年级化学下册第九单元溶液期末试卷免费版,共12页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
这是一份2022学年最新人教版九年级化学下册第九单元溶液期末模拟试卷免费版,共12页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
这是一份2022学年最新人教版九年级化学下册第九单元溶液期末试卷【免费版】,共14页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。













