

沪教版 (上海)九年级第一学期第三单元 走进溶液世界3.2 溶液达标测试
展开最新人教版九年级化学下册第九单元溶液同步训练试卷【精编】
(考试时间:90分钟,总分100分)
班级:__________ 姓名:__________ 分数:__________
一、单选题(每小题3分,共计24分)
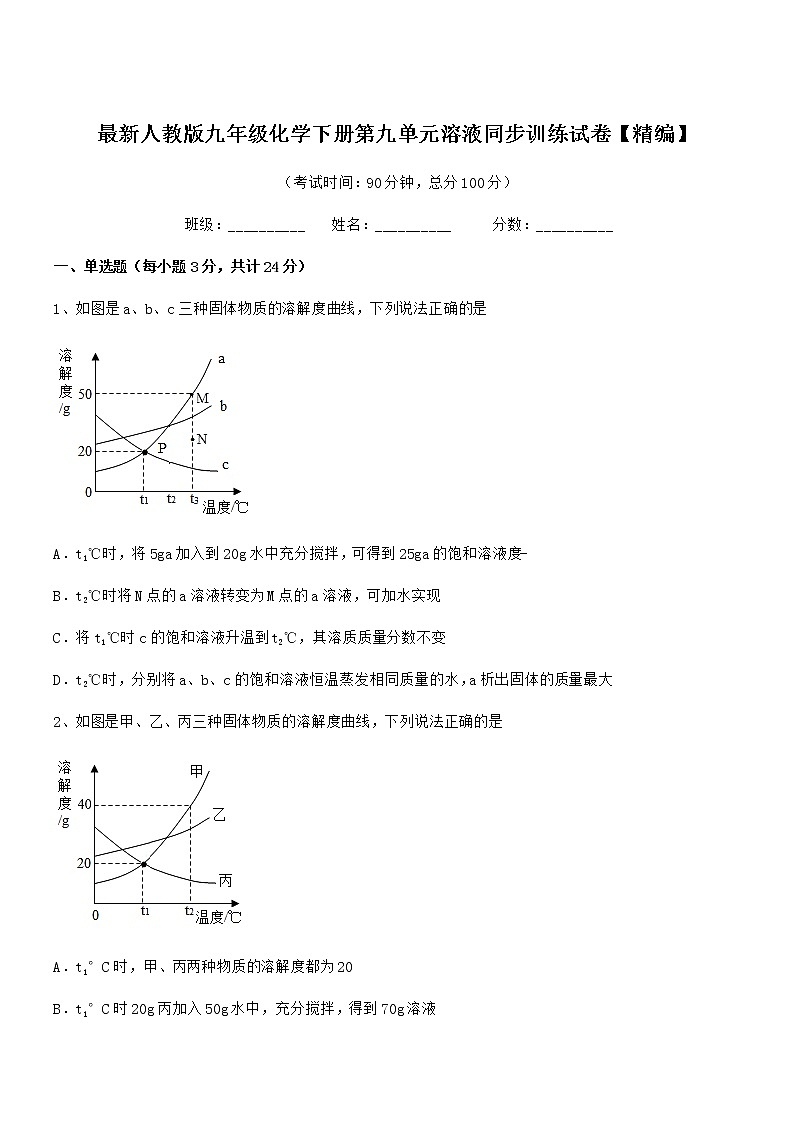
1、如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是
A.t1℃时,将5ga加入到20g水中充分搅拌,可得到25ga的饱和溶液度-
B.t2℃时将N点的a溶液转变为M点的a溶液,可加水实现
C.将t1℃时c的饱和溶液升温到t2℃,其溶质质量分数不变
D.t2℃时,分别将a、b、c的饱和溶液恒温蒸发相同质量的水,a析出固体的质量最大
2、如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是
A.t1°C时,甲、丙两种物质的溶解度都为20
B.t1°C时20g丙加入50g水中,充分搅拌,得到70g溶液
C.将甲、乙、丙三种物质的饱和溶液从t1°C升至t2°C,所得溶液都变为不饱和
D.t2°C时三种物质的饱和溶液降温到t1°C,则所得溶液中溶质质量分数;乙>甲>丙
3、下列实验方案不能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 除去水中的异味和色素 | 用活性炭吸附 |
B | 鉴别硬水和软水 | 取样,分别加入肥皂水,振荡 |
C | 除去粗盐中的难溶性杂质 | 溶解,蒸发,结晶 |
D | 探究分子之间有空隙 | 将水、酒精各50mL倒入100mL量筒中 |
A.A B.B C.C D.D
4、下列有关溶液的说法不正确的是
A.氯化钠溶于水就是钠离子和氯离子在水分子作用下均匀扩散到水中的过程
B.溶液加水稀释前后溶质的质量不变
C.同种溶质的饱和溶液与不饱和溶液通过改变条件可以相互转化
D.均一、稳定的液体一定是溶液
5、如图是甲、乙、丙三种物质的溶解度曲线图,请据图判断下列说法正确的是
A.甲的溶解度大于乙和丙
B.将t1℃时甲的饱和溶液变为t2℃时甲的饱和溶液,可以采用蒸发水的方法
C.当大量甲的固体中含有少量固体丙时,可以采用蒸发结晶的方法提纯甲
D.将t2℃下甲的饱和溶液150g降温到t1℃,则可析出晶体质量为30g
6、下列说法中,错误的是
A.将食盐溶于水后,溶质以分子形式存在 B.洗涤剂可乳化餐具上的油污
C.物质在溶解的过程中,有的放热、有的吸热 D.汽油可溶解衣服上的油渍
7、下列反应或过程所对应的图像正确的是
A. 电解一定质量的水
B. 向等质量的锌粉和铁粉中分别加入足量等浓度的稀盐酸
C. 用两份质量相等、浓度相同的过氧化氢溶液分别制取氧气
D. 向一定质量的硝酸银溶液中加入铜粉
8、配制50g溶质质量分数20%的硝酸钾溶液,下列图示错误的是
A.称固体 B.量液体
C.溶解 D.装瓶贴标签
二、填空题(每小题4分,共计20分)
1、如图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
(1)10℃,甲、乙、丙三种物质的溶解度由小到大的顺序______。
(2)在30℃时,向30克甲物质中加入50克水,充分溶解后所得溶液质量是______。
(3)若乙中混有少量甲,最好采用______的方法提纯乙(填“降温结晶”或“蒸发结晶”)。
(4)30℃时,把等质量的甲、乙、丙三种物质配成各自的饱和溶液,需水最多的是______。
(5)30℃时,甲乙丙三种物质的饱和溶液将其温度降到10℃时所得溶液的溶质质量分数由大到小的是______。
2、如图是几种固体物质的溶解度曲线,回答
(1)10℃时硝酸铵的溶解度是___________。
(2)10℃时把10g氯化钠加入到100g水中充分搅拌,观察到的现象是_____,溶液中存在的溶质的粒子是_______。
(3)约______℃时硝酸钠和硝酸钾的溶解度相等。
(4)70℃ 50g水中最多溶解氯化铵的质量是______。
(5)80℃时150g硝酸钾放入100g水中,充分搅拌,所得溶液中溶质的质量是______,溶质的质量分数是________。小红用此溶液通过降温结晶得到硝酸钾晶体,得到60g硝酸钾晶体需要把溶液温度降至__________℃。
3、如图是A、B、C三种物质的溶解度曲线,回答下列问题:
(1)A物质在t3℃时溶解度为________。
(2)P点表示_______。
(3)t3时把50gA放入50g水中,形成的溶液的质量为______g。
(4)A物质中混有少量B,提纯A方法______(填“降温结晶”或“蒸发结晶”)。
(5)如果分别把A、B、C放入100g水中配成t3℃时的饱和溶液,再冷却到t1℃,溶液中溶质的质量分数大小关系为_____。
4、用下图装置完成“粗盐中难溶性杂质的去除”实验请回答下列问题:
(1)粗盐提纯实验中的操作顺序为______(填序号),以及称量精盐并计算产率。
(2)操作③中玻璃棒搅拌的作用是______。
(3)操作③中,当观察到蒸发皿内出现______时,停止加热,让余热蒸干剩余液体。
5、根据图示信息,用化学用语填空:
(1)写出溶质中金属元素的元素符号______;
(2)写出溶液中大量存在的阴离子的符号______;
(3)写出溶液中溶剂的化学式______;
三、计算题(每小题4分,共计36分)
1、黄铜是铜锌合金,耐腐蚀,许多仿金饰品就是用它来制作的。称取40.0g黄铜样品置于烧杯中,慢慢加入稀硫酸使其充分反应,直至没有气泡产生为止,反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑。过程图示如下:
计算:
(1)反应生成氢气的质量为______g。
(2)所用稀硫酸的溶质质量分数(写出计算过程)。
2、将一定质量的大理石投入50g稀盐酸中,恰好完全发应,放出气体的质量与反应时间的关系如图所示,请回答下列问题:
(1)完全反应后生成二氧化碳气体的质量为___________g;
(2)所用盐酸溶液中溶质的质量分数?(写出计算过程,结果精确到0.1%)
3、回答下列问题
(1)800kg质量分数为0.5%的过氧乙酸消毒液中,过氧乙酸的质量为_____kg。
(2)要配制800kg质量分数为0.5%的过氧乙酸消毒液,需质量分数为16%的过氧乙酸溶液的质量是多少?
4、某化学实验小组的同学对实验室一颗生锈的铁钉产生了兴趣,经称量,生锈的铁钉重7.2克(假设其成分只有Fe和Fe2O3,不含其它杂质),把该铁钉放入一定浓度的稀硫酸中,充分反应,测得产生气体质量与稀硫酸质量关系如图所示。求:
(1)反应结束时产生气体的总质量为________。
(2)所用稀硫酸溶质的质量分数?______
(3)该铁钉中氧化铁的质量分数?______
5、实验室制取二氧化碳结束后,17中学化学兴趣小组的同学对锥形瓶内剩余的固液混合物(以下简称废液)做了如下实验:
请回答下列问题:
(1)实验中发生反应的化学方程式为___________。
(2)根据已知条件列出求解12.5g大理石中碳酸钙质量(x)的比例式___________。
(3)根据实验可知废液中含有的可溶性物质有___________(填化学式);
(4)所用废液中盐酸的质量分数为___________。
(5)操作A的名称为___________。
(6)下图中可以表示H+变化的是___________(填序号)。
6、某石灰石中含有杂质(杂质不溶于水,也不与盐酸反应),一兴趣小组想测定 该样品中碳酸钙的质量,他们将一块样品敲打粉碎后,取出 6g 放入质量为 20g 的烧杯 中,然后加入稀盐酸,用玻璃棒搅拌至不再产生气泡为止,共消耗掉盐酸的质量为 50g。反应所需时间和烧杯及其所盛物质的总质量变化如图所示,求:
(1)生成二氧化碳的质量为______;
(2)此石灰石样品中碳酸钙的质量;
(3)参加反应的盐酸溶液中溶质的质量分数。
7、某食用纯碱中含有少量的氯化钠,为测定高纯碱中碳酸钠(Na2CO3)的含量,现取纯碱样品12.5g,加入150.0g稀盐酸溶液恰好完全反应,测得反应后溶液总质量变为158.1g.计算:
(1)反应中产生CO2的质量.
(2)纯碱样品中Na2CO3的质量分数
(3)求所得溶液中溶质的质量分数
8、已知20℃时氯化钠的溶解度是36g,将20g氯化钠充分溶解在50g水中。求所得溶液中溶质的质量分数是______?(计算结果精确至0.01%)
9、某食品加工厂生产的酱油中氯化钠的质量分数为15%~18%,该厂日产酱油15t。试计算该厂每月(按30天计)消耗氯化钠的质量。
四、实验探究(每小题5分,共计20分)
1、设计实验、动手操作、观察现象、记录信息、提炼证据、进行推理、形成结论是化学学习的重要方法。
(1)学习化学概念“饱和溶液”——实验“KNO3溶于水”
(实验用品)KNO3(研磨处理)、水、玻璃棒、三脚架、石棉网、酒精灯、烧杯等。
(实验探究)在室温20℃下,向小烧杯中加入20mL水,按下表中设计的操作步骤进行实验。
实验序号 | 实验步骤 | 实验现象 | 实验推理 | 实验结论 |
I | 加入2gKNO3,搅拌 | 全部溶解 | 不一定形成饱和溶液 | 在一定温度下,一定量水中不能无限制地溶解溶质 |
Ⅱ | 再加入5gKNO3,搅拌 | 部分溶解 | _____ | |
Ⅲ | 加热,搅拌 | _____ | 不一定形成饱和溶液 | KNO3的溶解度随温度的升高而_____ |
Ⅳ | 再加入5gKNO3,搅拌 | 全部溶解 | 不一定形成饱和溶液 | |
Ⅴ | 放在冷水的大烧杯中冷 | 析出晶体 | 一定形成饱和溶液 | KNO3可用_____的方法结晶 增加溶剂的质量,可将饱和溶液转化为不饱和溶液 |
Ⅵ | _____,搅拌 | 全部溶解 | 一定形成不饱和溶液 |
(实验反思)
①KNO3预先研磨处理的目的是_____。
②实验步骤_____(填实验序号,下同)中KNO3的溶质质量分数最大。
③比较实验步骤 _____中观察到的实验现象,经分析推理,可得出将KNO3饱和溶液转化为不饱和溶液的另一种方法,即升高饱和溶液的温度。
2、某化学兴趣小组的同学为了测定某厂生产的纯碱是否属于优等品(国家规定:优等品中碳酸钠的质量分数不低于99.2%),设计如下两种实验方案:
(1)方案一:称取样品10.65g,加水完全溶解,向其中加入足量的氯化钡溶液,充分反应后,过滤、洗涤、干燥得固体19.70g.通过计算(写出计算过程)______判断该厂的产品是否属于优等品.(杂质可溶于水且不与氯化钡反应)
(2)方案二:用如图所示的装置,通过准确测量排出水的体积,也可计算样品的纯度。该装置中仪使用注射器的优点是__________,但实验后同学们发现所测的碳酸钠的纯度偏低,造成此结果的原因可能是______________.(装置气密性良好)(写一条即可)。
3、设计实验、动手操作、观察现象、记录信息、提炼证据、进行推理、形成结论是化学学习的重要方法。
(1)学习化学概念“饱和溶液”——实验“KNO3溶于水”
[实验用品]KNO3(研磨处理)、水、玻璃棒、三脚架、石棉网、酒精灯、烧杯等。
[实验探究]在室温20℃下,向小烧杯中加入20mL水,按下表中设计的操作步骤进行实验。
实验序号 | 实验步骤 | 实验现象 | 实验推理 | 实验结论 |
I | 加入2gKNO3,搅拌 | 全部溶解 | 不一定形成饱和溶液 | 在一定温度下,一定量水中不能无限制地溶解溶质 |
Ⅱ | 再加入5gKNO3,搅拌 | 部分溶解 | _____ | |
Ⅲ | 加热,搅拌 | ____ | 不一定形成饱和溶液 | KNO3的溶解度随温度的升高而_________ |
Ⅳ | 再加入5gKNO3,搅拌 | 全部溶解 | 不一定形成饱和溶液 | |
Ⅴ | 放在冷水的大烧杯中冷却 | 析出晶体 | 一定形成饱和溶液 | KNO3可用__________的方法结晶 增加溶剂的质量,可将饱和溶液转化为不饱和溶液 |
Ⅵ | _______,搅拌 | 全部溶解 | 一定形成不饱和溶液 |
[实验反思]
①KNO3预先研磨处理的目的是____________________________。
②实验步骤_____________(填实验序号,下同)中KNO3的溶质质量分数最大。
③比较实验步骤 ___________中观察到的实验现象,经分析推理,可得出将KNO3饱和溶液转化为不饱和溶液的另一种方法,即升高饱和溶液的温度。
(2)应用化学知识“身边的化学”——体验“家庭燃料的变迁”
[文献资料]
①天然气和煤都是___________(选填“可再生”或“不可再生”)能源;天然气的主要成分是_______(填化学式)。
②我国近50年来家庭燃料变迁:煤或木柴→液化石油气或管道煤气→天然气
③CO2能产生___________效应,SO2易导致酸雨。
④充分燃烧天然气和煤各1kg产生CO2和SO2的质量如下图所示。
[证据推理]各级政府推广“利用天然气代替煤作家庭燃料”,分析文献资料可知实施该项举措的科学依据是_________________。
[联系实际]为防止燃气泄漏造成危险,使用天然气的家庭“将报警器安装位置确定在燃气灶附近墙壁的上方”,这是基于天然气具有_______________的性质。
[反思拓展]保护生态环境是建设“人类命运共同体”的重要组成部分,我国科学家正在利用和开发H2等新能源,在一定程度上减少对环境的污染。请再列举一例可利用的新能源:______________。
4、某学习小组对CO2展开研究:
Ⅰ.CO2的制备
(1)写出图中标号仪器的名称:①______。
(2)实验室制取CO2的反应原理是为______(写化学方程式)。检查A装置的气密性的一种方法是向分液漏斗中加适量水,堵住右侧导气管,打开分液漏斗活塞,若观察到______,则装置不漏气。
(3)实验发现:制取CO2时,最好选用质量分数为7.5%的稀盐酸。现欲配制100g 7.5%的稀盐酸,需要37%(密度为1.18g / mL)的浓盐酸______mL(计算结果精确到小数点后一位),需要水______mL(精确度同上)。量取水时,若仰视读数(其他操作均正确),则所配稀盐酸的质量分数______7.5%(填“>”或“=”或“<”),配制过程不需要的仪器是______。
A.酒精灯 B.量筒 C.烧杯 D.玻璃棒 E.胶头滴管 F.药匙
Ⅱ.CO2的收集
用以下三种方法收集,每种方法均做三次实验,取平均值。将C装置注射器中足量NaOH溶液注入集气瓶中,充分振荡,测集气瓶内气压。(饱和碳酸氢钠溶液可吸收CO2中的HCl气体,NaOH溶液可用来吸收CO2)
方法1:当B装置开始产气泡15s后,用排水法收集 CO2气体,记录集满CO2气体所要的时间为t;
方法2 :当B装置开始产气泡15s后,用向上排空气法收集,收集时间用方法一所用的平均时间t0;
方法3:当B装置开始产气泡15s后,用向上排空气法收集,同时用燃着木条放在集气瓶口,待木条熄灭,立即盖上玻璃片。
实验数据:
| 方法1 | 方法2 | 方法3 |
瓶内初始气压(kPa) | 104.2 | 104.2 | 104.2 |
三次实验最终气压平均值(kPa) | 9.3 | 31.8 | 39.7 |
CO2纯度 | 91.1% | 69.5% | X |
数据分析:
(4)三种方法均在15s后开始收集的原因是______。
(5)已知:CO2纯度 =,则方法3所收集CO2的纯度为______。通过对比,欲收集更高纯度的CO2,应采用______法收集。
Ⅲ.二氧化碳转化新进展
(6)利用非高热电浆体合成技术可将CO2和甲烷(CH4)反应合成乙酸(CH3COOH),反应的化学方程式为______。
(7)在光催化条件下,CO2和H2反应生成甲烷(CH4)和水,反应的化学方程式为______。
初中化学沪教版 (上海)九年级第一学期3.2 溶液课后测评: 这是一份初中化学沪教版 (上海)九年级第一学期3.2 溶液课后测评,共14页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
化学九年级第一学期3.2 溶液课时训练: 这是一份化学九年级第一学期3.2 溶液课时训练,共12页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
初中化学第三单元 走进溶液世界3.2 溶液随堂练习题: 这是一份初中化学第三单元 走进溶液世界3.2 溶液随堂练习题,共15页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。













