

初中沪教版 (上海)3.2 溶液随堂练习题
展开最新人教版九年级化学下册第九单元溶液同步训练试卷必考
(考试时间:90分钟,总分100分)
班级:__________ 姓名:__________ 分数:__________
一、单选题(每小题3分,共计24分)
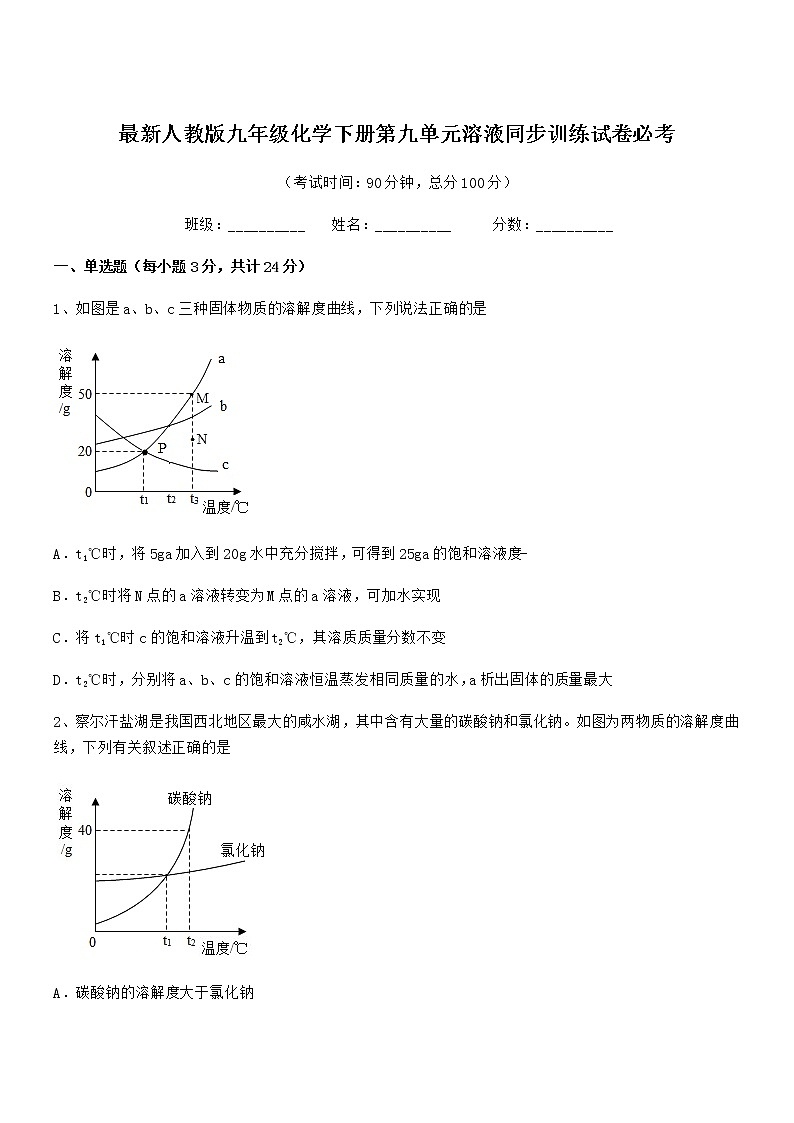
1、如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是
A.t1℃时,将5ga加入到20g水中充分搅拌,可得到25ga的饱和溶液度-
B.t2℃时将N点的a溶液转变为M点的a溶液,可加水实现
C.将t1℃时c的饱和溶液升温到t2℃,其溶质质量分数不变
D.t2℃时,分别将a、b、c的饱和溶液恒温蒸发相同质量的水,a析出固体的质量最大
2、察尔汗盐湖是我国西北地区最大的咸水湖,其中含有大量的碳酸钠和氯化钠。如图为两物质的溶解度曲线,下列有关叙述正确的是
A.碳酸钠的溶解度大于氯化钠
B.t2℃时,可以配制溶质质量分数为40%的碳酸钠溶液
C.将t2℃时两种物质的饱和溶液降温至t1℃,碳酸钠析出的固体较多
D.夏天晒盐可以得到氯化钠,冬天捞碱可以得到碳酸钠
3、如图是KNO3的溶解度曲线,下列说法正确的是
A.60℃时,b、c点对应的都是饱和溶液
B.将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液
C.将b点的饱和溶液降温到a点,有晶体析出
D.60℃时,向50g水中加入60g KNO3,形成不饱和溶液
4、将家庭中常用的四种调味品分别放入水中,不能形成溶液的是
A.白酒 B.花生油 C.蔗糖 D.食盐
5、下列实验方案不能达到实验目的的是
A.除去氧化铜中的炭粉:在氧气流中灼烧
B.区分一氧化碳和甲烷:在空气中点燃,看火焰颜色
C.检验一氧化碳中的二氧化碳:将气体通过澄清石灰水
D.鉴别固体氢氧化钠与硝酸铵:取样,分别溶于水中,观察溶液温度变化
6、物质的溶解度随温度变化的曲线叫做溶解度曲线。利用溶解度曲线,可以获得许多有关物质溶解度的信息。甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是
A.K点表示在t°C时,甲、乙的溶解度不相等
B.35°C时,将20g甲物质加入50g水中,充分溶解后得到的甲物质溶液的质量是70g
C.t°C时乙物质的饱和溶液,升温到35°C时仍是饱和溶液
D.甲物质的溶解度比乙物质大
7、花生油、盐、面酱、醋是厨房中常用的调味品,将它们分别与足量水充分混合后,形成的混合物属于溶液的是
①花生油 ②食盐 ③面酱 ④白醋
A.①③ B.②③ C.①④ D.②④
8、某实验小组提纯粗盐并配制10%NaCl溶液的部分操作如下,下列有关叙述错误的是
A.④中缺少玻璃棒引流溶液
B.①中玻璃棒的作用是搅拌,加速食盐溶解
C.装瓶保存时洒出少量溶液会导致浓度偏低
D.当②蒸发皿中出现较多固体时,停止加热
二、填空题(每小题4分,共计20分)
1、硝酸钾和氯化钾两种物质的溶解度曲线见下图,这两种物质的溶解度见下表
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | 甲 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
乙 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | |
请回答下列问题:
(1)观察溶解度曲线和溶解度表,判断物质乙是指______(填写化学式)。
(2)60℃时,饱和KNO3溶液中混有少量KCl,应采用______的方法提纯KNO3。
(3)60℃时,分别将KNO3和KCl两种物质的饱和溶液温度降至t℃,析出晶体的质量关系为:KNO3______KCl(填系号)。
A.大于 B.等于 C.小于 D.不确定
(4)如图所示,20℃时,将一定质量的KNO3固体放入盛水的试管中,发现有少量固体未溶解,向烧杯的水中加入某物质后,试管内固体能完全溶解,则加入的物质可以是______(填写字母标号)。
①冰块②生石灰③硝酸铵固体④干冰⑤浓硫酸⑥氢氧化钠固体
A.①③④ B.②⑤⑥ C.①③⑤ D.②④⑥
(5)60℃时,将20gKC1固体放入50g水中,降温至20℃,析出晶体的质量是______。
2、实验室配制100 g 溶质质量分数为5%的氯化钠溶液。实验操作如下:
(1)托盘天平右盘上砝码的质量为______g,量取水的体积为______mL(水的密度为1g/mL)。
(2)操作B中玻璃棒的作用是______。
(3)实验操作顺序是______(填序号)。
(4)从配好的溶液中倒出50 g,剩余的溶液溶质质量分数为______。
3、如图是A、B、C三种固体物质的溶解度曲线。
(1)图中P点的含义是___________。
(2)A 、B、C三种物质,溶解度受温度影响最小的是___________。
(3)t1℃时,A 、B、C三种物质的溶解度由大到小的顺序是___________ 。
(4)把A的不饱和溶液变为饱和溶液的方法是___________(任写一条)。
4、阅读下列溶解度曲线,并回答有关问题:
(1)10℃时,硝酸钠的溶解度为______。“氢氧化钙的溶解的曲线”未呈现在“a 图”中的原因是______。
(2)20℃时,11g 硝酸钾投入到 10g 水中,形成的是______(选填“饱和”或“不饱和”)溶液,随着温度的升高,硝酸钾不断溶解,当温度升高到______℃以上时,固体全部溶解。
(3)气体溶解度变化规律是______,若将 CO2通入海水中吸收,应通入______(选填“深”或“浅”)海中。
(4)实验室回收的硝酸钾溶液,若要得到硝酸钾固体,操作的方法是______。
5、下图为甲、乙两种物质(均不含结晶水)的溶解度曲线,请根据图示回答下列问题。
(1)t2℃时,将45g的甲物质放入80g的水中,充分搅拌后得到的溶液质量为___________g。
(2)若甲物质中混有少量的乙物质,可用___________的方法得到较纯的甲物质。
(3)t2℃时,将60g甲的饱和溶液稀释为质量分数10%的溶液,应加水___________g。
三、计算题(每小题4分,共计36分)
1、某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的组成,取黄铜样品50g放入锥形瓶中,向其中分5次共加入250克稀硫酸,测得数据记录如下表:
1 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
累计加入稀硫酸的质量/g | 50 | 100 | 150 | 200 | 250 |
累计产生气体的质量/g | 0.2 | m | 0.6 | 0.7 | 0.7 |
(1)表中m=______g;
(2)黄铜样品中铜的质量分数______;
(3)求所用稀硫酸中溶质的质量分数?(写出计算过程)
2、 “黄铜”即铜锌合金,古代称为“俞石”。由于外观酷似黄金,常被不法商販冒充黄金出售。某实验小组为了辨别真伪,用该合金与稀盐酸反应,将三次实验所得相关的数据记录如下:
物质质量 | 第一次 | 第二次 | 第三次 |
所取合金的质量/g | 25 | 25 | 50 |
所用稀盐酸的质量/g | 120 | 160 | 100 |
充分反应后,剩余物总质量/g | 144.6 | 184.6 | 149.6 |
(1)根据上表数据分析,合金中的锌与稀盐酸恰好完全反应时,所取合金与稀盐酸的质量比为___________。
(2)计算铜锌合金中的铜的质量分数为___________。
(3)计算第3次实验完全反应后所得溶液中溶质的质量分数(计算结果精确到0.1%)。
3、某年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取24g“石头纸”样品(杂质不溶于水也不与稀盐酸反应)。向其中逐渐加入100g稀盐酸,所用稀盐酸的质量与剩余固体的质量关系如图所示,请根据图中的数据进行计算。
(1)“石头纸”样品中碳酸钙的质量为_____g;
(2)样品与100g稀盐酸充分反应后产生二氧化碳的质量为多少?
(3)计算所用稀盐酸中溶质的质量分数。(请根据化学方程式写出完整的计算步骤)
4、向 100 克 16%的氢氧化钠溶液中,加入 100 克稀硫酸恰好完全反应,请计算:
(1)稀硫酸的溶质质量分数?
(2)反应结束后所得溶液的溶质质量分数?
5、实验室有一瓶含有杂质并且部分变质的氢氧化钠样品(其中杂质不含钠元素也不溶于水)。实验小组同学进行了如下实验:
请回答下列问题:
(1)上述实验过程中发生反应的化学方程式_____。
(2)根据已知条件列出样品中参加反应的物质质量(X)的比例式_____。
(3)此样品中未变质的氢氧化钠的质量分数为_____。
(4)将反应后溶液蒸发21.8g水,所得溶液中溶质的质量分数为_____。
(5)将最终所得溶液加水进行稀释,需要的仪器有:烧杯、玻璃棒、_____。
6、实验室常用 3%的过氧化氢溶液制备氧气。
(1)欲配置 100g 3%的过氧化氢溶液,需取用 10%的过氧化氢溶液____________mL。
(2)含 0.04mol 溶质的过氧化氢溶液完全反应,能产生多少克的氧气___________?(根据化学方程式列式计算)
(3)反应结束后,发生装置内剩余气体的主要成分为氧气,请设计实验方案,收集该剩余气体______________。
7、某石灰石中含有杂质(杂质不溶于水,也不与盐酸反应),一兴趣小组想测定 该样品中碳酸钙的质量,他们将一块样品敲打粉碎后,取出 6g 放入质量为 20g 的烧杯 中,然后加入稀盐酸,用玻璃棒搅拌至不再产生气泡为止,共消耗掉盐酸的质量为 50g。反应所需时间和烧杯及其所盛物质的总质量变化如图所示,求:
(1)生成二氧化碳的质量为______;
(2)此石灰石样品中碳酸钙的质量;
(3)参加反应的盐酸溶液中溶质的质量分数。
8、将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为4.0%的氢氧化钠溶液中,边滴加边搅拌随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)。
反应时间/s | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶液温度/℃ | 20.5 | 20.6 | 20.7 | 20.8 | 20.9 | 20.8 | 20.7 |
(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是_________℃。
(2)计算稀盐酸溶质的质量分数(精确到0.1%)。
9、实验室常用锌与稀硫酸反应来制取氢气,反应原理为Zn+H2SO4=ZnSO4+H2↑。某同学取锌粒13g,加入200g稀硫酸中,恰好完全反应,气体全部逸出,反应后溶液的质量为212.6g。试计算所用稀硫酸中溶质的质量分数。
四、实验探究(每小题5分,共计20分)
1、某小组同学在用过氧化氢溶液与制取氧气的过程中,发现反应的速率很慢,产生的气泡很少。对此,它们进行了如下探究:
(猜想与假设)
①速率慢、气泡少可能与过氧化氢溶液的浓度有关。
②速率慢、气泡少可能与的质量有关。
(进行实验)
根据图甲进行如下实验。
实验1:用26mg与5mL不同浓度过氧化氢溶液进行实验,压强变化如乙图1。
实验2:用5mL 1.5%过氧化氢溶液与不同质量进行实验,压强变化如乙图2。
(解释与结论)
(1)实验1得到的结论是 ______ ,实验2的目的是 ______ 。欲得出“能加快过氧化氢的分解”这一结论,需要对比 ______ 。(简要的写出实验设想)
(2)小组同学查阅资料得知:多种物质能催化过氧化氢的分解。
(实验探究)
实验证明,溶液也能显著加快过氧化氢的分解,溶液主要含有三种粒子( ),稀硫酸中含有三种粒子()为了进一步探究 溶液中哪种粒子能起催化作用,小组同学作了以下分析和设计:
①小组同学认为最不可能的是,他们的理由是 ______ 。
②要说明另外的两种粒子是否起到催化作用,小组同学设计了如下实验,完成探究活动。
实验步骤 | 实验现象 | 结论 |
a.取一支试管加入5mL 5%过氧化氢溶液,然后加入2-3滴稀硫酸 | 溶液中几乎没有气泡放出 | 验证明,起催化作用的是 ______ 。 |
b.另取一支试管加入5mL 5%过氧化氢溶液,然后加入2-3滴硫酸铜溶液 | 溶液中有大量气泡放出 |
(3)(反思与评价)
小组同学在进行实验1和2制取氧气过程中,发现反应的速度很慢,产生的气泡很少的原因可能是 ______ 、 ______ 。
(4)利用图甲装置不能探究“温度对过氧化氢分解速率”的影响,其理由是 ______ 。
2、某化学兴趣小组展示了他们设计的“火龙生字”创新实验。用硝酸钾的热饱和溶液先在白纸上书写“火”字,晾干后白纸上出现硝酸钾晶体如图1所示。用带火星的木条接触硝酸钾晶体,立即有火花出现,并缓慢地沿着字的笔迹蔓延,最后呈现出“火”字的黑色痕迹(如图2所示)。
现场的同学对此产生了浓厚的兴趣,随后进行了如下研究:
(提出问题)为什么附有硝酸钾的白纸更容易燃烧?
(查阅资料)硝酸钾不可燃烧,但受热易分解,生成亚硝酸钾(KNO2)和一种常见的气体单质。
(猜想与假设)对于产生的是什么气体,四位同学有如下猜测:
甲:二氧化氮;乙:氮气;丙:氧气;丁:氢气。
丙同学首先排除了二氧化氮,理由是____;乙同学认为也不可能是氢气,他的理由是____。
(进行实验)四位同学设计了实验对丙同学的猜想进行了验证,取少量硝酸钾晶体放入试管中加热,观察到的现象是_______,证明丙同学的猜想正确,硝酸钾分解的化学方程式是_______。
(解释与结论)白纸上写过字的地方更容易燃烧的原因是_______。
(反思与评价)为什么要用“硝酸钾的热饱和溶液”书写文字?
已知硝酸钾在不同温度时的溶解度如下表:
温度/°C | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 31.6 | 63.9 | 110 | 169 | 246 |
你对上述问题的解释是:_______。
3、某小组同学向盛有MnO2的试管中加入H2O2溶液,发现有大量气泡和水雾生成。小组同学对H2O2分解反应进行了深入的研究。
Ⅰ.探究水雾产生的原因
(进行实验)分别向三只试管中依次加入0.5gMnO2和30mL溶质质量分数不同的H2O2溶液,用温度传感器测定反应过程中溶液温度的变化,现象如下。
溶液 | 5%H2O2溶液 | 10%H2O2溶液 | 30%H2O2溶液 |
温度变化 | |||
水雾 | 有少量水雾 | 有较多水雾 | 有大量水雾 |
(解释与结论)
(1)在MnO2作催化剂的条件下,H2O2发生分解反应的化学方程式为_______,该反应_______热量(填“吸收”或“放出”)。
(2)H2O2溶液的溶质质量分数与反应中溶液温度变化的关系是_______。
(3)根据以上实验,可得出的结论是_______。
Ⅱ.探究影响H2O2分解反应速率的因素。
(实验方案)
试验编号 | H2O2溶液 | 蒸馏水 | 催化剂 | 温度/°C | |
溶质质量分数 | I'/ mL | I'/ mL | |||
① | 10% | 10 | 20 | 无催化剂 | 20 |
② | 10% | 10 | 20 | 0.5gMnO2 | 20 |
③ | 10% | 15 | x | 0.5gMnO2 | 20 |
(4)对比实验①②,目的是探究_______与H2O2分解反应速率是否有关。
(5)实验②③,目的是探究溶质质量分数与H2O2分解反应速率是否有关,则实验③中x是_______(填字母序号)。
a 15 b 30
(实验过程及分析)
在恒温恒容的密闭容器中完成以上实验,用压强传感器测量反应过程中容器内的气体压强随时间的变化,实验数据如下图所示。
(6)能证明溶质质量分数对H2O2分解反应速率有影响的证据是_______。
4、请从A或B两题中任选1个作答。如图在三只试管中进行实验。
A | B | ||||
①固体溶解形成紫色溶液 | ②固体几乎不溶解 | ③固体溶解,形成紫红色溶液 | ①紫色石蕊小花不变红 | ②紫色石蕊小花不变红 | ③紫色石蕊小花变红 |
(1)对比实验①、②的现象,可得出的结论是 。 (2)设计实验②、③的目的是 。 | (1)设计实验①的目的是 。 (2)对比实验①、②、③的现象,可得出的结论是 。 | ||||
A _______ , ________ 。B _________ , _________ 。
2022年度最新人教版九年级化学下册第九单元溶液期末试卷必考: 这是一份2022年度最新人教版九年级化学下册第九单元溶液期末试卷必考,共13页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
2022年度最新人教版九年级化学下册第九单元溶液期末试卷(必考): 这是一份2022年度最新人教版九年级化学下册第九单元溶液期末试卷(必考),共16页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
沪教版 (上海)九年级第一学期3.2 溶液课时练习: 这是一份沪教版 (上海)九年级第一学期3.2 溶液课时练习,共13页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。













