

初中沪教版 (上海)3.2 溶液当堂达标检测题
展开最新人教版九年级化学下册第九单元溶液同步训练试卷【完整】
(考试时间:90分钟,总分100分)
班级:__________ 姓名:__________ 分数:__________
一、单选题(每小题3分,共计24分)
1、下列饮料中,不属于溶液的是
A.啤酒 B.汽水 C.冰红茶 D.酸奶
2、下列图像能正确反映对应变化关系的是
A. 木炭在密闭的容器内燃烧
B. 加热一定量的氯酸钾和二氧化锰固体
C. 一定温度下,向一定量接近饱和的KNO3溶液中加入KNO3固体
D. 等质量的粉末状、块状石灰石分别与质量分数相同的足量稀盐酸反应
3、某温度下有一杯饱和的硝酸钾溶液,欲使其溶质的质量分数发生改变,下列操作可行的是
A.加入一定质量的硝酸钾晶体 B.升高温度
C.降低温度 D.恒温蒸发溶剂
4、配制50g溶质质量分数20%的硝酸钾溶液,下列图示错误的是
A.称固体 B.量液体
C.溶解 D.装瓶贴标签
5、如图所示,向烧杯中加入某物质后,试管底部的粉末减少,则加入的物质可能是
A.氢氧化钠 B.碳酸钙
C.硝酸铵和氢氧化钙 D.氯化钠
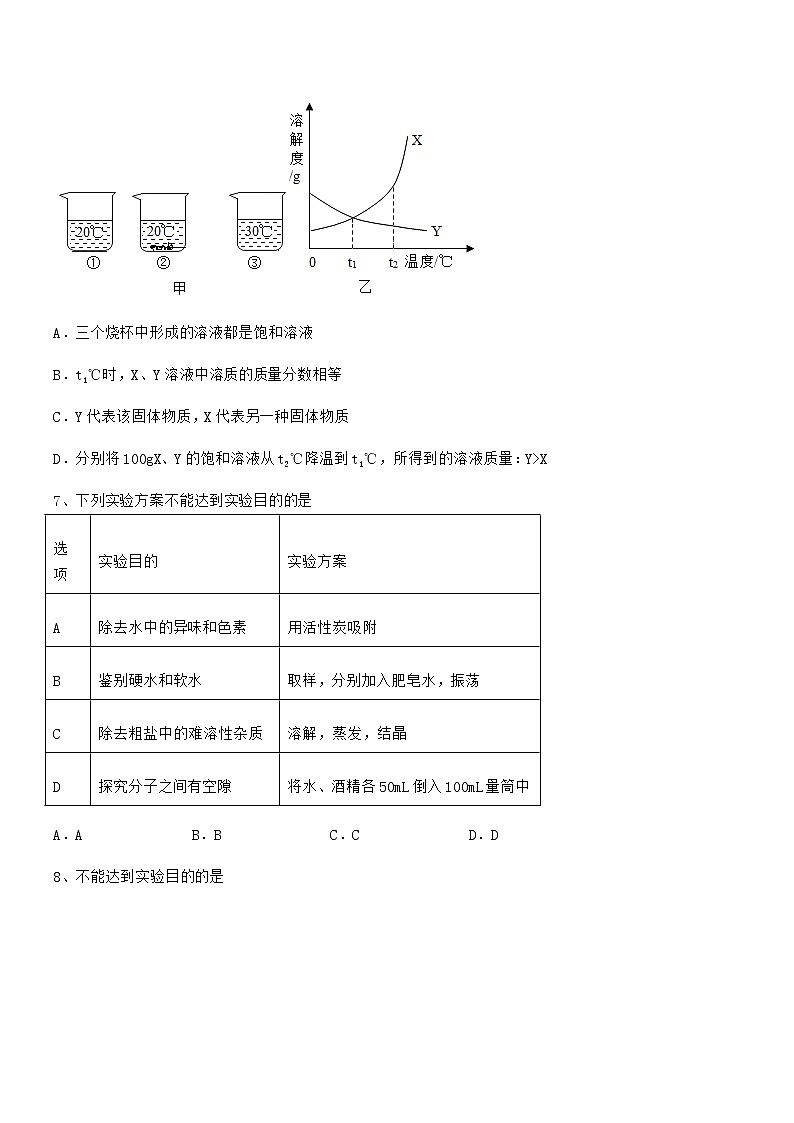
6、向盛有等量水的三个烧杯中分别加入某固体物质10g、25g、25g,如图甲所示是充分溶解后的现象,如图乙所示是该固体物质和另一种固体物质的溶解度曲线。
下列有关说法正确的是
A.三个烧杯中形成的溶液都是饱和溶液
B.t1℃时,X、Y溶液中溶质的质量分数相等
C.Y代表该固体物质,X代表另一种固体物质
D.分别将100gX、Y的饱和溶液从t2℃降温到t1℃,所得到的溶液质量:Y>X
7、下列实验方案不能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 除去水中的异味和色素 | 用活性炭吸附 |
B | 鉴别硬水和软水 | 取样,分别加入肥皂水,振荡 |
C | 除去粗盐中的难溶性杂质 | 溶解,蒸发,结晶 |
D | 探究分子之间有空隙 | 将水、酒精各50mL倒入100mL量筒中 |
A.A B.B C.C D.D
8、不能达到实验目的的是
实验设计 | ||||
实验目的 | A.检查装置的气密性 | B.验证蜡烛中含有碳元素 | C.室温下比较氯化钠在不同溶剂里的溶解性 | D.除去二氧化碳中混有的少量一氧化碳 |
A.A B.B C.C D.D
二、填空题(每小题4分,共计20分)
1、小明同学在化学实验室制作“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液。请回答下列问题:
(1)若用氢氧化钠固体配制,需用______称取氢氧化钠______g。用______量取______mL的水,读数时若俯视,会使溶质质量分数______。(填偏大、偏小、不变)(已知ρ水=1g/cm3)。
(2)若用25%的氢氧化钠溶液配制,需25%的氢氧化钠溶液______g,水______g。
2、下表是NaCl和Na2CO3在不同温度下的溶解度:
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度/g | NaCl | 35.0 | 35.5 | 36.0 | 36.5 | 37.0 |
Na2CO3 | 6.0 | 10.0 | 18.0 | 36.5 | 50.0 | |
(1)在______℃时,在10g水中能够溶解的NaCl和Na2CO3质量相同。
(2)生活在盐碱湖附近的人们,最容易从湖中得到纯碱的季节是______(填“夏季”或“冬季”)。
(3)40 ℃时,向5 g NaCl中加10 g水,可得溶质质量分数为______的溶液。
3、以化合价为纵坐标,物质的类别为横坐标所绘制的图象叫价类图,如图为碳的价类图,请根据图中信息填空。
(1)A点表示的物质类别是______。
(2)D点表示的物质在常温下易分解为B,则D的化学式为______。
(3)写出A与B反应生成C的化学方程式______。
(4)根据图1、图2中三种固体物质的溶解度曲线回答问题(水为溶剂)。
①分析图1,P点的含义是_________;
②若A中混有少量的B,可采用_________的方法提纯A;
③取一定质量的A的饱和溶液,将溶液温度从t℃降低到10℃,溶液中溶质的质量分数_________(填“增大”、“减小”或“不变”);
④分析图2,要使C的饱和溶液变成不饱和溶液,可采用的方法是:______或_____。
4、下列是MgSO4和KC1的溶解度表及溶解度曲线。
温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | |
溶解度/g | MgSO4 | 33.7 | 38.9 | 44.5 | 50.6 | 54.6 | 55.8 | 52.9 | 52.2 |
KC1. | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | 51.1 | 54.0 | |
请分析后回答下列问题:
(1)代表KCl溶解度曲线的是__________(填“甲”或“乙”)。
(2)t3℃时,等质量的两种物质饱和溶液,均降温到t1℃,析出晶体质量关系甲__________乙(填“>”“<”或“无法确定”).
(3)t2℃的范围为 (填字母)。
A.30-40 B.40-50 C.70-80 D.80-90
(4)t3℃时MgSO4的饱和溶液降温到t1℃,溶液中溶质的质量分数的变化情况是 (填字母)。
A.始终不变 B.先增大后减小 C.先减小后增大 D.先不变后减小 E.先不变后增大
5、随着水资源的污染越来越严重,水资源的保护和合理利用已受到人们的普遍关注。请参与讨论下列有关问题:
(1)下列能确认水是由氧元素和氢元素组成的实验是___________(填序号)
①水的蒸馏 ②水的蒸发 ③水的电解 ④水的净化
(2)在一些地方,用抽取的地下水洗衣服时,肥皂不易起泡沫且产生浮渣,其可能的原因是该地下水是___________(填“硬水”或“软水”)。
(3)有媒体曝光过,有一辆某品牌大货车,行驶在高速公路上,汽车后轮突然冒出滚滚浓烟并燃烧起来,幸好消防人员及时赶到并用高压水枪喷射货车油箱和轮胎,才得以扑灭。请解释向轮胎喷水能灭火的原因是___________。
(4)水是常用的溶剂。若要配制50g5%的氯化钠溶液,需要进行如下的操作:①计算(需要氯化钠2.5g):②用托盘天平称量2.5g氯化钠;③用___________(填“10mL”或“50mL”)量筒量取___________mL水(水的密度为lg/mL);④将两者置于烧杯中,用玻璃棒搅拌,玻璃棒搅拌的目的是___________。
三、计算题(每小题4分,共计36分)
1、为测定一瓶久置过氧化氢溶液的溶质质量分数,实验操作如图1所示,电子天平示数如图2所示。请计算:
(1)完全反应后生成氧气的质量为______。
(2)该过氧化氢溶液中溶质的质量分数。
2、现有80g 10%的硝酸钠溶液,若向上述溶液中加入20g水,则所得溶液中溶质的质量分数是多少?(写出计算过程)
3、某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的组成,取黄铜样品50g放入锥形瓶中,向其中分5次共加入250克稀硫酸,测得数据记录如下表:
1 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
累计加入稀硫酸的质量/g | 50 | 100 | 150 | 200 | 250 |
累计产生气体的质量/g | 0.2 | m | 0.6 | 0.7 | 0.7 |
(1)表中m=______g;
(2)黄铜样品中铜的质量分数______;
(3)求所用稀硫酸中溶质的质量分数?(写出计算过程)
4、 “石头纸”是用沿海水产养殖中大量废弃贝壳制得的。为测定其中碳酸钙(杂质不溶于水也不与水反应)的含量,某同学进行了如下实验。取25.0 g样品粉碎放入烧杯中,加入一定质量分数的稀盐酸,所加稀盐酸的质量与生成气体的质量关系如图所示。
(1)根据图示观察,生成气体的质量是______克。
(2)计算“石头纸”中碳酸钙的质量分数。
(3)此稀盐酸的溶质质量分数?
(4)完全反应后烧杯内溶液的溶质质量分数是多少?(结果精确到0.1%)
5、在生活中我经常食用食醋,根据所学知识回答下列问题。
(1)食醋中溶质醋酸的化学式___________。
(2)醋酸这种物质由___________构成。
(3)醋酸中碳元素的质量分数是___________。
(4)200 克溶质质量分数为 3%的醋酸溶液中碳元素的质量为___________。
6、 “黄铜”是铜锌合金,具有较机械性能,比纯铜耐腐蚀。现将20g黄铜投入100g稀硫酸中,恰好完全反应,剩余的溶液和残余固体总质量为119.8g。
已知:Zn+H2 SO4=ZnSO4+ H2↑。
请计算:
(1)产生氢气的质量为________g。
(2)这种黄铜中锌的质量为多少?
(3)所用稀硫酸的溶质质量分数是多少?
7、将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为4.0%的氢氧化钠溶液中,边滴加边搅拌随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)。
反应时间/s | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶液温度/℃ | 20.5 | 20.6 | 20.7 | 20.8 | 20.9 | 20.8 | 20.7 |
(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是_________℃。
(2)计算稀盐酸溶质的质量分数(精确到0.1%)。
8、过氧化氢溶液常用于家庭、医疗等方面,它具有杀菌、漂白、防腐和除臭等作用,医疗上常用3%的过氧化氢溶液消毒。若要配制500g溶质质量分数为3%的过氧化氢溶液,需溶质质量分数为30%的过氧化氢溶液多少g?需水多少g?
9、中华文化源远流长,早在西汉时期《淮南万毕术》一书中就有“曾青得铁则化为铜”的记载,这是我国现代“湿法炼铜”的先驱。利用此原理,向160kg含硫酸铜的废液中加入足量的铁粉,得到金属铜6.4kg。请计算废液中硫酸铜的溶质质量分数。
四、实验探究(每小题5分,共计20分)
1、同学们在实验室用下图装置制取氧气。
(1)加热高锰酸钾时,试管口略向下倾斜的原因是 ______ 。
实验后,同学们发现沾有高锰酸钾的白抹布洗完晾干后变为棕褐色。
(查阅资料)
草酸溶液能将棕褐色物质除去。
(提出问题)
哪些因素能加快草酸除去棕褐色物质的速率?
(进行实验)
将均匀染有棕褐色的抹布剪成大小相同的小布条进行实验
实验 编号
| 实验1 20℃ 水
| 实验2 20℃ 0.5%草酸溶液 | 实验3 20℃ 0.25%草酸溶液 | 实验4 20℃ 0.125%草酸溶液 | 实验5 30℃ 0.25%草酸溶液 | 实验6 40℃ 0.25%草酸溶液 |
现象 | 颜色 没有褪去 | 70秒后 颜色褪去 | 98秒后 颜色褪去 | 150秒后 颜色褪去 | 51秒后 颜色褪去 | 40秒后 颜色褪去 |
(解释与结论)
(2)配制200g溶质质量分数为 0.5%的草酸溶液,需要草酸的质量为 ______ 。
(3)实验1的目的是 ______ 。
(4)证明升高温度能加快草酸除去棕褐色物质的速率,需要对比 ______ (填实验序号)。
(5)由实验2、3、4可以得出的结论是 ______ 。
(反思与评价)
(6)实验后,同学们查资料得知抹布上的棕褐色物质为二氧化锰,请你设计实验方案进行验证 ______ 。
2、对比归纳是学习化学的重要方法。请你参与下列探究活动并回答问题:
实验一:探究影响硫燃烧剧烈程度的因素。
分别将硫在空气和氧气中燃烧如图。 ①硫在氧气里燃烧的化学方程式为___; ②硫在氧气里燃烧比在空气里燃烧更剧烈,说明了影响硫燃烧剧烈程度的因素是___。 |
实验二:探究燃烧条件。
如图是小明同学设计的对比实验,用于探究燃烧条件铜片上白磷燃烧,水中白磷不燃烧,由此说明燃烧条件之一是___。将烧杯中的热水倒出,水中白磷露出水面,能观察到的现象是____。 |
实验三:探究影响物质溶解性的因素。
①小红同学做了如图所示A试管和B试管的对比实验,发现B中固体可溶,A中几乎不溶。该对比实验说明了影响物质溶解性的因素是_____; ②小明同学补充了如图C所示实验,他想探究的影响因素是_____。 |
3、对比归纳是学习化学的重要方法。请你参与下图三个探究活动并回答问题。
(探究活动一)探究影响木炭燃烧剧烈程度的因素:
木炭在氧气中燃烧比在空气中燃烧更剧烈,说明了影响木炭燃烧剧烈程度的因素是_____。
(探究活动二)探究影响物质溶解性的因素:
(1)同学们做了A试管和B试管的对比实验,发现B试管中固体可溶,A试管中固体几乎不溶。该对比实验说明了影响物质溶解性的因素是_____。
(2)同学们又补充了C试管所示实验,他们想探究的影响因素是_____。
(探究活动三)探究二氧化碳能否与水、饱和石灰水、氢氧化钠溶液反应:
小明分别振荡三个软质塑料瓶,观察到塑料瓶都变瘪且变瘪的程度由大到小的顺序为A>B>C。
(1)小明认为二氧化碳与三种物质都能发生反应,你认为小明的结论_____(填“是或否”)正确,理由是_____。
(2)B瓶中发生反应的化学方程式为_____。
(3)对比A瓶与_____瓶的实验现象,可证明二氧化碳能与氢氧化钠溶液发生反应且溶质的溶解性更强。
4、探究一:用锌制取氢气。甲同学拟用如图实验装置完成制取氢气和测量生成气体体积的实验:
(1)装置连接顺序是:A→______→______→D(填字母)。
探究二:硫酸铜对氢气生成速率的影响。乙同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率,为此展开探究。
(设计实验)
在锥形瓶中分别放入足量的、等质量的、颗粒大小相同的锌粒,再向分液漏斗中加入由31.5%的稀硫酸,不同体积水、5%的硫酸铜溶液组成的混合液,试剂用量记录如表:
混合液(试管编号) | ① | ② | ③ | ④ | ⑤ |
31.5%的H2SO4溶液/mL | 10 | V1 | 10 | 10 | 10 |
5%的CuSO4溶液/mL | 3.6 | 3.8 | 4.0 | 4.2 | 4.4 |
蒸馏水/mL | 16.4 | 16.2 | 16.0 | 15.8 | V2 |
收集70mL水所用时间/s | 21.2 | 20.4 | 19.7 | 20.5 | 21.3 |
(2)表中的V1______mL,V2=______mL。
(分析与结论)
(3)表中______组反应速率最快该组的原混合液中H2SO4和CuSO4溶质的质量比为______。(最简整数比)。(提示:31.5%的H2SO4溶液和5%的CuSO4溶液密度均为1.2g/mL)。
初中化学沪教版 (上海)九年级第一学期3.2 溶液当堂检测题: 这是一份初中化学沪教版 (上海)九年级第一学期3.2 溶液当堂检测题,共15页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
沪教版 (上海)九年级第一学期第三单元 走进溶液世界3.2 溶液同步训练题: 这是一份沪教版 (上海)九年级第一学期第三单元 走进溶液世界3.2 溶液同步训练题,共14页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
初中沪教版 (上海)3.2 溶液同步训练题: 这是一份初中沪教版 (上海)3.2 溶液同步训练题,共14页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。













