

2021-2022年度最新人教版九年级化学下册第九单元溶液期中复习试卷下载
展开这是一份2021-2022年度最新人教版九年级化学下册第九单元溶液期中复习试卷下载,共17页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
最新人教版九年级化学下册第九单元溶液期中复习试卷下载
(考试时间:90分钟,总分100分)
班级:__________ 姓名:__________ 分数:__________
一、单选题(每小题3分,共计24分)
1、如图是a、b、c三种固体物质的溶解度曲线,下列分析正确的是
A.若b中混有少量的a,可采用降温结晶的方法提纯b
B.t2℃时,物质a的100g饱和溶液中含有25g物质a
C.t3℃时,分别将a、b、c的饱和溶液降温至t1℃,溶质质量分数关系是b>a=c
D.t2℃时向50g水中加入15g物质b充分搅拌,所得溶液质量一定小于65g
2、不能达到实验目的的是
实验设计 | ||||
实验目的 | A.检查装置的气密性 | B.验证蜡烛中含有碳元素 | C.室温下比较氯化钠在不同溶剂里的溶解性 | D.除去二氧化碳中混有的少量一氧化碳 |
A.A B.B C.C D.D
3、能与水混合形成溶液的是
A.冰 B.蔗糖 C.植物油 D.粉笔灰
4、从化学的角度对下列词句进行解释,错误的是
A.点石成金——化学反应中元素种类可以发生改变
B.用洗洁精可除去油污——洗洁精对油污有乳化作用
C.真金不怕火炼——金的化学性质不活泼
D.用铜和黄铜相互刻画,铜上留有更深的划痕——合金的硬度比组成它的纯金属大
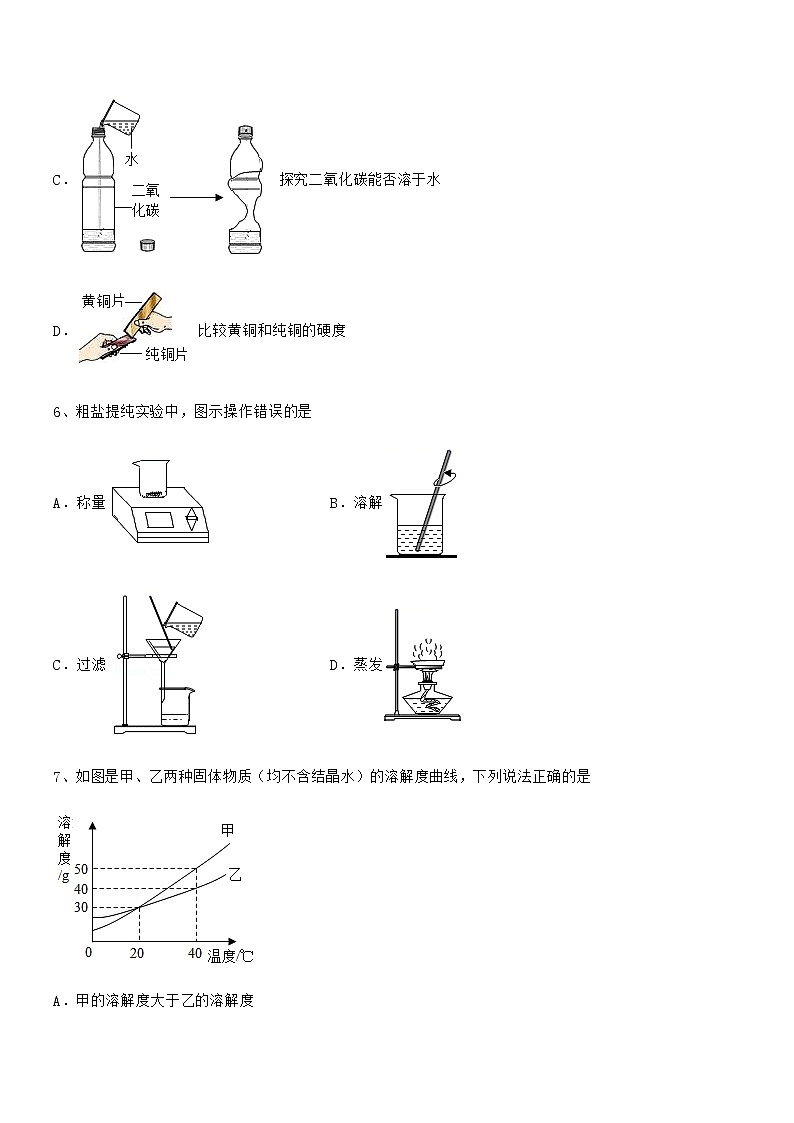
5、下列所示实验设计不能达到预期目的的是
A. 验证质量守恒定律
B. 验证生石灰遇水放热
C. 探究二氧化碳能否溶于水
D. 比较黄铜和纯铜的硬度
6、粗盐提纯实验中,图示操作错误的是
A.称量 B.溶解
C.过滤 D.蒸发
7、如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是
A.甲的溶解度大于乙的溶解度
B.甲中含有少量的乙,可用蒸发溶剂的方法提纯甲
C.40℃时等质量的甲、乙饱和溶液降温到20℃时,析出晶体的质量甲一定大于乙
D.20℃时,甲、乙溶液的溶质质量分数相等
8、下列有关溶液的说法错误的是
A.溶液是均一、稳定的混合物
B.溶液中的溶质可以是固体、液体或气体
C.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
D.氯化钠溶于水就是钠离子和氯离子在水分子作用下均匀扩散到水中的过程
二、填空题(每小题4分,共计20分)
1、家庭消毒常用“84”消毒液,请回答下列问题。
(1)“84”消毒液的有效成分次氯酸钠(NaClO)中氯元素的化合价为______价。
(2)已知次氯酸钙和次氯酸钠的构成相似,次氯酸钠由钠离子(Na+)和次氯酸根离子(C1O-)构成,则次氯酸钙的化学式为______。
(3)Cl2常作自来水消毒剂,其实验室制法为:,X的化学式为______。
(4)水溶液在生产和生活中有着广泛的应用。冬天在汽车的水箱中加入少量乙二醇,可使水溶液的凝固点______,(填“升高”或“降低”或“不变”)以防止水结冰。
2、下表是KNO3和NaCl两种固体物质在不同温度下的溶解度,请回答:
温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度(g) | KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | |
(1)上述两种物质中溶解度受温度影响比较大的是________。
(2)要使KNO3从其溶液中全部结晶出来,应该采用的结晶方法是______。
(3)60℃时,用100g水配成KNO3饱和溶液再将其降温到10℃,析出结晶_______g。
3、根据所给氯化钠和碳酸钠的溶解度及溶解度曲线的信息,回答下列问题。
温度/°C | 0 | 10 | 20 | 30 | 40 | |
溶解度 | 氯化钠/g | 35.7 | 35.8 | 36 | 36.3 | 36.6 |
碳酸钠/g | 6 | 10 | 18 | 36.5 | 50 | |
(1)如图中表示Na2CO3溶解度曲线的是___________(填“A”或“B”),10℃时将3.5 g NaCl加入10g水中充分溶解,得到的是___________(填“饱和”或“不饱和”)溶液。
(2)m点表示的意义是___________。
(3)t2℃时将40g固体A加入50g水中,充分搅拌后,所得溶液的溶质质量分数为___________(结果精确到0.1%)。
(4)若Na2CO3中混有少量的NaCl,提纯Na2CO3应采取的方法是___________(填“降温结晶”或“蒸发结晶”)。
4、根据图示信息,用化学用语填空:
(1)写出溶质中金属元素的元素符号______;
(2)写出溶液中大量存在的阴离子的符号______;
(3)写出溶液中溶剂的化学式______;
5、如图是某输液瓶标签上的部分内容。由此可知,葡萄糖由___种元素组成,其中葡萄糖中碳与氢元素的质量比为___。要把100g这种葡萄糖溶液稀释为1%的溶液,需要加入水的质量为___g。
三、计算题(每小题4分,共计36分)
1、20℃时,将200g10%的氢氧化钠溶液变为20%的氢氧化钠溶液,
(1)若蒸发,需要蒸发掉多少克水?
(2)若加溶质,需要加入多少克氢氧化钠?(请写出计算步骤)
2、有效预防登革热的方法之一就是用杀虫剂对室外水沟、垃圾池周围以及有杂草的地方进行喷洒灭蚊。某街道决定采用高效氯氰菊酯杀虫剂进行喷杀,瓶上的标签如下表所示。求:
氯氰菊酯杀虫剂1000mL | |
溶质的质量分数 | 80% |
密度 | 1.2g/cm3 |
具有强毒性,阴冷,密封储藏 | |
(1)1000mL氯氰菊酯杀虫剂的质量是___________g,其中含溶质氯氰菊酯___________g。
(2)欲配制30kg溶质质量分数为20%的氯氰菊酯杀虫剂来消毒,需要这种氯氰菊酯杀虫剂的质量是多少?
3、将含杂质的铁样品7g放入盛有121.6g稀盐酸溶液的烧杯中,刚好完全反应(杂质既不溶于水,也不与酸反应),称得反应后烧杯内物质的总质量为128.4g。(已知:铁与稀盐酸反应生成氯化亚铁和氢气)求
(1)生成氢气的质量_____。
(2)铁样品中铁的质量分数_____。
4、实验室中经常要使用氢氧化钠溶液,现有溶质质量分数为80%的氢氧化钠溶液。请计算:
(1)400 g溶质质量分数为80%的氢氧化钠中所含溶质的质量是______g。
(2)若要将80%的氢氧化钠溶液稀释成400 g 40%的氢氧化钠溶液,则需要80%的氢氧化钠溶液质量为______g,需要加水的质量为______g。(写出计算过程)
5、为了测定黄铜样品中铜的质量分数,深究悉讨小组进行了如图实验:
请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为___________。
(2)求解20g黄铜样品中参加反应的物质的质量(x)的比例式___________。
(3)黄铜样品中铜的质量分数是___________。
(4)不法商家用黄铜冒充黄金,为了鉴别真假黄金,可以选用什么化学试剂___________。
(5)《淮南万毕术》一书中写到“曾青得铁则化为铜”,请用化学方程式表示___________。
(6)欲将300g上述黄铜样品转化为铜盐,可将过滤后的固体滤渣洗涤、干燥,然后再空气中充分加热,可以得到氧化铜的质量是___________,再经过某些反应及操作就得到了所需的铜盐。
(7)慎思明辨小组同学收集了一些废铜屑,他们欲用这些废铜屑制取硫酸铜,设计了如下两个方案:
方案1:CuCuOCuSO4
方案2:CuCuSO4[已知Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O]
从节约原料的角度出发,上述两个方案中,你认为比较合理的是___________方案(填“1”或“2”),80克Cu与含H2SO4196g的浓硫酸反应得到硫酸铜的质量___________160g(填大于、小于、等于)。
(8)勇往直前小组查阅资料发现:铝不仅能与酸反应产生氢气,还能与氢氧化钠溶液反应可生成H2(2Al+2NaOH+2H2O═2NaAlO2+3H2↑)。取3g纯铝片和40g一定溶质质量分数的氢氧化钠溶液,充分反应后,铝片有剩余,称得反应后剩余物质的总质量为42.7g。请计算:
①生成氢气的质量是___________g。
②所用氢氧化钠溶液的氢氧化钠的质量分数为___________。
③写出铝与稀硫酸反应的化学方程式___________。
④等质量的铝分别与足量的稀盐酸和氢氧化钠溶液反应产生氢气的质量比为___________。
6、某化学兴趣小组取部分变质的 Ca(OH)2(含杂质 CaCO3)样品8.0g投入200.0g水中,充分搅拌,通入足量CO2,溶质质量与反应的 CO2质量的关系如图所示。[提示:CaCO3+H2O+CO2=Ca(HCO3)2,Ca(HCO3)2能溶于水]
(1)Ca(OH)2全部转化为CaCO3时消耗的CO2 质量为______g。
(2)8.0g样品中杂质CaCO3 的质量为多少?
(3)通入 m3g CO2时,溶液中溶质的质量为多少?
7、某化学小组的同学进行硫酸铜溶液和氢氧化钠溶液相混合的实验。实验过程及数据如图所示:
(1)判断a为 。
(2)计算氢氧化钠溶液中溶质的质量分数为多少?
8、我国第一艘国产航母的许多电子元件使用了黄铜(假设合金中仅含铜,锌),兴趣小组同学向盛有30g黄铜样品的烧杯中逐渐加入稀硫酸,生成氢的质量与加入稀硫酸的质量关系如图所示,计算:
(1)充分反应后生成氢气的质量为___________g。
(2)硫酸溶液中溶质的质量分数。
9、 “黄铜”是铜锌合金,具有较机械性能,比纯铜耐腐蚀。现将20g黄铜投入100g稀硫酸中,恰好完全反应,剩余的溶液和残余固体总质量为119.8g。
已知:Zn+H2 SO4=ZnSO4+ H2↑。
请计算:
(1)产生氢气的质量为________g。
(2)这种黄铜中锌的质量为多少?
(3)所用稀硫酸的溶质质量分数是多少?
四、实验探究(每小题5分,共计20分)
1、生活中钢铁腐蚀的基本原理是形成铁-碳原电池,这一原理在人类日常生活中有广泛的应用,比如,铁系脱氧剂和自热暖贴。以生活中糕点中的脱氧剂质量配方(铁粉:活性炭:氯化钠=1:0.15:0.2)为参照,保持铁粉质量固定为5g,在密闭的实验环境中,使用氧气传感器测定铁-碳原电池反应中氧气含量的变化,探究铁-碳原电池反应速率的影响因素。
实验1:探究不同种类的炭粉对反应速率的影响
实验编号 | 铁粉/g | 炭粉/g | 氯化钠/g |
1-1 | 5 | 0.75(活性炭粉) | 1 |
1-2 | 5 | 0.75(石墨粉) | 1 |
实验2:探究不同用量的活性炭粉对反应速率的影响
实验编号 | 铁粉/g | 活性炭粉/g | 氯化钠/g |
2-1 | 5 | 0 | 1 |
2-2 | 5 | 0.75 | 1 |
2-3 | 5 | 1.5 | a |
实验3:探究不同用量的氯化钠对反应速率的影响
实验编号 | 铁粉/g | 活性炭粉/g | 氯化钠/g |
3-1 | 5 | 0.75 | 0 |
3-2 | 5 | 0.75 | 1 |
3-3 | 5 | 0.75 | 2 |
(解释与结论)
(1)钢铁腐蚀是铁、水和________共同作用。
(2)实验1中使用活性炭粉比石墨粉吸氧效果更好,推测其原因是______。
(3)实验2-3中 a =_____ g。
(4)实验3的结论是_______。
(反思与评价)
(5)以下说法正确的是_______。(填序号)
A铁在氯化钠溶液中比在水中腐蚀速率更快
B在铁—碳原电池中,加入活性炭粉是加快反应速率的关键因素之一
C在铁—碳原电池中,活性炭粉和氯化钠的质量越多越好
D这个实验目的之一可以配制出效果更好的脱氧剂
(6)放置一段时间的脱氧剂,检验其是否完全失效的方法是________。
2、某小组同学用如图所示装置做氧化铜与稀盐酸反应的兴趣实验,发现有的同学得到蓝色溶液,有的同学得到绿色溶液。老师提示这种现象可能与所得氯化铜溶液有关。同学们对这个现象进行探究。
实验1:探究影响氯化铜溶液颜色的因素
取溶质质量分数不同的氯化铜溶液各20mL置于同样的烧杯中,分别置于不同温度的水浴箱中加热(忽略溶剂蒸发)。待溶液温度恒定后,观察溶液颜色,记录如表:
烧杯编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
溶质质量分数/% | 5 | 5 | 5 | 10 | 10 | 10 | 20 | 20 | 20 |
水浴箱温度/℃ | 30 | 50 | 70 | 30 | 50 | 70 | 30 | 50 | 70 |
溶液颜色 | 浅蓝 | 浅蓝 | 蓝 | 蓝 | 蓝绿 | 翠绿 | 蓝绿 | 翠绿 | 墨绿 |
实验2:探究室温下氯化铜溶液的变色浓度范围
a、室温下,称取15.4g的氯化铜固体溶于35.0g水中,配制成溶质质量分数30.6%的氯化铜溶液。
b、将上述氯化铜溶液依次加入等质量的水稀释,配制成不同溶质质量分数的氯化铜溶液,观察溶液颜色,记录如表:
溶质质量分数/% | 30.6 | 25.5 | 21.9 | 19.2 | 17.0 | 15.3 |
溶液颜色 | 深绿 | 翠绿 | 蓝绿 | 蓝绿 | 蓝 | 浅蓝 |
(结果与讨论)
(1)实验1中,④⑤⑥的实验目的是___________。
(2)根据实验1的结果可知,③⑥⑨中影响氯化铜溶液颜色的因素是___________。
(反思与评价)
(3)室温下,小文将20g氯化铜固体溶于80g水中,则此溶液的颜色为___________。
(4)小昕配制了一杯质量分数为12%的氯化铜溶液,溶液为浅蓝色,若要使此溶液由蓝向绿色转变,可进行的操作有___________(填字母序号)。
A.将溶液放在水浴箱中加热到70℃
B.加入适量的氯化铜固体并使之溶解
C.加入适量的水稀释
(拓展探究)如何将绿色的氯化铜溶液变为蓝色或变黄呢?
(查阅资料)
(1)氯化铜溶于水后在水溶液中电离出大量的Cu2+和Cl﹣。
(2)氯化铜溶液的颜色会随着溶液中的Cu2+与其他离子形成不同的络合离子而改变。其中:水合铜离子[Cu(H2O)4]2+为蓝色:四氯合铜络离子[CuCl4]2﹣为黄色。
(3)由光学知识可知:黄色光+蓝色光=绿色光,因此,氯化铜溶液变绿的原因实际上是溶液中的[Cu(H2O)4]2+和[CuCl4]2﹣混合形成的。
(设计实验)
目的 | 步骤 | 现象 |
1、将绿色的氯化铜溶液变为蓝色 | 取少量绿色的氯化铜溶液,加入水 | 溶液变蓝 |
2、将绿色的氯化铜溶液变为黄色 | 取少量绿色的氯化铜溶液,加入稀盐酸 | 溶液未变黄 |
(5)请分析,步骤2中加入稀盐酸溶液未变黄的原因___________。
(6)若将将绿色的氯化铜溶液变为黄色,可向其中加入___________。
3、某校化学兴趣小组在老师指导下,对过氧化氢溶液分解制取氧气进行再探究。
(初步探究)写出实验室用过氧化氢溶液制取氧气的化学方程式:_____。
(继续探究)小组同学通过查阅资料得知,溶液也可作为过氧化氢溶液分解的催化剂,氯化铜溶液中含有H2O、Cu2+、Cl﹣,到底哪种微粒对过氧化氢溶液的分解起催化作用呢?
(作出猜想)
猜想一:可能是H2O;
猜想二:可能是_____;
猜想三:可能是Cl﹣。
(分析交流)猜想一肯定是错误的,因为_____。
(实验探究)为了进一步验证猜想,小组同学设计了如表实验:
实验操作 | 实验现象 |
其他条件不变,向过氧化氢溶液中加入NaCl溶液 | 无明显变化 |
其他条件不变,向过氧化氢溶液中加入Na2SO4溶液 | 无明显变化 |
其他条件不变,向过氧化氢溶液中加入_____(填化学式)溶液 | 立即产生大量气泡 |
(结论反思)猜想_____成立。
(拓展应用)与课本中二氧化锰相比,从循环利用的角度分析,_____(填“二氧化锰”或“氯化铜溶液”)更适合作该反应的催化剂。
(深入探究)小组同学查阅了不同金属离子对过氧化氢分解影响的实验资料得知,100℃时,在不同金属离子存在下,纯过氧化氢24h的分解率如表所示。
实验编号 | 离子 | 加入量(mg/L) | 分解率% |
① | 无 | ﹣ | 2 |
② | Al3+ | 1.0 | 2 |
③ | Fe3+ | 1.0 | 15 |
④ | Cu2+ | 0.1 | 86 |
⑤ | Cr3+ | 0.1 | 96 |
(交流反思)实验①的目的是_____,通过以上探究可得出的结论:_____(写一点即可)。
(继续探究)在实验时,小组同学发现实验室氯化铜溶液的颜色有绿色、蓝色等,氯化铜溶液颜色与什么有关呢?
(1)小组同学提出氯化铜溶液的颜色可能与溶液的浓度有关。
(实验)步骤Ⅰ:用托盘天平称取无水氯化铜固体5.0g置于小烧杯中;步骤Ⅱ:往小烧杯中加入一定量的蒸馏水,搅拌,观察溶液的颜色并记录。
室温下的实验现象及数据记录如表:(水的密度为1g/mL)
加入水的体积/mL | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 |
溶液颜色 | 深绿 | 墨绿 | 墨绿 | 蓝绿 | 绿色 | 深蓝 | 蓝色 | 蓝色 | 浅蓝 | 淡蓝 |
a 上述实验可以得到的结论是氯化铜溶液颜色和其浓度有关。
b 仅从上述实验数据判断,为配制蓝色的氯化铜溶液,其溶液中溶质质量分数不超过_____(数据精确到0.1%)。
(2)老师提示氯化铜溶液颜色还与温度有关,请设计实验验证_____。
4、空气和水是人类无法离开的物质。
(1)空气中 ________ 含量升高会造成“温室效应”。
(2)如图1是测定空气中氧气含量的实验装置:
①红磷足量的原因是 ___________________________ ;
②燃烧产生的现象为发出白光,放出热量,产生大量的 ___________________ 。
(3)生活中可用活性炭净水,是利用活性炭的 ________ 性。生活中可用 ___________ 的方法降低水的硬度。
(4)t2 ℃时,将甲、乙各80 g分别放到盛有100 g水的两个烧杯中,充分溶解后,恢复到t2℃,现象如图2,甲和乙的溶解度曲线如图3。请结合图示回答下列问题:
①固体甲对应的溶解度曲线是 ______ (填“a”或“b”)。
②M点的含义 _______ 。
③向烧杯A的溶液中继续加入15 g甲物质,充分搅拌,发现固体先全部溶解,一段时间后又有部分固体析出,你认为“全部溶解”的原因是 ___________ 。
④将t2℃等质量的甲、乙饱和溶液分别降温到t1℃时,所得溶液的有关说法正确的是 ______ (填字母)。
a.甲溶液仍为饱和溶液 b.两溶液质量甲<乙
c.两溶液中溶剂质量甲=乙 d.两溶液溶质质量分数甲>乙
相关试卷
这是一份2022年度最新人教版九年级化学下册第九单元溶液期中试卷下载,共14页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
这是一份2022年度最新人教版九年级化学下册第九单元溶液期中复习试卷【下载】,共14页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
这是一份2021年度最新人教版九年级化学下册第九单元溶液期中试卷下载,共14页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。












