
2021学年最新人教版九年级化学下册第九单元溶液期中考试卷完整版
展开最新人教版九年级化学下册第九单元溶液期中考试卷完整版
(考试时间:90分钟,总分100分)
班级:__________ 姓名:__________ 分数:__________
一、单选题(每小题3分,共计24分)
1、下列饮料中,不属于溶液的是
A.啤酒 B.汽水 C.冰红茶 D.酸奶
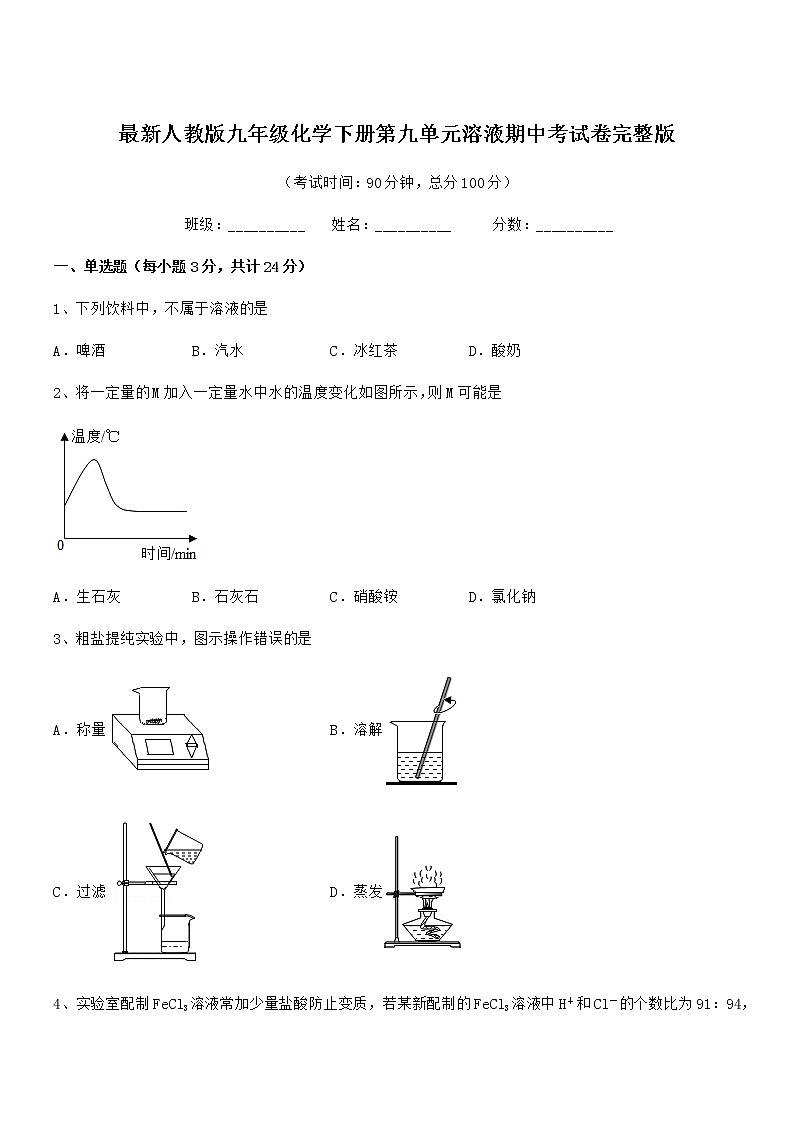
2、将一定量的M加入一定量水中水的温度变化如图所示,则M可能是
A.生石灰 B.石灰石 C.硝酸铵 D.氯化钠
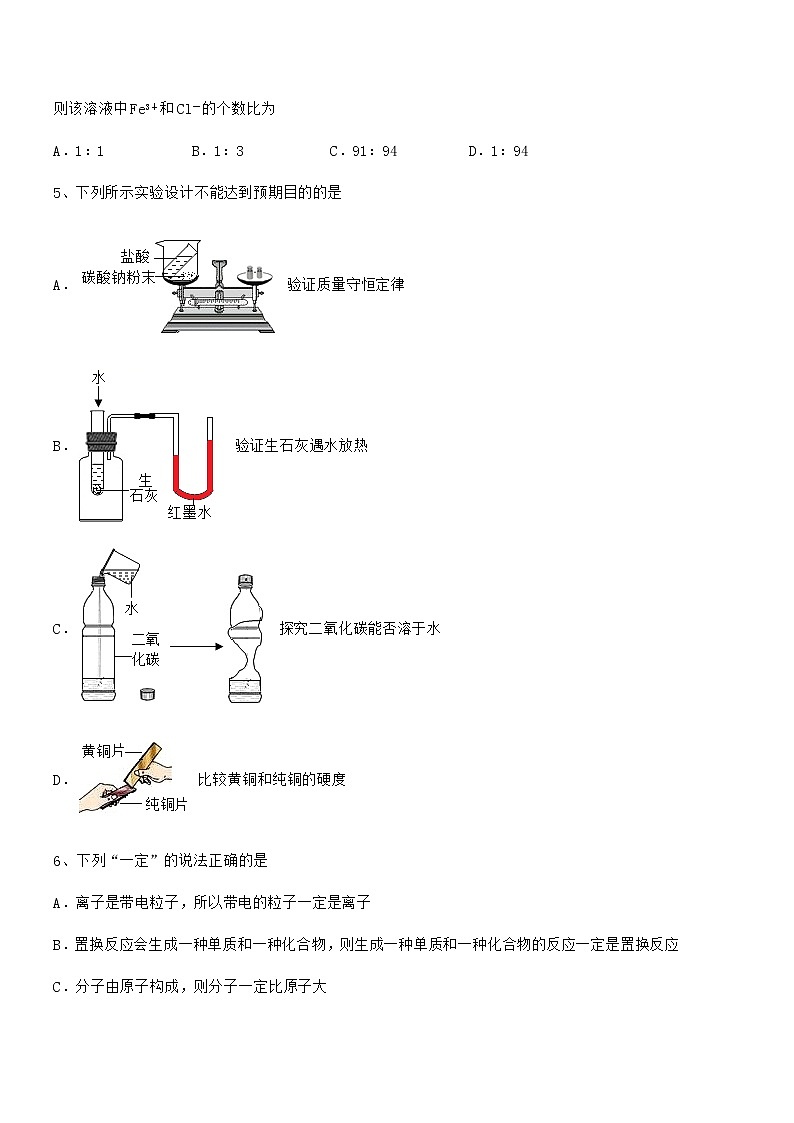
3、粗盐提纯实验中,图示操作错误的是
A.称量 B.溶解
C.过滤 D.蒸发
4、实验室配制FeCl3溶液常加少量盐酸防止变质,若某新配制的FeCl3溶液中H+和Cl-的个数比为91:94,则该溶液中Fe3+和Cl-的个数比为
A.1:1 B.1:3 C.91:94 D.1:94
5、下列所示实验设计不能达到预期目的的是
A. 验证质量守恒定律
B. 验证生石灰遇水放热
C. 探究二氧化碳能否溶于水
D. 比较黄铜和纯铜的硬度
6、下列“一定”的说法正确的是
A.离子是带电粒子,所以带电的粒子一定是离子
B.置换反应会生成一种单质和一种化合物,则生成一种单质和一种化合物的反应一定是置换反应
C.分子由原子构成,则分子一定比原子大
D.饱和的硝酸钾溶液降温结晶后,一定仍为硝酸钾的饱和溶液
7、下列有关氯化钠溶液的说法中,不正确的是
A.氯化钠溶于水时,溶液温度基本不变
B.氯化钠溶液中含有钠离子、氯离子、水分子
C.氯化钠溶液是均一、稳定的混合物
D.室温下,氯化钠饱和溶液不能再溶解任何物质
8、有一固体物质(不含结晶水)的溶液甲,在一定温度下,经历如下变化:
据此判断下列结论中正确的是
A.该温度下,固体物质的溶解度是30g
B.溶液乙和溶液丙的溶质质量分数可能相等
C.溶液乙一定是不饱和溶液
D.溶液丙再蒸发10g水,析出晶体的质量一定大于3g
二、填空题(每小题4分,共计20分)
1、下面是某同学配制100g质量分数为15%的氯化钠溶液的主要过程。
配制上述溶液的主要步骤有:计算、称量、量取、溶解。
(1)计算:氯化钠固体的质量是______g。
(2)本实验是定量实验,选择仪器不恰当或操作不规范都会导致实验结果有错误。实验时选择量筒规格应为______(填“50mL”或“100mL”)。在量取水时俯视量筒读数(其它操作均正确),所得溶液的质量分数______15%(填“大于”、“等于”或“小于”),实验过程中玻璃棒的作用是______。
(3)若用20%的NaCl溶液100g稀释成质量分数为10%的NaCl溶液,需加水______mL。
2、甲、乙两种固体物质的溶解度曲线如下图所示。
(1)t1℃时,甲、乙饱和溶液中溶质的质量分数:甲______乙(填“>”“<”或“=”)。
(2)t2℃时,将60g乙物质放入100g水中,所得溶液中,溶质与溶剂的质量比为______(填最简整数比)。
(3)现有t2℃时,甲、乙两种物质的饱和溶液各100,将这两种溶液分别降温到t1℃,所得溶液中溶质的质量分数甲______乙(填“>”、“<”或“=”)。
(4)小明同学进行了如下图所示的实验:
上述实验过程中所得的溶液,属于不饱和溶液的是______(填序号),溶液中溶质的质量分数相同的是______(填序号)。
(5)喝了汽水以后,常常会打嗝。这说明随温度升高气体的溶解度______。
3、 “20℃ NaCl的溶解度为36g”的含义:
(1)20℃时,100g水中最多可溶解NaCl___________。
(2)20℃时,36g NaCl完全溶解___________需要___________水。
(3)20℃时,36g NaCl和100g水恰好形成饱和溶液,其质量为___________。
(4)20℃时,136g饱和NaCl溶液中含有NaCl___________,水___________。
(5)36g NaCl和100g水形成饱和溶液时,温度为___________。
4、烧杯中盛有115g,温度为80℃,溶质为M,溶质质量为15g的溶液,将其置于室温环境,测定不同温度时析出固体M的质量。测定记录如表:
溶液的温度/℃ | 75 | 65 | 50 | 35 | 20 |
析出固体M的质量/g | 0 | 0 | 2.0 | 4.5 | 8.4 |
(1)若不考虑水蒸发对实验的影响,65℃时,该溶液是_____(“饱和溶液”或“不饱和溶液”或“无法判断”);
(2)50℃时该物质的溶解度是_____;
(3)该物质是_____
A.微溶物质 B.可溶物质 C.易溶物质 D.难溶物质
5、水与溶液在生产生活中有广泛的用途。
(1)如图为A、B两种物质的溶解度曲线如图所示,请根据图回答下列问题:
①甲的溶解度受温度的影响比乙的溶解度受温度影响______(填“大”或“小”);若甲中含有少量的乙,提纯甲应采用的结晶方法是______。
②t2℃时,将60g的甲、乙分别加入到100g水中,充分溶解,能形成的饱和溶液是______物质。
③将t1oC时甲、乙的饱和溶液升温到t2oC,所得溶液的溶质质量分数的关系是甲______(填“﹥”“﹤”“=”)乙。
(2)欲配制50 g溶质质量分数为0.9%的氯化钠溶液,需溶质质量分数为11%的氯化钠溶液的质量为______(列式即可)。
三、计算题(每小题4分,共计36分)
1、有50g10%的食盐溶液,要使其溶质质量分数变为20%,有以下三种方法,请你进行计算。(写出计算过程)
(1)可加入多少克食盐?
(2)可蒸发多少克水?
(3)将其与溶质质量分数为25%的食盐溶液混合,需要25%的食盐溶液多少克?
2、向80g15%的NaNO3溶液中加入28gNaNO3固体后,发现有8 gNaNO3未溶解,则形成的溶液中溶质的质量分数是多少?(写解题过程)
3、我国第一艘国产航母的许多电子元件使用了黄铜(假设合金中仅含铜,锌),兴趣小组同学向盛有30g黄铜样品的烧杯中逐渐加入稀硫酸,生成氢的质量与加入稀硫酸的质量关系如图所示,计算:
(1)充分反应后生成氢气的质量为___________g。
(2)硫酸溶液中溶质的质量分数。
4、.求为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.试计算:
(1)样品中锌的质量分数;
(2)反应所消耗的H2SO4溶液质量;
5、将一定质量的大理石投入50g稀盐酸中,恰好完全发应,放出气体的质量与反应时间的关系如图所示,请回答下列问题:
(1)完全反应后生成二氧化碳气体的质量为___________g;
(2)所用盐酸溶液中溶质的质量分数?(写出计算过程,结果精确到0.1%)
6、实验室常用过氧化氢溶液与二氧化锰混合制取氧气.现将2.5g二氧化锰放入盛有50g过氧化氢溶液的锥形瓶中,完全反应后,放出气体的质量与反应时间的关系如图所示.
试求
(1)完全反应后生成的氧气的质量为______g.
(2)求过氧化氢溶液中过氧化氢的质量分数。
7、化学课外活动小组为了测定黄铜中锌的含量(黄铜是铜锌合金),进行了如图所示实验。 请根据图示的实验过程和数据进行计算。
(1)样品中锌的质量分数为 ___________。
(2)生产氢气的质量。
(3)恰好完全反应后所得溶液中溶质的质量分数。(精确到 0.1%)
8、某化学兴趣小组为了测定当地的石灰石(主要成分是CaCO3)的质量分数,他们做了如下实验:取24克样品放入烧杯中,向其中逐渐加入100克一定质量分数的稀盐酸(杂质不溶于水也不与酸反应),所用盐酸的质量分数与剩余固体的质量关系如图所示,请根据图中的数据进行计算:
(1)石灰石样品中CaCO3的质量为_____克。。
(2)求所得溶液的溶质质量分数_____。(请根据化学方程式写出完整的计算步骤,结果保留一位小数)
9、 “黄铜”是铜锌合金,具有较机械性能,比纯铜耐腐蚀。现将20g黄铜投入100g稀硫酸中,恰好完全反应,剩余的溶液和残余固体总质量为119.8g。
已知:Zn+H2 SO4=ZnSO4+ H2↑。
请计算:
(1)产生氢气的质量为________g。
(2)这种黄铜中锌的质量为多少?
(3)所用稀硫酸的溶质质量分数是多少?
四、实验探究(每小题5分,共计20分)
1、某化学兴趣小组的同学准备探究影响化学反应速率的因素有哪些,同学们收集资料后发现:
(1)镁条在空气中可以剧烈燃烧,铁丝在氧气中能够剧烈燃烧,金在高温下也不能燃烧,说明影响反应速率的因素之一是______。分析可知,这三种金属活动性由弱到强的顺序是______。铁丝在空气中不能燃烧,在氧气中可以燃烧,说明影响反应速率的因素之二是______。
(2)同学们又利用压强传感器来探究影响铁和稀盐酸反应速率的因素,实验装置和测得的数据如图所示:
①锥形瓶内发生反应的化学方程式为______,基本反应类型为______。
②图中表示铁片与稀盐酸反应的曲线是______(填“a”或“b”),根据曲线得出的结论是______。
③实验测得的反应达到终点时,压强相等。若取少量锥形瓶中剩余溶液加入紫色石蕊溶液,均无明显现象,说明两锥形瓶内的______(填化学式)一定没有剩余。
附加问:
(3)同学们查阅资料发现工业上运输浓硫酸常用铁罐车,于是提岀疑问:铁能与浓硫酸反应吗?请参与实验设计完成相关探究。
实验步骤 | 实验现象 |
①将一打磨过的铁片放入硫酸铜溶液中 | ______ |
②另取一打磨过的铁片先放入浓硫酸中,一段时间后将铁片取出,用水冲洗干净后,放入硫酸铜溶液中,观察现象 | 在硫酸铜溶液中,铁片表面没有明显现象 |
(4)①常温下铁能与浓硫酸反应吗?______(填“能”或“不能”)
②运输浓硫酸的铁罐车能否用水冲洗?请回答并分析原因______。
2、探究“烧不坏的滤纸”实验。
(实验过程)将浸泡于适宜浓度的酒精溶液中的滤纸取出后点燃,发现酒精发生燃烧, 而滤纸不燃烧且完好无损。
(1)酒精(C2H6O)完全燃烧的化学方程式为____。
(2)从燃烧条件分析,滤纸未燃烧的原因是____。
(提出问题)该实验中,适合的酒精溶液溶质质量分数范围是多少?
(探究步骤)Ⅰ.按下表配制不同浓度的酒精溶液(已知:无水酒精的密度为 0.8 g/mL,水的密度为 1.0 g/mL)
实验编号 | 无水酒精体积/mL | 水体积/mL |
① | 10 | 5 |
② | 10 | 10 |
③ | 10 | 15 |
④ | 10 | 20 |
⑤ | 10 | 30 |
Ⅱ.用不同浓度的酒精溶液浸泡滤纸。
Ⅲ.用温度传感仪测定酒精燃烧时滤纸的温度数据,绘成图像如图。
(3)曲线①在接近 20 s 时,温度突然上升的主要原因是____。
(4)实验③大约在____s 时酒精燃尽,火焰熄灭。
(5)没有继续进行“无水酒精与水的体积比为 10:35” 实验的原因是____。
(实验结论)(6)根据图中信息分析:为确保实验成功,所用酒精溶液的溶质质量分数(ω)合理的范围是____(计算结果保留至小数点后 1 位)。
3、碳酸氢钠 (NaHCO3)是一种重要的化工原料。某化学兴趣小组同学对碳酸氢钠的性质进行探究。
(查阅资料)
①碳酸氢钠的溶解度如下:
温度 | 10℃ | 20℃ | 30℃ | 40℃ |
溶解度 | 8.1g | 9.6g | 11.1g | 12.7g |
②碳酸氢钠固体在潮湿的空气中久置或受热分解均生成 Na2CO3、H2O和CO2。
(实验探究)
探究1:NaHCO3溶液与盐酸反应的热效应
室温下(20℃),边搅拌边向盛有0.5 g NaHCO3固体的烧杯中加入10mL水,测得温度为18.5℃;恢复至室温后,向烧杯中加入过量10mL质量分数为20%的盐酸(20℃),搅拌,测得温度为20.8℃。
(1)实验中配制的 NaHCO3溶液___________(填“是”或“不是”)饱和溶液。
(2)由上述实验可知:NaHCO3固体溶于水___________(填“放热”或“吸热”)。有同学认为由上述实验得出 NaHCO3溶液与盐酸反应放热的结论并不可靠,理由是___________。
探究2:NaHCO3溶液与CaCl2溶液的反应。
分别向10mL0.5%和5% NaHCO3溶液中滴加10%的CaCl2溶液,发现均有白色浑浊出现,通过传感器测得CO2浓度与时间的关系如图所示。
(3)由上图得出的实验结论是___________。
(4)该条件下, NaHCO3溶液和CaC12溶液反应的化学方程式为:________ 。
探究3:久置的 NaHCO3样品中 NaHCO3含量的测定:
将一瓶在潮湿空气中久置的 NaHCO3样品(假设只有NaHCO3和Na2CO3)混合均匀后,称取19.0g混合物,加热至恒重,称其质量为15.9g。
(5)①计算样品中 NaHCO3的质量分数(结果精确至0.01%)________。
②若上述测定过程中未加热至恒重,则测得 NaHCO3的质量分数将___________(填“偏大”、“偏小”或“无影响”)。
4、网红产品“天气瓶”(如图1)的制作步骤如下:
I.将10g樟脑溶于40mL酒精,得溶液a(樟脑难溶于水);
Ⅱ.将2.5g硝酸钾和2.5g氯化铵溶于33g水中,得溶液b;
Ⅲ.将a、b两种溶液混合、加热、搅拌直至澄清;
Ⅳ.混合液冷却至室温后,密封在玻璃容器内,即制得“天气瓶”。
根据上述步骤并结合图2的溶解度曲线,回答下列问题。
(1)溶液a中溶剂为_______。
(2)溶液b中硝酸钾的质量分数为_______(列出计算式)。
(3)瓶内出现的晶体数量会随气温的降低而增加。该晶体的成分是_______,推断产生这种现象的原因是_______。
(4)图3是“天气瓶”的宣传图,根据其制作步骤,判断该宣传的真实性为____,理由是___。
2022学年最新人教版九年级化学下册第九单元溶液期中考试卷【完整版】: 这是一份2022学年最新人教版九年级化学下册第九单元溶液期中考试卷【完整版】,共12页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
2022学年最新人教版九年级化学下册第九单元溶液期末考试卷(完整版): 这是一份2022学年最新人教版九年级化学下册第九单元溶液期末考试卷(完整版),共13页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
2021年度最新人教版九年级化学下册第九单元溶液期末考试卷完整版: 这是一份2021年度最新人教版九年级化学下册第九单元溶液期末考试卷完整版,共14页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。












