




所属成套资源:山东省临沂市中考化学复习单元课件专题
山东省临沂市中考化学复习第十单元酸和碱课件
展开
这是一份山东省临沂市中考化学复习第十单元酸和碱课件,共60页。PPT课件主要包含了刺激性气味,有白雾出现,有挥发性,无挥发性,无吸水性,有吸水性,干燥剂,NH3,浓硫酸,3浓硫酸稀释等内容,欢迎下载使用。
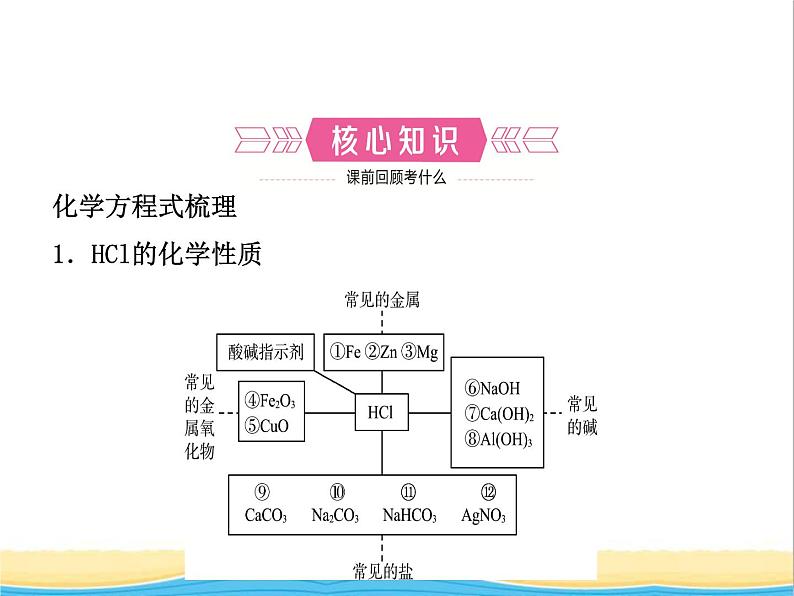
化学方程式梳理1.HCl的化学性质
① ______________________;② ______________________;③ ______________________;④ _________________________;⑤ ______________________;⑥ _____________________;
Fe+2HCl===FeCl2+H2↑
Zn+2HCl===ZnCl2+H2↑
Mg+2HCl===MgCl2+H2↑
Fe2O3+6HCl===2FeCl3+3H2O
CuO+2HCl===CuCl2+H2O
NaOH+HCl===NaCl+H2O
⑦ ___________________________;⑧ ___________________________;⑨ ______________________________;⑩ _______________________________;⑪ ______________________________;⑫ _________________________。
Ca(OH)2+2HCl===CaCl2+2H2O
Al(OH)3+3HCl===AlCl3+3H2O
2HCl+CaCO3===CaCl2+CO2↑+H2O
Na2CO3+2HCl===2NaCl+H2O+CO2↑
NaHCO3+HCl===NaCl+H2O+CO2↑
AgNO3+HCl===AgCl↓+HNO3
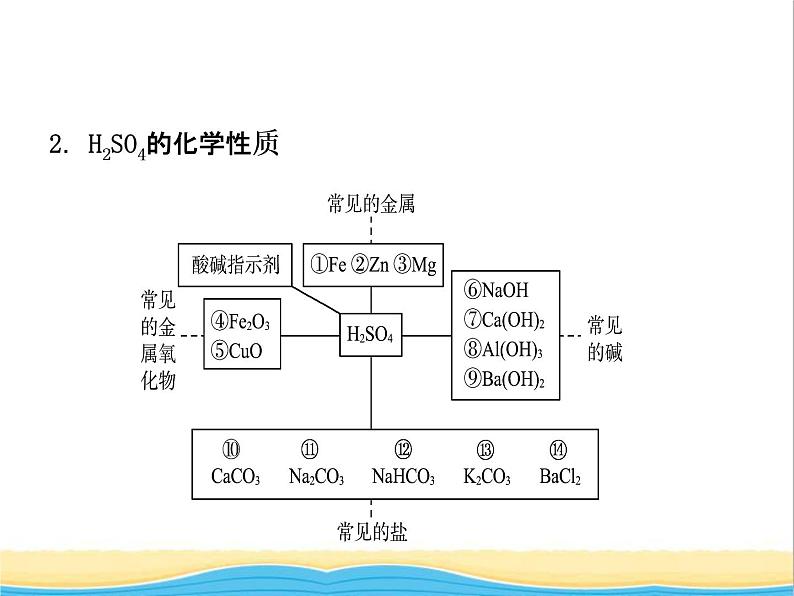
2.H2SO4的化学性质
① ______________________;② ______________________;③ ______________________;④ _____________________________;⑤ ______________________;⑥ __________________________;⑦ ___________________________;
Fe+H2SO4===FeSO4+H2↑
Zn+H2SO4===ZnSO4+H2↑
Mg+H2SO4===MgSO4+H2↑
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
CuO+H2SO4===CuSO4+H2O
2NaOH+H2SO4===Na2SO4+2H2O
Ca(OH)2+H2SO4===CaSO4+2H2O
⑧ _________________________________;⑨ _____________________________;⑩ _______________________________;⑪ ________________________________;⑫ ____________________________________;⑬ ______________________________;⑭ ___________________________。
2Al(OH)3+3H2SO4===Al2(SO4)3+6H2O
Ba(OH)2+H2SO4===BaSO4↓+2H2O
H2SO4+CaCO3===CaSO4+CO2↑+H2O
Na2CO3+H2SO4===Na2SO4+H2O+CO2↑
2NaHCO3+H2SO4===Na2SO4+2H2O+2CO2↑
K2CO3+H2SO4===K2SO4+H2O+CO2↑
BaCl2+H2SO4===BaSO4↓+2HCl
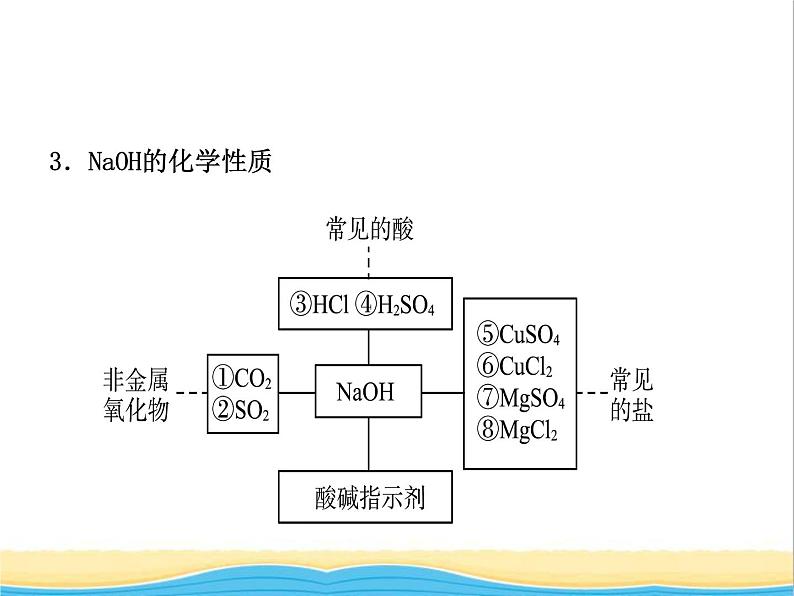
3.NaOH的化学性质
① _______________________;② _______________________;③ _____________________;④ __________________________;⑤ _______________________________;⑥ _______________________________;⑦ _______________________________;⑧ _______________________________。
CO2+2NaOH===Na2CO3+H2O
SO2+2NaOH===Na2SO3+H2O
2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
2NaOH+CuCl2===Cu(OH)2↓+2NaCl
2NaOH+MgSO4===Mg(OH)2↓+Na2SO4
2NaOH+MgCl2===Mg(OH)2↓+2NaCl
4.Ca(OH)2的化学性质
① __________________________;② __________________________;③ ___________________________;④ ___________________________;⑤ _______________________________;⑥ ________________________________;
CO2+Ca(OH)2===CaCO3↓+H2O
SO2+Ca(OH)2===CaSO3↓+H2O
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
Ca(OH)2+CuSO4===Cu(OH)2↓+CaSO4
⑦ ________________________________;⑧ ________________________________;⑨ ________________________________。
Ca(OH)2+CuCl2===Cu(OH)2↓+CaCl2
Ca(OH)2+MgSO4===Mg(OH)2↓+CaSO4
Ca(OH)2+MgCl2===Mg(OH)2↓+CaCl2
考点一 酸及其性质1.常见酸的物理性质及用途
2.浓硫酸的特性(1)吸水性浓硫酸具有很强的吸水性,因此可作 _______,常用来干燥O2、H2、CO2、CH4、CO等酸性气体,不能用来干燥碱性气体,如_____。使用多功能瓶干燥气体时应注意导管长进短出。浓硫酸吸水属于_______变化。
(2)腐蚀性浓硫酸有强烈的腐蚀性,能够夺取纸张、木材、布料、皮肤里的水分,生成黑色的碳,稀硫酸虽不能使纸张碳化,但水分挥发后变为 _______,也会使纸张碳化。这一碳化过程属于 _____变化。如果不慎将少量浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
BaCl2+H2SO4===BaSO4↓+
考点二 碱及其性质1.氢氧化钠和氢氧化钙的物理性质及用途
注:在使用氢氧化钠时,必须十分小心,防止眼睛、皮肤、衣物等被腐蚀。如果不慎沾在皮肤上,要 ____________________,然后再涂上 _______溶液。
CaCO3↓+2NaOH
3.氢氧化钠变质的探究(1)氢氧化钠变质的原因:氢氧化钠与空气中的二氧化碳反应生成碳酸钠。反应的化学方程式: _______________________。(2)检验NaOH是否变质的方法:方法一:加入过量的稀盐酸有气泡产生,证明氢氧化钠已经变质。反应原理: _______________________________。
2NaOH+CO2===Na2CO3+H2O
2HCl+Na2CO3===2NaCl+H2O+CO2↑
方法二:加入澄清石灰水有白色沉淀生成,证明氢氧化钠已经变质。反应原理: _______________________________。方法三:加入氯化钡或氯化钙溶液有白色沉淀生成,证明氢氧化钠已经变质。反应原理: _______________________________________________________________。
BaCl2+Na2CO3===BaCO3↓+2NaCl(或CaCl2
+Na2CO3===CaCO3↓+2NaCl)
(3)变质情况没有变质:只有NaOH;全部变质:只有Na2CO3;部分变质: ____________的混合物。
NaOH和Na2CO3
(4)探究氢氧化钠是部分变质还是全部变质的方案设计:原理:取样品加水溶解,逐滴滴入_________或氯化钙溶液至不再产生沉淀为止,滴入 _________后,若溶液变红则说明部分变质,若溶液不变色则说明全部变质。
分析:由于NaOH和生成的Na2CO3均能使酚酞溶液变红,所以不能直接加入指示剂进行鉴别。加入BaCl2或CaCl2反应的化学方程式为 _____________________________或 ______________________________,反应后的物质为NaCl和BaCO3沉淀或NaCl和CaCO3沉淀,溶液呈_____性,滴加 _________变红,则说明原溶液中含有_____性物质,利用该原理可以判断NaOH是否完全变质。
Na2CO3+BaCl2===2NaCl+BaCO3↓
CaCl2===2NaCl+CaCO3↓
明确探究氢氧化钠变质实验的注意事项讲:在中考中,关于探究NaOH的变质情况,易触雷的地方是用Ca(OH)2或Ba(OH)2除去Na2CO3,若加入Ca(OH)2或Ba(OH)2,会引入新的杂质OH-,导致不能判断原溶液中是否含有NaOH。练:链接“随堂演练”P71T12
(5)除去部分变质的氢氧化钠中的碳酸钠的方法。在溶液中滴入澄清石灰水至不再产生沉淀为止,然后过滤,就得到氢氧化钠溶液。
(6)联想与启示氢氧化钠变质是由于它与空气中的二氧化碳发生反应的缘故,因此氢氧化钠应_______保存。酸与碱发生中和反应,若有固体溶解或颜色改变或沉淀产生等明显现象,则不需要加指示剂指示反应的进行情况;若酸与碱反应无明显现象,则需要加指示剂指示反应的进行程度。
考点三 中和反应及其应用1._____与_____作用生成 _______的反应,叫中和反应;中和反应的实质是 ___与 ____结合生成水。
2.碱入酸与酸入碱的图像对比(在对应的图下填“酸入碱”或“碱入酸”) _______
开始时溶液呈_____性,pH____7,随着_____的加入,pH逐渐_______,当酸碱刚好完全反应时,pH=7,溶液呈中性;随着_____的继续加入,溶液的pH____7,溶液呈_____性。以稀盐酸和氢氧化钠反应为例分析反应过程中所得溶液的溶质:a点:NaCl、HCl;b点:NaCl;c点:NaCl、NaOH。
_______开始时溶液呈_____性,pH____7,随着_____的加入,pH逐渐_______,当酸碱刚好完全反应时,pH=7,溶液呈中性;随着_____的继续加入,溶液的pH____7,溶液呈_____性。
以稀盐酸和氢氧化钠反应为例分析反应过程中所得溶液的溶质:a点:NaCl、NaOH;b点:NaCl;c点:NaCl、HCl。
3.应用(1)应用于 _________。(2)改变土壤的 _______。(3)处理 _________。(4)调节溶液的 _______。
中和反应是否发生的判断讲:中考中,关于中和反应的考查主要体现在实验探究题中,在解答过程中触雷的地方主要是①在判断是否发生反应时选用的判断试剂错误,证明酸碱发生反应,一般用酚酞溶液,而不选用石蕊溶液;②判断是否恰好完全反应时,选用试剂错误,选用试剂应根据酸或碱的化学性质;
③分析反应后所得溶液中溶质的可能组成出现错误,分析反应后溶液中的溶质应从反应物是否有剩余和生成物两个角度分析。练:链接“聚焦临沂”P68T10
考点四 溶液的酸碱性与酸碱度1.酸碱指示剂(1)石蕊和酚酞是常用的两种指示剂,它们与酸、碱溶液作用时的颜色见表:
(2)石蕊试纸:为了方便实验,化学上分别用含有石蕊的酸溶液或碱溶液制成石蕊试纸。蓝色石蕊试纸遇酸性溶液变成 ___色,红色石蕊试纸遇碱性溶液变成_____色。
(1)使紫色石蕊溶液变红——该溶液显酸性,但不一定是酸溶液,如NH4NO3溶液。 (2)使紫色石蕊溶液变蓝——该溶液显碱性,但不一定是碱溶液,如Na2CO3溶液。 (3)酸碱指示剂遇到酸或碱后,是指示剂变色而不是酸或碱的溶液变色。
2.溶液酸碱度的表示方法——pH(1)一般情况下,溶液的pH范围是 ______。
(2)pH试纸的使用方法:在 _______或白瓷板上放一张pH试纸,用 ___________________蘸取待测液并滴到试纸上,再将pH试纸与标准比色卡对比即得溶液的pH。
酸碱度的表示与测量讲:在中考中,关于酸碱度的表示与测量,易触雷的地方有三处:①不能正确掌握测量的精确度;②不能正确掌握pH的测量操作;③忽略酸性和碱性溶液稀释后对溶液pH的影响不同。练:链接“聚焦临沂”P69T14
3.酸与碱对生命活动的意义(1)人的体液的pH>7,必须维持在 ___________,如果超出正常范围,就会导致生理功能失调或产生疾病,甚至死亡。(2)胃液中的胃酸主要成分是_______,能帮助消化食物,如果胃酸分泌过多,则会导致胃酸过多症。
(3)土壤的酸碱性强弱对植物的生长具有非常重要的意义。大多数的植物适宜在接近_______的土壤中生长,土壤的酸性太强(pH____4)或碱性太强(pH____8),作物都不能正常生长。
考点一 酸及其性质 (3年3考)1.常见酸的化学性质2.常见酸的物理性质和用途3.酸的通性
1.(2017·临沂中考)食醋中一般含有3%~5%的醋酸,醋酸又叫乙酸(CH3COOH),是无色有刺激性气味的液体,能溶于水。(1)食醋可以除去水壶内的水垢,水垢的主要成分之一是碳酸钙。除水垢时,可在水壶中加入水,倒入适量食醋,浸泡一段时间,碳酸钙会转变成可溶性的醋酸钙而被除掉,化学方程式为CaCO3+2CH3COOH===Ca(CH3COO)2+H2O+CO2↑。
(2)在熬制骨头汤时,常常在汤中加入少量食醋,因为骨头中含有不溶于水的磷酸钙,磷酸钙与醋酸反应生成可溶性的磷酸二氢钙,能够增加汤内的含钙量,促进人体对钙、磷的吸收和利用。(3)食醋不仅在厨房中大显身手,还是一种杀菌剂,冬天在屋子里熬食醋可以杀灭细菌,对预防感冒有很大作用。
(4)饮酒过量的人可以用食醋来解酒,因为乙酸能与乙醇发生反应生成乙酸乙酯(CH3COOC2H5)和水,从而达到解酒的目的。(5)醋酸能与活泼金属发生置换反应产生氢气,家用铝盆等金属制品不能用来盛放食醋,以免被腐蚀。
根据以上内容,回答下列问题:(a)乙酸属于 ___________ (填“有机化合物”或“无机化合物”)。(b)乙酸的物理性质 _______________________________(任答一条)。(c)食醋能用来解酒的原因是__________________________________________________________。
无色有刺激性气味液体,能溶于水
乙酸能跟乙醇发生反应生成
乙酸乙酯和水,从而达到解酒的目的
(d)用食醋除水垢,该反应属于基本反应类型中的_______反应。(e)用铁锅炒菜时,放一点食醋能更好补铁的原因是 _______________________________(用化学方程式表示)。
2CH3COOH+Fe===(CH3COO)2Fe+H2↑
【思路分析】 本题难度不大,掌握酸的化学性质、有机物的特征、物理性质、化学方程式的书写方法等是正确解答本题的关键。
2.(2015·临沂中考)下列物质之间不能发生化学反应的是( )A.石灰水与稀盐酸 B.铜与硝酸银溶液C.银与稀硫酸 D.二氧化碳与水
3.(2017·临沂中考)用玻璃棒蘸硫酸在白纸上写字,如图。(1)现象:放置一会儿发现用_____(填“浓”或“稀”)硫酸在白纸上写的字变黑。(2)结论:同种酸由于___________不同,它们的性质不完全相同。
4.(2013·临沂中考)构建知识网络能帮助我们理解知识间的内在联系,请分析以下知识网络图,回答有关问题。
(1)则①中填写_______,②中填写_____。(2)上图中“金属氧化物”若为氧化铁,请你写出稀盐酸与氧化铁反应的化学方程式 _________________________。
6HCl+Fe2O3===2FeCl3+3H2O
考点二 碱及其性质 (3年3考)1.常见碱的物理性质和用途2.常见碱的化学性质3.碱的通性
5.(2017·临沂模拟)某同学在复习Ca(OH)2化学性质时,归纳出了Ca(OH)2与其他物质间相互反应关系(图中“—”表示相连的两种物质能发生反应)。
(1)若X是与其他两种不同类别的化合物,则X可以是_____________________。(2)根据图示的物质间关系,写出其中两个化学方程式:① ___________________________;②___________________________。(3)氢氧化钾的化学性质与氢氧化钙相似,请写出氢氧化钾溶液吸收SO2的化学方程式:_____________________。
二氧化碳(合理即可)
CO2+Ca(OH)2===
SO2+2KOH===K2SO3+H2O
【思路分析】 根据碱的化学性质(能与酸碱指示剂、非金属氧化物、酸、盐等反应),据此进行分析解答。
6.为研究氢氧化钠、氢氧化钙两种溶液的化学性质,进行如下实验。
(1)A、D中酚酞均变_____色,说明两种溶液都呈碱性。(2)B中溶液的pH_____7(填“>”“<”或“=”)。写出氢氧化钠与盐酸反应的化学方程式_____________________。(3)F中沉淀的化学式是_______。(4)四支试管内的物质在G中混合后得到无色溶液,其中一定含有的溶质是 _______________________,可能含有的溶质是_______。
HCl+NaOH===NaCl+H2O
氯化钠、氯化钙、氯化钾
7.(2017·临沂兰山模拟)归纳总结是学习化学的重要方法,小明同学用图1总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应)。
(1)验证反应①,小明将无色酚酞溶液滴入NaOH溶液中,溶液变成_______。(2)小明用微观示意图(如图2)来说明反应③的发生,用化学方程式表示为 __________________________,从该图中可以看出,反应后的溶液pH_____7(填“>”“<”或“=”)。(3)如果反应④能够发生,你选择的物质是____。A.Na2CO3 B.HCl C.CuSO4 D.NaCl
考点三 中和反应及其应用 (3年3考)1.关于中和反应的探究性实验2.中和反应中的pH变化3.中和反应的应用
8.(2015·临沂中考)如图体现了稀盐酸和氢氧化钠溶液反应的实质,请回答有关问题。
(1)在上图C、D中的圆圈内填入适当的化学式或离子符号:C中 ____、 ____,D中 ___。(2)用化学方程式表示图中所体现的化学方程式 ______________________。(3)以上变化的反应类型是 ___________。
NaOH===NaCl+H2O
9.(2016·临沂中考)甲酸(HCOOH)俗名蚁酸,它和醋酸具有相似的化学性质,蚁虫叮咬时能在人的皮肤内分泌出蚁酸刺激皮肤产生痛痒,当被蚁虫叮咬时,在叮咬处涂抹下列物质中的____(填序号)会减轻痛痒。A.食盐水 B.食醋 C.草木灰水
10.(2017·临沂中考)某同学在向氢氧化钠溶液中滴加稀盐酸研究中和反应时,忘了滴加酸碱指示剂。为了确认滴加的盐酸是否已经过量,从烧杯中取少量反应后的溶液于试管中,用某种试剂进行检验。
(1)要想检验滴加的盐酸是否过量,下列试剂不能达到目的的是____ (填字母代号)A.酚酞溶液 B.石蕊溶液C.锌粒 D.碳酸钙(2)该同学用pH试纸测得反应后的溶液的pH=10,此时溶液中含有的溶质有 ___________,该中和反应的化学方程式为 _____________________。
考点四 溶液的酸碱性与酸碱度 (3年3考)1.溶液酸碱性与指示剂的关系2.溶液酸碱性与pH的关系3.酸碱性与人类健康和作物生长的关系4.pH的测定
11.(2017·临沂费县模拟)把生石灰、二氧化碳、食盐分别溶于水,往它们的溶液里分别滴入紫色石蕊溶液,则上述溶液呈现的颜色依次是( )A.紫色、蓝色、红色 B.红色、蓝色、蓝色C.红色、蓝色、紫色 D.蓝色、红色、紫色
12.(2015·临沂中考)测定人体内或排出的液体pH,可以帮助人们了解身体的健康状况。人体内的一些液体的近似pH如下:下列液体中,碱性最强的是( )A.胃液 B.胰液 C.胆汁 D.血浆
13.(2017·临沂模拟)生活中一些物质的近似pH如下。有关说法不正确的是( )A.草木灰水显碱性B.胃酸过多的人少吃橘子C.上述物质酸性最强的是炉具清洁剂D.醋酸能使紫色石蕊溶液变红
14.(2017·临沂模拟)某校同学开展了如图所示“溶液酸碱性的检验”的实验活动。
(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:由表可知,紫薯汁能做酸碱指示剂,若遇到稀硫酸溶液显示的颜色是_______。
(2)用pH试纸测定图1中溶液的酸碱性:草木灰水pH>7,属于_______(填“酸性”“中性”或“碱性”)溶液,白醋pH_____7。(3)图2是三位同学分别测定某溶液酸碱性的操作示意图,其中正确的是____(填“A”“B”或“C”,下同),可能导致被测溶液pH发生改变的错误操作是____。
相关课件
这是一份中考化学复习第十单元酸和碱第1课时常见的酸和碱教学课件,共40页。PPT课件主要包含了刺激性,HCl,干燥剂,CH3COOH,纸上显出黑色字迹,蘸有浓硫酸的部位变黑,腐蚀或脱水,盐+氢气,盐+水,NaCl+H2O等内容,欢迎下载使用。
这是一份中考化学复习第十单元酸和碱第2课时酸和碱的中和反应练习课件,共27页。PPT课件主要包含了OH-等内容,欢迎下载使用。
这是一份中考化学复习第十单元酸和碱第1课时常见的酸和碱教学课件,共40页。PPT课件主要包含了刺激性,HCl,干燥剂,CH3COOH,纸上显出黑色字迹,蘸有浓硫酸的部位变黑,腐蚀或脱水,盐+氢气,盐+水,NaCl+H2O等内容,欢迎下载使用。










