





苏教版选修4 化学反应原理第四单元 沉淀溶解平衡教课内容ppt课件
展开
这是一份苏教版选修4 化学反应原理第四单元 沉淀溶解平衡教课内容ppt课件,共19页。PPT课件主要包含了难溶≠不溶,PbI2s,难溶电解质的溶解平衡,沉淀溶解平衡,大展身手,对比电离方程式,必须用可逆符号,表达式,溶解能力,②Qc=Ksp时等内容,欢迎下载使用。
(1)少量难溶的PbI2固体加入有水的烧杯,用玻璃棒充分搅拌,静置
(2)取上层清液,向其中滴加几滴AgNO3溶液,震荡,观察实验现象。
观察●思考 :
说明:上层清液中存在I-.
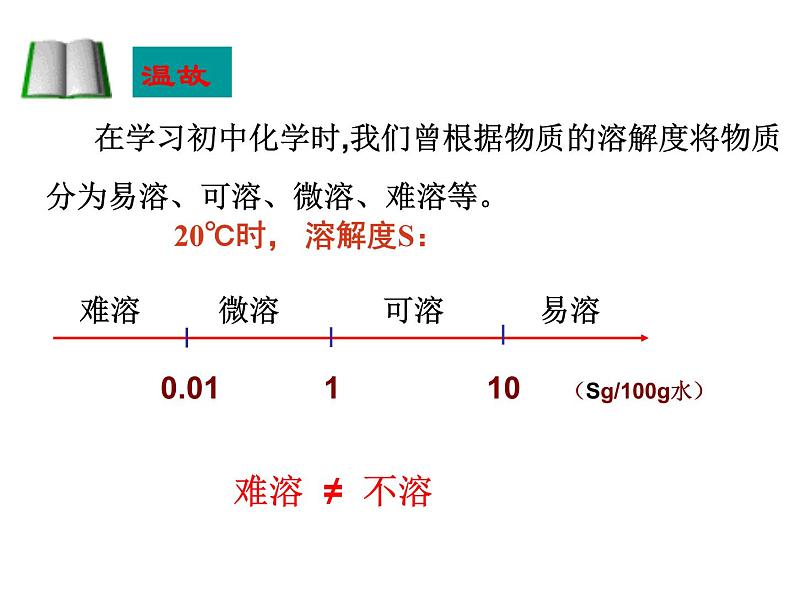
在学习初中化学时,我们曾根据物质的溶解度将物质分为易溶、可溶、微溶、难溶等。
Pb2+(aq)+2I-(aq)
尽管PbI2固体难溶于水,但仍有部分Pb2+和I-离开固体表面进入溶液,同时进入溶液的Pb2 +和I-又会在固体表面沉淀下来。
第一课时
一定温度下,沉淀溶解成离子的速率等于离子重新结合成沉淀的速率,即达到沉淀溶解平衡状态。
动:动态平衡,溶解和沉淀仍在进行
此时溶液中各离子的浓度保持不变,形成饱和溶液。
定:溶液中各离子浓度保持不变
变:当条件改变时,溶解平衡将发生移动
逆:溶解和沉淀互为可逆过程
下列有关AgCl的说法正确的是( ) A. AgCl难溶于水,溶液中没有Ag+和Cl— B. 在AgCl饱和溶液中,AgCl没有再溶解了 C. AgCl是一种难溶物,所以是弱电解质 D.在AgCl饱和溶液中,AgCl生成和溶解不 断进行,但速率相等。
3、沉淀溶解平衡表达式:
Ksp=c(Pb2+)c2 (I- )
Ksp =c(Ag+ )c (Cl- )
Ksp =c(Cu2+ ) c 2 (OH- )
二、沉淀溶解平衡常数——溶度积常数(Ksp)
注意:书写溶度积表达式时不考虑固体的浓度
3、Ksp的影响因素
内因:难溶电解质本身的性质( )。外因:只与 ( )有关。
常见难溶电解质的溶度积与溶解度( 25 °C)
4、意义 :Ksp大小反映难溶电解质的溶解能力,Ksp越小说明溶解能力越弱。
5、应用:判断沉淀溶解平衡的方向
离子积Qc和溶度积Ksp的关系:
③Qc > Ksp时,
过饱和溶液,析出沉淀。
饱和溶液
①Qc < Ksp时,
《美丽化学》:结晶过程__超清.mp4
例:将4×10-3mlL-1的AgNO3溶液与4×10-3mlL-1的NaCl溶液等体积混合能否有沉淀析出?Ksp(AgCl)= 1.8×10-10
C(Ag+)=2 ×10-3 mlL-1, c(Cl-)= 2 ×10-3 mlL-1 Qc=2 ×10-3× 2 ×10-3 =4.0 ×10-6 >1.8×10-10
Qc>Ksp,所以有AgCl沉淀析出。
分别往不饱和食盐水和饱和食盐水中加入浓盐酸。
现象:不饱和食盐水无明显现象; 饱和食盐水有沉淀析出。
说明:1、易溶电解质也可以存在沉淀溶解平衡; 2、沉淀溶解平衡的前提:饱和溶液。
二、影响沉淀溶解平衡的因素
温度升高,多数溶解平衡向溶解方向移动。
加入相同的离子,向生成沉淀的方向移动
讨论总结:对于平衡AgCl(S) Ag+(aq) + Cl-(aq) 若改变条件,对其有何影响
→ ↑ ↑
→ 不变 不变
不移动 不变 不变
← ↓ ↑
← ↑ ↓
完成课本P88交流与讨论
相关课件
这是一份苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡一等奖课件ppt,共32页。PPT课件主要包含了Cu2+,pH范围相差太小等内容,欢迎下载使用。
这是一份高中化学苏教版选修4 化学反应原理第四单元 沉淀溶解平衡课文ppt课件,共19页。PPT课件主要包含了故事一,沉淀的溶解平衡,试一试,故事二,想一想,动一动,pH1034,算一算,猜一猜,故事三等内容,欢迎下载使用。
这是一份2020-2021学年第四单元 沉淀溶解平衡示范课课件ppt,共21页。PPT课件主要包含了实验探究P90,白色沉淀→黄色沉淀,黄色沉淀→黑色沉淀,白色沉淀,黑色沉淀,无变化,溶度积规则,沉淀的生成,沉淀的溶解,分析沉淀转化的方向等内容,欢迎下载使用。










