




高中化学专题二 化学反应与化学平衡第一单元 化学反应速率课堂教学ppt课件
展开
这是一份高中化学专题二 化学反应与化学平衡第一单元 化学反应速率课堂教学ppt课件,共27页。PPT课件主要包含了化学平衡的移动,①若V正>V逆,平衡不移动,②若V正=V逆,③若V正<V逆,溶液由黄色向橙色转变,溶液由橙色向黄色转变,不移动,增大压强则a﹥1,增大压强a﹥1等内容,欢迎下载使用。
1、概念:改变外界条件,破坏原有的平衡状态,建立起新的平衡状态的过程。
2、移动的原因:外界条件发生变化。
3、移动的方向:由v正和v逆的相对大小决定。
平衡向正反应方向移动。
平衡向逆反应方向移动。
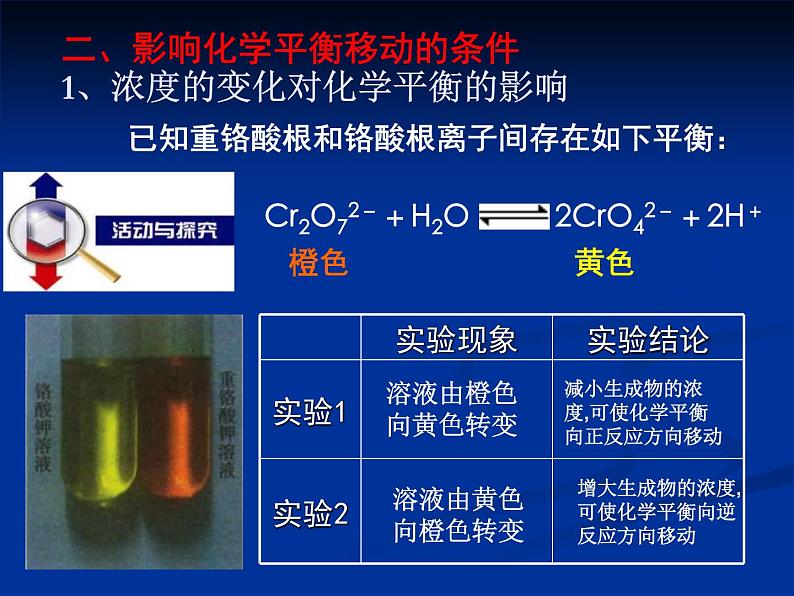
二、影响化学平衡移动的条件1、浓度的变化对化学平衡的影响
已知重铬酸根和铬酸根离子间存在如下平衡:
增大生成物的浓度,可使化学平衡向逆反应方向移动
减小生成物的浓度,可使化学平衡向正反应方向移动
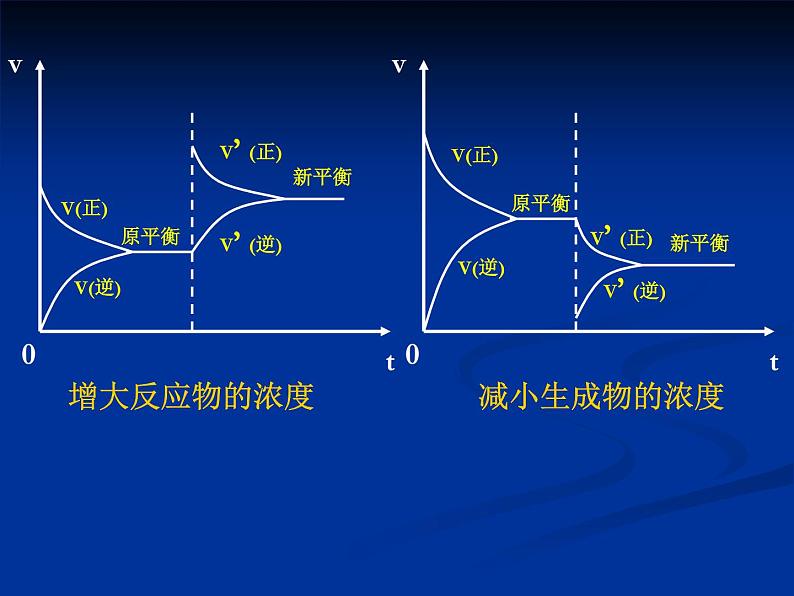
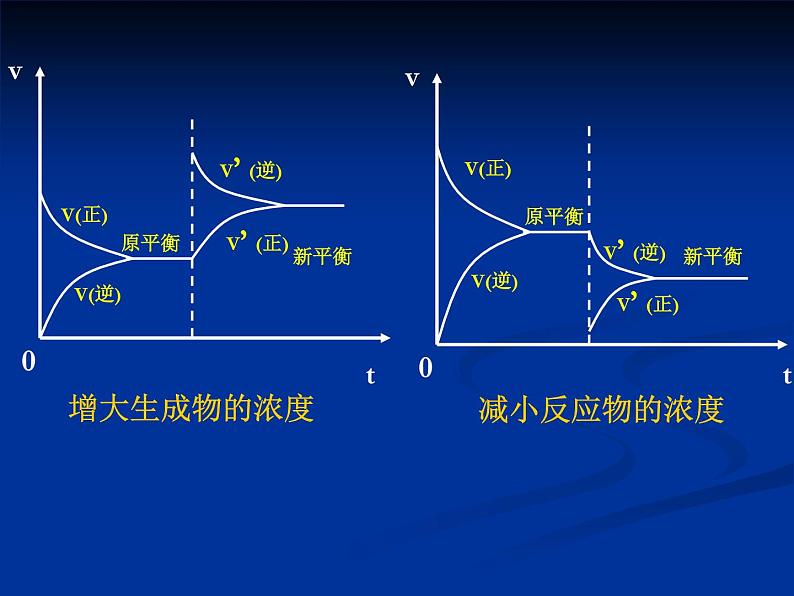
在其它条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆反应方向移动。
1、浓度变化对化学平衡的影响
浓度对化学平衡移动的几个注意点
①对于固态和纯液体,其浓度可看作 一个常数,增加或减小固态或纯液体的量并不 影响V正、V逆的大小,所以化学平衡不移动。
②只要是增大浓度,不论增大的是反应物浓度,还是生成物浓度,新平衡状态下的反应速率一定大于原 平衡状态;减小浓度,新平衡状态下的速率一定小 于原平衡状态。
③反应物有两种或两种以上, 增加一种物质的浓度, 该 物质的平衡浓度增大,转化率降低, 而其他物质的平衡浓度减小,转化率提高。
④在溶液中进行的反应,如果是稀释溶液,反应物浓度减小,生成物浓度减小, V(正) 、V(逆)都减小,但减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和大的方向移动。
练习2、在密闭容器中进行下列反应
达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化:
(1)增加C,平衡 c(CO) .
2、压强变化对化学平衡的影响
若 m+n﹥p+q ,则K’ ﹤ K ,平衡正向移动。
若 m+n﹤p+q ,则K’ ﹥ K ,平衡逆向移动。
若 m+n=p+q ,则K’ =K ,平衡不发生移动。
若 m+n﹥p+q ,则K’ ﹥ K ,平衡逆向移动。
若 m+n﹤p+q ,则K’ ﹤ K ,平衡正向移动。
2.充入”惰性气体” a 恒压 当成”减压” b 恒容 速率不变,平衡不移动
练习3、在密闭容器中进行下列反应
(2)减小密闭容器体积,保持温度不变,则平衡 ; c(CO2) 。
(3)通入N2,保持密闭容器体积和温度不变,则平衡 ; c(CO2) 。
(4)通入N2,保持密闭容器压强和温度不变,则平衡 ; c(CO2) 。
练习4:在一密闭容器中充入1 mlNO2,建立平衡:
测得NO2转化率为a%。在其它条件不变时,再充入1 mlNO2 ,待新平衡建立时,又测NO2的转化率为b%,问 a、b值的大小关系。
3、温度对化学平衡的影响
2NO2(气) N2O4(气) △H=-56.9kJ/ml
温度升高平衡向逆反应方向移动温度降低平衡向正反应方向移动
温度升高平衡向正反应方向移动温度降低平衡向逆反应方向移动
温度如何影响化学平衡呢?
温度升高,平衡向吸热方向移动;温度降低,平衡向放热方向移动。
3、温度变化对化学平衡的影响
(正反应为放热反应)的正确图像为:
4 、催化剂对化学平衡的影响
化学平衡移动原理(勒夏特列原理)
改变影响化学平衡的一个因素,平衡将向能减弱这种改变的方向移动。
定性角度:平衡移动的方向为减弱外界改变的方向。
定量角度:移动的结果只是减弱了外界条件的变化, 而不能完全抵消外界条件的变化量。
相关课件
这是一份苏教版 (2019)选择性必修1第三单元 化学平衡的移动图文ppt课件,共60页。PPT课件主要包含了图说考点,基础知识,物质组成,过程表示,溶液从橙色变为黄色,正反应,逆反应,向右移动,向左移动,不移动等内容,欢迎下载使用。
这是一份苏教版选修4 化学反应原理第三单元 化学平衡的移动课文ppt课件,共15页。PPT课件主要包含了化学平衡的移动,课时目标,化学平衡状态,化学平衡状态的判断,平衡移动,化学平衡移动,影响移动因素等内容,欢迎下载使用。
这是一份2021学年第一单元 化学反应速率图片课件ppt,共60页。PPT课件主要包含了第2讲,基础再现·深度思考,质量或浓度,反应物,生成物,保持不变,或浓度,化学平衡,浓度幂之积,规律方法·解题指导等内容,欢迎下载使用。











