





苏教版选修4 化学反应原理第一单元 化学反应速率课堂教学ppt课件
展开学习目标: (1)理解化学平衡图像的意义,掌握化学平衡图像题的解法。 (2)通过对各类图像的分析,提高对图像信息进行综合处理和加工的能力。 (3)通过化学平衡图像的分析,体会平衡—移动—平衡之间的因果关系,体会万物趋向平衡、果不抵因的哲学思想。
化学平衡图像题型分类:
一、浓度 - 时间图:二、速度-时间图:三、某物质的转化率(或百分含量)-时 间-温度(或压强)图:四、某物质的转化率(或百分含量)-温度(或压强)图:五、其他
1、看懂图像: ①看清纵坐标与横坐标的意义; ②看线(即弄清线的走向和变化趋势); ③看点(即弄清起点、拐点、交点、终点的意义); ④看是否要作辅助线(如等温线、等压线); ⑤看定量图像中有关量的多少。 2、联想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。3、作出判断:根据图像中表现的关系与所学规律相对比,作出符合题目要求的判断。(正反应是吸热还是放热,体积是增大还是减小等)
化学平衡图象问题的解题方法
勒夏特列原理,也叫化学平衡移动原理:如果改变影响平衡的一个条件(如浓度、温度、或压强等),平衡就向能够减弱这种改变的方向移动。1、浓度2、压强3、温度
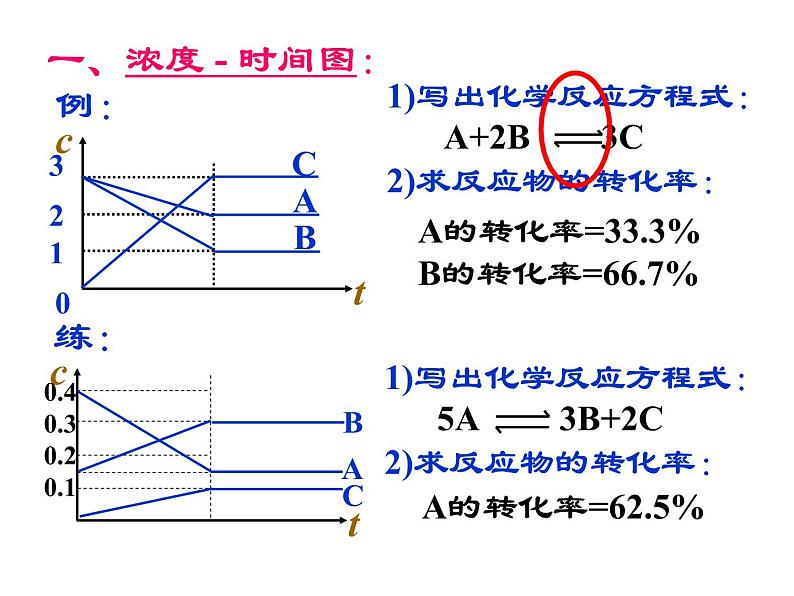
一、浓度 - 时间图:
1)写出化学反应方程式:2)求反应物的转化率:
A的转化率=33.3%B的转化率=66.7%
A的转化率=62.5%
1、何为反应物、生成物2、反应物、生成物计量数关系3、是否为可逆反应
总结:浓度-----时间图像的关键:
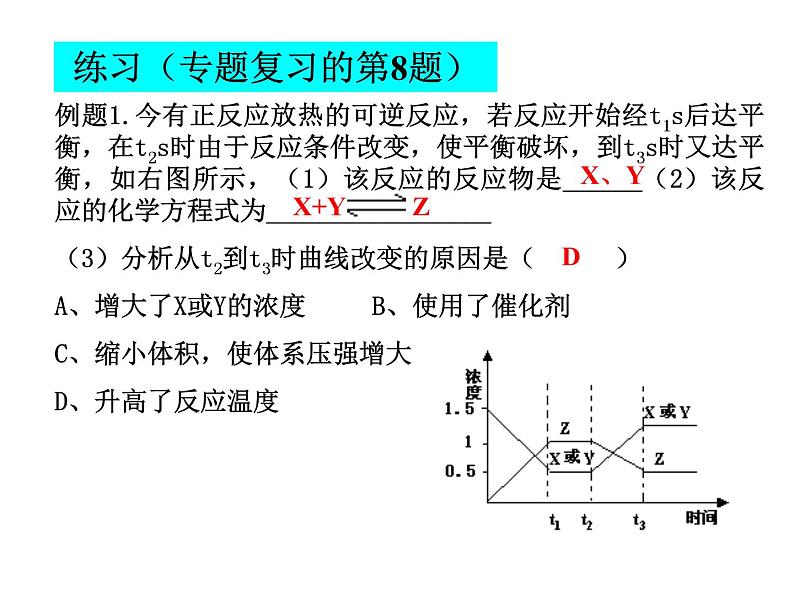
练习(专题复习的第8题)
例题1.今有正反应放热的可逆反应,若反应开始经t1s后达平衡,在t2s时由于反应条件改变,使平衡破坏,到t3s时又达平衡,如右图所示,(1)该反应的反应物是______(2)该反应的化学方程式为_________________ (3)分析从t2到t3时曲线改变的原因是( )A、增大了X或Y的浓度B、使用了催化剂C、缩小体积,使体系压强增大D、升高了反应温度
X+Y Z
可用于:1、已知引起平衡移动的因素,判断反应是吸热或放 热,反应前后气体体积的变化。2、(已知反应)判断引起平衡移动的因素。
•引起平衡移动的因素是 ,平衡 将向 方向移动。
•已知对某一平衡改变温度时有如下图变化,则温度的变化是 (升高或降低),平衡向 反应方向移动,正反应是 热反应。
•若对一正反应吸热的可逆反应平衡后降低温度,画出平衡移动过程中的 v - t 图。
•对于mA(g)+nB(g) pC(g)+qD(g),改变压强时有如下图变化,则压强变化是 (增大或减小),平衡向 反应方向移动,m+n p+q (>、<、=) 。
•若对以上反应已知m+n>p+q,平衡后降低压强时,画出相关的 v – t 图。
•对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。
•对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。
由于v正、v逆相同程 度的增大,t1时的改变因素可能是 a.加入(正)催化剂 b.当m+n=p+q时增大压强。平衡没有移动。
1、以mA(g)+nB(g) qC (g);为例: 若增大压强,或升高温度,重新达到平衡v正、v逆变化如图,则△H___0,m+n___q
三、某物质的转化率(或百分含量)-时间-温度(或压 强)图:
•对于反应mA(g)+nB(g) pC(g)+qD(g)
先看拐点:先拐先平衡,数值大再看平台:与勒夏特列原理挂钩
四、某物质的转化率(或百分含量)-温度(或压强)图:
•对于反应mA(g)+nB(g) pC(g)+qD(g)
•正反应放热m+n>p+q
•正反应放热m+n
•对于反应mA(g)+nB(g) pC(g)+qD(g)
•正反应吸热m+n=p+q
•对于2A(g)+B(g) C(g)+3D(g)(正反应吸热)有如下图所示的变化,图中Y轴可能表示: A、B物质的转化率 B、正反应的速率 C、平衡体系中的A% D、平衡体系中的C%
对于反应mA(g)+nB(g) pC(g)+qD(g)
2021学年第一单元 化学反应速率图片课件ppt: 这是一份2021学年第一单元 化学反应速率图片课件ppt,共60页。PPT课件主要包含了第2讲,基础再现·深度思考,质量或浓度,反应物,生成物,保持不变,或浓度,化学平衡,浓度幂之积,规律方法·解题指导等内容,欢迎下载使用。
苏教版选修4 化学反应原理专题二 化学反应与化学平衡第一单元 化学反应速率复习ppt课件: 这是一份苏教版选修4 化学反应原理专题二 化学反应与化学平衡第一单元 化学反应速率复习ppt课件,共5页。PPT课件主要包含了正方向进行等内容,欢迎下载使用。
苏教版选修4 化学反应原理第一单元 化学反应速率课文配套课件ppt: 这是一份苏教版选修4 化学反应原理第一单元 化学反应速率课文配套课件ppt,共22页。PPT课件主要包含了速率-时间图,增大反应物浓度,减小生成物浓度,•正反应吸热,•m+np+q,•正反应放热等内容,欢迎下载使用。













