





苏教版选修4 化学反应原理专题三 溶液中的离子反应第三单元 盐类的水解备课ppt课件
展开加碱:c(H+)
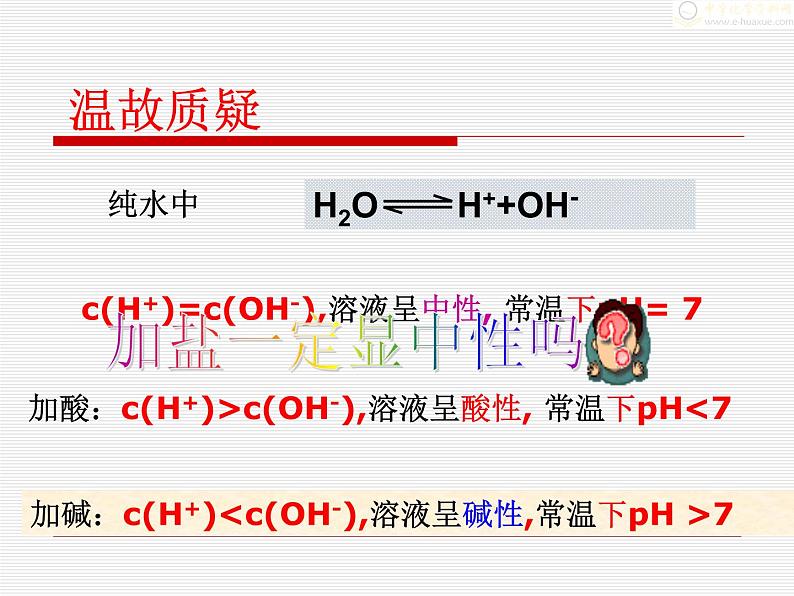
c(H+)=c(OH-),溶液呈中性, 常温下pH= 7
加酸:c(H+)>c(OH-),溶液呈酸性, 常温下pH<7
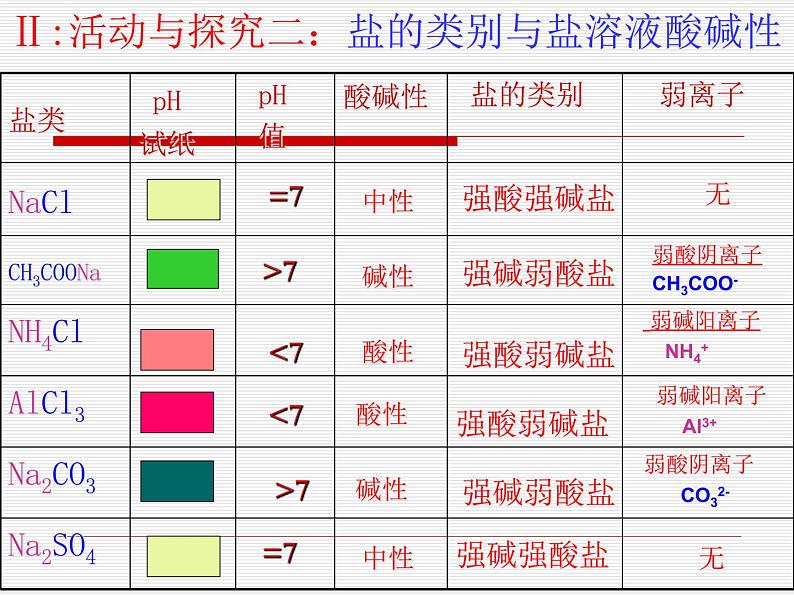
测定食盐(NaCl)、纯碱(Na2CO3)、除锈剂(NH4Cl)、醋酸钠(CH3COONa)、氯化铝溶液的pH,并将实验结果填入下表:
Ⅰ:活动与探究一:盐溶液的酸碱性
盐溶液不一定都是中性,还可能呈酸性,可能呈碱性
【温馨提示】 pH测定注意事项:1、玻璃棒要洁净、干燥。2、测溶液时pH试纸不能用蒸馏水湿润。3、pH读整数。4、pH试纸的使用:取一小块pH试纸放在表面皿上,用玻璃棒蘸取待测液,点在试纸的中部,变色后与标准比色卡对比读出溶液的pH。
1、盐溶液的酸碱性是随机出现的, 还是有规律可循呢?
2、有规律可循! 用什么方法总结现象背后的规律?
CH3COOH+NaOH=CH3COONa+H2O
NH3·H2O + HCl = NH4Cl + H2O
NaOH + HCl = NaCl + H2O
NH3·H2O+CH3COOH=CH3COONH4+H2O
盐的分类——生成盐对应的酸、碱的强弱
Ⅱ:活动与探究二:盐的类别与盐溶液酸碱性
弱碱阳离子 NH4+
弱碱阳离子 Al3+
弱酸阴离子 CO32-
弱酸阴离子CH3COO-
盐的组成与盐溶液酸碱性的关系:强碱弱酸盐的水溶液——显碱性强酸弱碱盐的水溶液——显酸性强酸强碱盐的水溶液——显中性
【谁强显谁性,都强显中性】
活动探究三: 盐类的水解溶液显酸碱性原因
以醋酸钠溶液水解为例,分析如下:
CH3COONa === CH3COO- + Na+
分析:CH3COONa电离产生的弱酸阴离子CH3COO-与水电离产生H+结合生成弱电解质CH3COOH,导致溶液中c(OH-)>c(H+)而使溶液呈碱性。
CH3COONa溶液呈碱性的原因?
请同学们试着仿照醋酸钠溶液,分析一下NH4Cl溶液呈酸性的原因?
【NH4Cl溶液为什么呈酸性?】
NH4Cl=== NH4+ + Cl-
解释:NH4Cl在水中电离产生的弱碱阳离子(NH4+)与水电离产生的OH-结合生成弱电解质一水合氨,导致溶液中c(H+)>c(OH-)而使溶液呈酸性。
弱酸阴离子或弱碱阳离子
盐类的水解促进了水的电离,生成了弱电解质。故,盐类水解的本质是破坏水的电离平衡,c(H+) ≠c(OH-),而使溶液呈现一定的酸性或碱性。
B: 盐类的水解一般比较小
C: 盐类的水解是吸热反应。升温促进水解。
A :盐类水解是酸碱中和反应的逆反应。
越弱越水解,都弱都水解,
有弱才水解,无弱不水解,
谁强显谁性,同强显中性.
(1) 单个离子的水解程度很小,书写用 号, 无明显沉淀和气体生成,一般不标“↓”或“↑”, 。(2)多元弱酸根的水解分步写,多元弱碱阳离子水解一步写出。
3、水解反应方程式的书写
多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。
多元弱酸的盐分步水解,以第一步为主,水解方程式一般只写第一步。
如:碳酸钠的水解反应方程式的书写。
有关盐类水解的说法不正确的是( ) A、盐类的水解过程破坏了纯水的电离平衡 B、盐类的水解是酸碱中和反应的逆反应 C、盐类水解的结果使盐溶液不一定呈中性 D、CH3COONa溶液中,c(Na+)与c(CH3COO -)相同
将含①F-②Cl-③Al3+④H+⑤S2-⑥OH-⑦NO3-⑧NH4+的盐分别加入到H2O中,能够促进水的电离的是:( ) A.①③⑤⑧ B. ③⑤⑧ C. ①⑥ D. ②④⑥⑧
等物质的量浓度、等体积的酸HA与碱NaOH混合后,溶液的酸碱性是:( )A.酸性 B.中性 C.碱性 D.不能确定
常温下,物质的量浓度相同的三种一元酸的钠盐NaX、NaY、NaZ溶液的pH值分别为7、8、9,则同物质的量浓度的这三种一元酸的酸性由强到弱的顺序是( )
A.HX、HY、HZ B.HZ、HY、HX C.HX、HZ、HY D.HY、HX、HZ
强碱阳离子、强酸酸根离子:溶液
a.必须溶于水;b.必须含弱酸阴离子或弱碱阳离子
盐类的水解(第一课时)
一、探究盐溶液的酸、碱性二、盐的组成与溶液酸碱性关系三、盐溶液呈现不同酸碱性的原因 1、强酸弱碱盐溶液呈酸性的原因: 2、强碱弱酸盐溶液呈碱性的原因: 3、思考与交流 4、盐类水解概念、实质、条件 5、盐类水解离子方程式书写
【作业】完成课后习题顶尖课课练:必做题1, 3,4,5,7 选做题2,6,8预习第2课时 影响盐类水解的因素
高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解完美版课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解完美版课件ppt,共60页。PPT课件主要包含了内容索引,课时对点练,应用体验,特别提示,④⑤③①②,cOH-,cH+,归纳总结,01mol·,=cOH-等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解优质课课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解优质课课件ppt,共60页。PPT课件主要包含了内容索引,课时对点练,盐溶液的酸碱性及原因,强酸强碱盐,强碱弱酸盐,强酸弱碱盐,CH3COO-,CH3COOH,NH3·H2O,H+或OH-等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第三单元 盐类的水解试讲课ppt课件: 这是一份苏教版 (2019)选择性必修1第三单元 盐类的水解试讲课ppt课件,共22页。PPT课件主要包含了Kh·Ka,深度思考,随着中和,②>①>④>③,5×10-8,③<②<①等内容,欢迎下载使用。













