

2021学年第一单元 化学反应中的热效应教课ppt课件
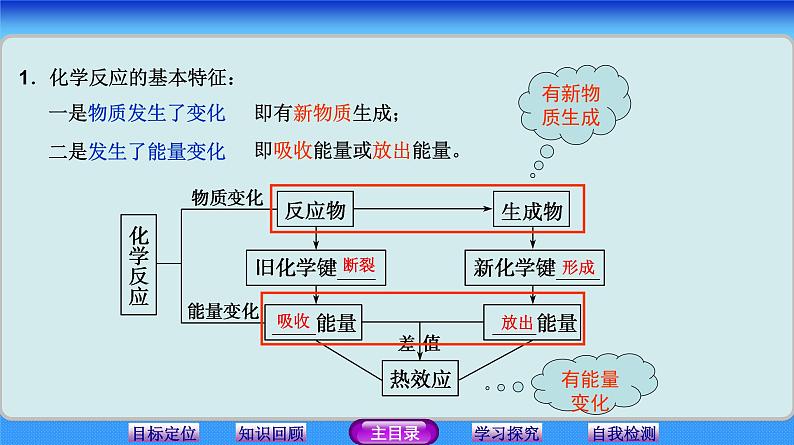
展开1.化学反应的基本特征:
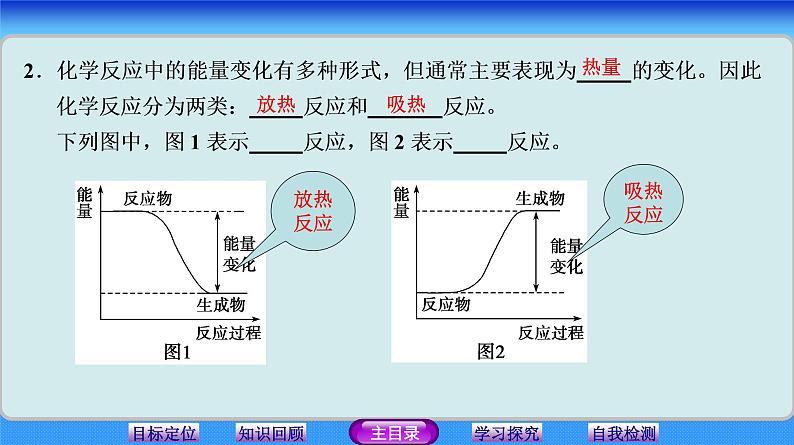
即吸收能量或放出能量。
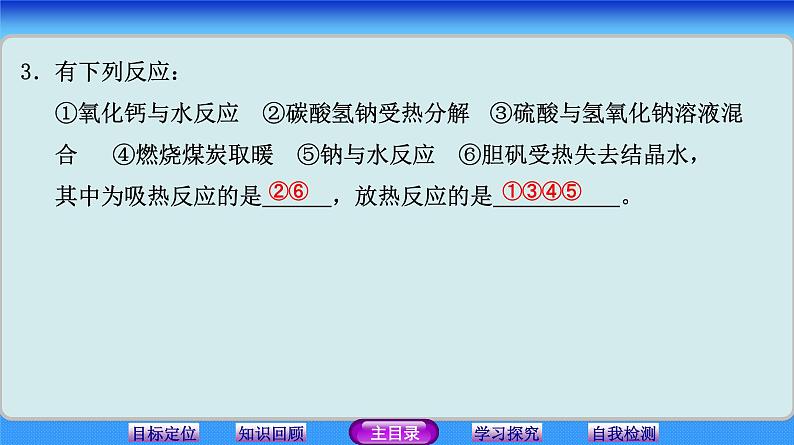
3.有下列反应: ①氧化钙与水反应 ②碳酸氢钠受热分解 ③硫酸与氢氧化钠溶液混 合 ④燃烧煤炭取暖 ⑤钠与水反应 ⑥胆矾受热失去结晶水, 其中为吸热反应的是 ,放热反应的是 。
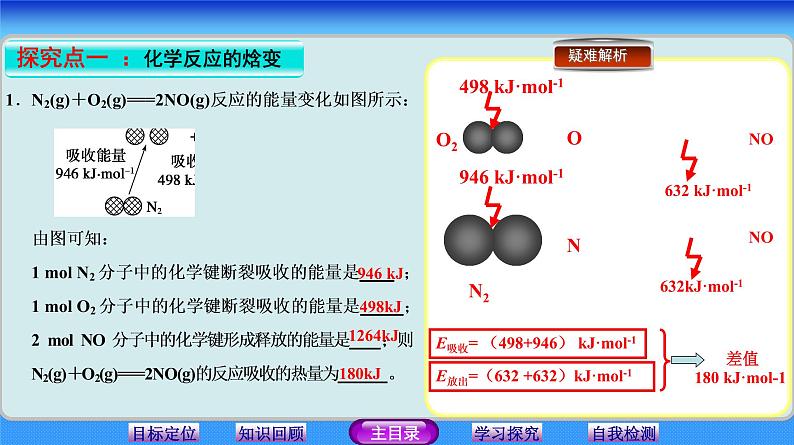
946 kJ·ml-1
498 kJ·ml-1
632 kJ·ml-1
E放出=(632 +632)kJ·ml-1
E吸收= (498+946) kJ·ml-1
差值180 kJ·ml-1
是在恒压条件下进行的化学反应的热效应 。
(即:化学反应中生成物所具有的焓与反应物所具有的焓之差。)
2. 反应热、焓变的概念
焓:物质所具有的能量称为物质的焓。
是化学反应在一定条件下所释放或吸收的热量。
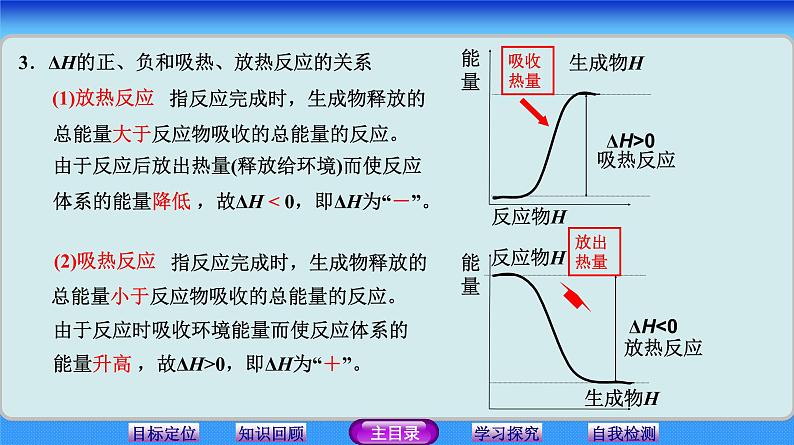
由于反应时吸收环境能量而使反应体系的能量升高 ,故ΔH>0,即ΔH为“+”。
3.ΔH的正、负和吸热、放热反应的关系
由于反应后放出热量(释放给环境)而使反应体系的能量降低 ,故ΔH < 0,即ΔH为“-”。
指反应完成时,生成物释放的
总能量大于反应物吸收的总能量的反应。
总能量小于反应物吸收的总能量的反应。
由图可知,B+C的能量高于A的能量,则反应B+C→A一定是放热反应;反之,A→B+C则是吸热反应。根据能量守恒定律,两反应的反应热在数值上相等,符号相反。
本题考查化学反应中的能量变化,
(3)在方程式的右边注明了ΔH的正负号、数值及单位。
(1)指明了反应时的温度和压强 ;
若在25 ℃、101 kPa时进行的反应,可以不注明。
(2)用括号注明了各物质反应时的状态;
s(固体)、l(液体)、g(气体)或aq(溶液)。
表示对于给定形式的化学反应,以各物质的化学计量数计量其物质的量时,发生反应所吸收或放出的热量。
2.热化学方程式的概念及意义
(2)热化学方程式的意义:
(1)热化学方程式是表示参加反应物质的量和反应热的关系的化学方程式。
不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化,还说明了物质的“量”与“能量”之间的数量关系。
(5)化学计量数改变,ΔH要相应改变;逆反应的ΔH数值与正反应的相等 、符号相反 。
3.热化学方程式的书写方法及要求
2H2 + O2 ==2H2O
ΔH=-571.6 kJ·ml-1
(1)遵循一般化学方程式的书写规则(一般不写反应条件)。
(2)在右端注明热量的变化:吸热反应,ΔH>0 ;放热反应,ΔH<0 。
(3)要注明反应物和生成物的聚集状态 。
(4)化学计量数只表示物质的量,因此可以是分数 ,也可以是整数 。
N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·ml-1
2 C(石墨,s)+2H2O(g)===2CO(g)+2H2(g) ΔH=262.6 kJ·ml-1
热化学方程式与普通化学方程式的区别
是整数,既表示微粒个数又表示该物质的物质的量
可以是整数也可以是分数,只表示物质的物质的量
必须注明(正号常省略)
表明了化学反应中的物质变化
不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化
H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·ml-1
检测学习效果·体验成功快乐
化学选修4 化学反应原理第一单元 化学反应中的热效应评课ppt课件: 这是一份化学选修4 化学反应原理第一单元 化学反应中的热效应评课ppt课件,共14页。PPT课件主要包含了展示提升,书写要点,ΔHΔH1+ΔH2,知识小结等内容,欢迎下载使用。
苏教版选修4 化学反应原理第一单元 化学反应中的热效应教案配套ppt课件: 这是一份苏教版选修4 化学反应原理第一单元 化学反应中的热效应教案配套ppt课件,共26页。PPT课件主要包含了复习回顾,反应热焓变,放热反应,吸热反应,化学键的断裂和形成,观察下列示意图,从键能角度看,交流与讨论,热化学方程式,物质变化等内容,欢迎下载使用。
高中苏教版第一单元 化学反应中的热效应课文课件ppt: 这是一份高中苏教版第一单元 化学反应中的热效应课文课件ppt,共19页。PPT课件主要包含了复习回顾,吸热反应,放热反应,kJmol,知识讲解,课堂运用,问题探究,减少热量损失等内容,欢迎下载使用。













