


高中苏教版第三单元 盐类的水解课文配套ppt课件
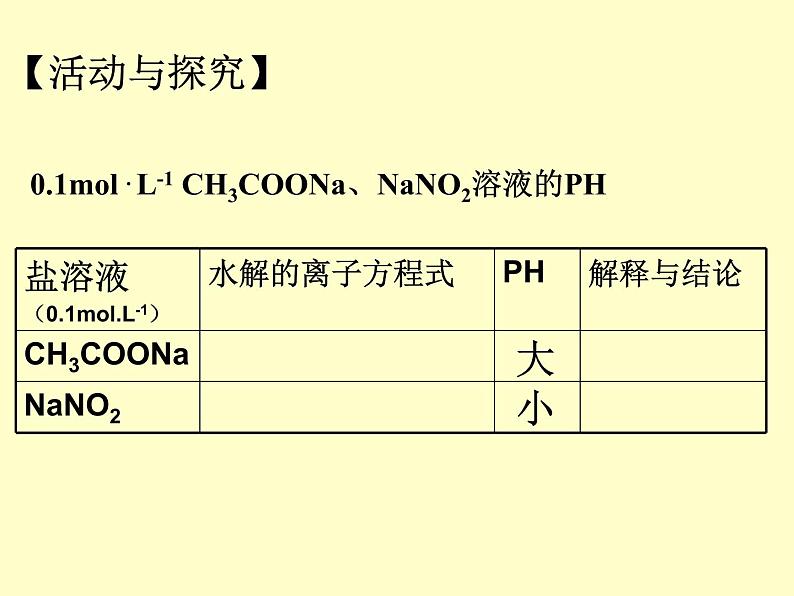
展开0.1ml . L-1 CH3COONa、NaNO2溶液的PH
为何上述两种种盐溶液的碱性不同? 根据课本提供的信息,弱酸强碱盐溶液的碱性强弱与相应弱酸有何关系?
CH3COOH < HNO2
CH3COONa > NaNO2
内因:盐本身的性质,组成盐的酸根相对应的酸越弱(或阳离子对应的碱越弱),水解程度越大,
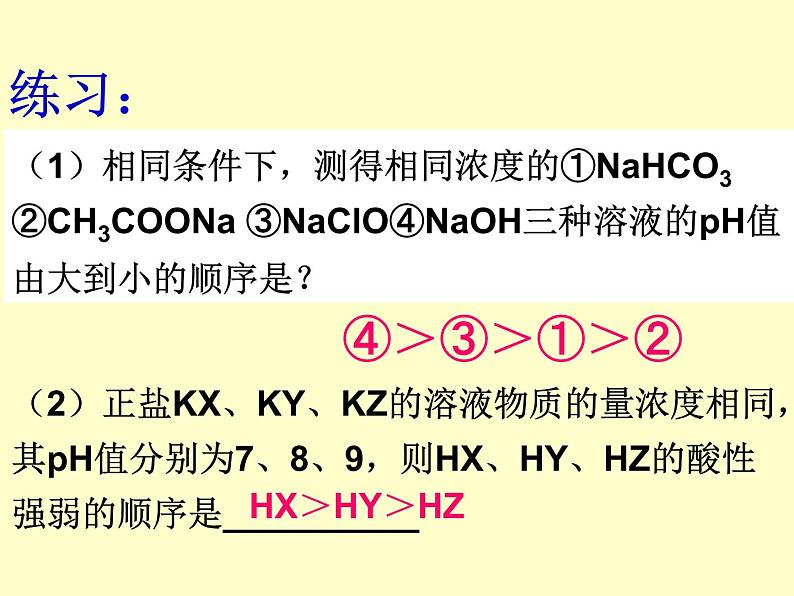
(2)正盐KX、KY、KZ的溶液物质的量浓度相同,其pH值分别为7、8、9,则HX、HY、HZ的酸性强弱的顺序是__________
(1)相同条件下,测得相同浓度的①NaHCO3 ②CH3COONa ③NaClO④NaOH三种溶液的pH值由大到小的顺序是?
铁盐(如FeCl3)是常见的净水剂,其净水原理是什么? 其水溶液的酸碱性如何?请写出FeCl3水解的化学方程式和离子方程式。
FeCl3 +3H2O Fe(OH)3+3HClFe3+ +3 H2O Fe(OH)3 + 3 H+
课本P83 “活动与探究”实验2
现象: 颜色变化:棕黄色变浅 测得某FeCl3溶液的pH为 ,现将该溶液稀释10倍后测得pH为 。根据以上信息,交流讨论并得出相应的结论。
加水稀释,盐溶液浓度减小,平衡正移,水解程度越大,
升温,平衡正向移动,促进水解
加酸,平衡逆向移动,抑制水解
盐的水解反应是吸热反应,升高温度,水解程度增大,
如何制备氢氧化铁胶体?
若将FeCl3溶液蒸干灼烧,所得物质是什么?如果改成Fe2(SO4) 3溶液
加酸抑制强酸弱碱盐的水解、促进弱酸强碱盐的水解; 加碱抑制弱酸强碱盐的水解、促进强酸弱碱盐的水解。
实验室中FeCl3溶液久置会变浑浊,为什么?该如何保存和配制FeCl3溶液?
加入一定量的 ,抑制FeCl3的水解。
配制:先将氯化铁溶于盐酸中, 再稀释至对应的浓度
人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡实验活动3 盐类水解的应用精品课件ppt: 这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡实验活动3 盐类水解的应用精品课件ppt,共35页。PPT课件主要包含了盐类的水解,知识回顾,HCHBHA,盐类水解的特点,CH3COOH,水解平衡常数,盐类水解的应用等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解精品课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第三单元 盐类的水解精品课件ppt,共60页。PPT课件主要包含了内容索引,盐类水解的应用,课时对点练,越水解,应用体验,正反应,逆反应,正误判断,增大减小,溶液变红等内容,欢迎下载使用。
高中苏教版 (2019)第三单元 盐类的水解课前预习ppt课件: 这是一份高中苏教版 (2019)第三单元 盐类的水解课前预习ppt课件,共60页。PPT课件主要包含了盐类水解的应用,课时对点练等内容,欢迎下载使用。













