
2022学年最新人教版九年级化学下册第十单元 酸和碱期末考试卷不含答案
展开
这是一份2022学年最新人教版九年级化学下册第十单元 酸和碱期末考试卷不含答案,共14页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
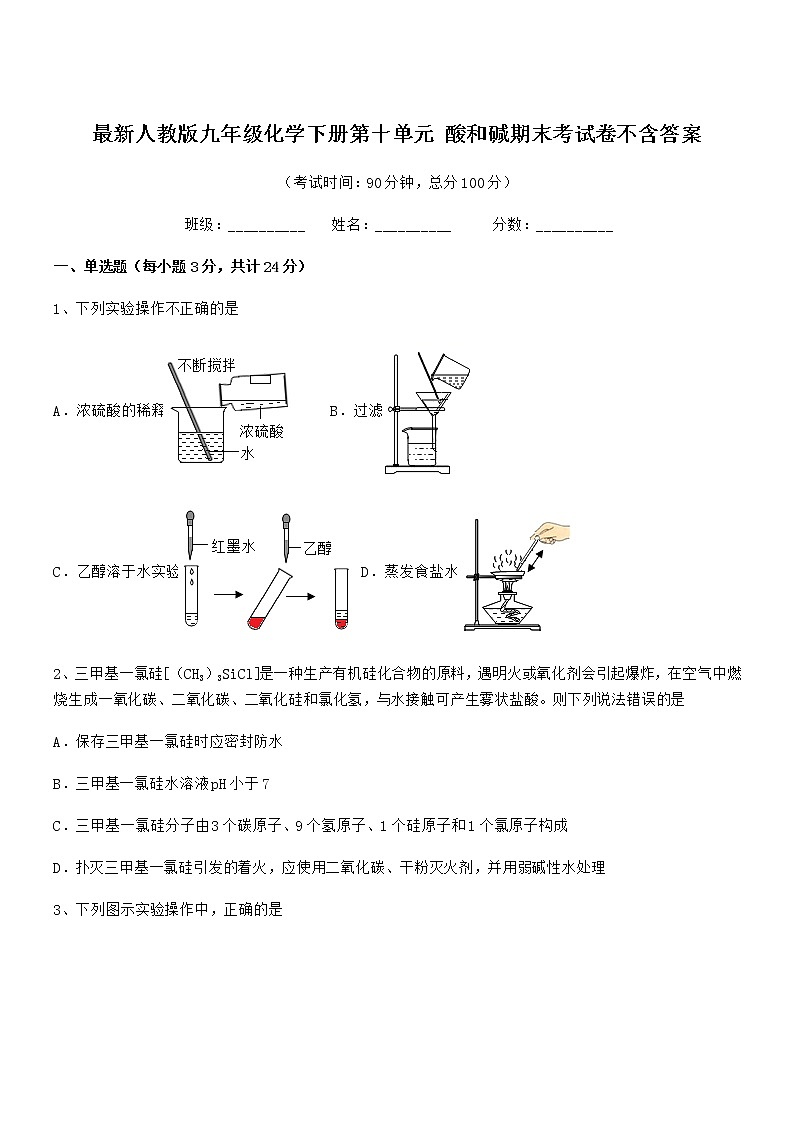
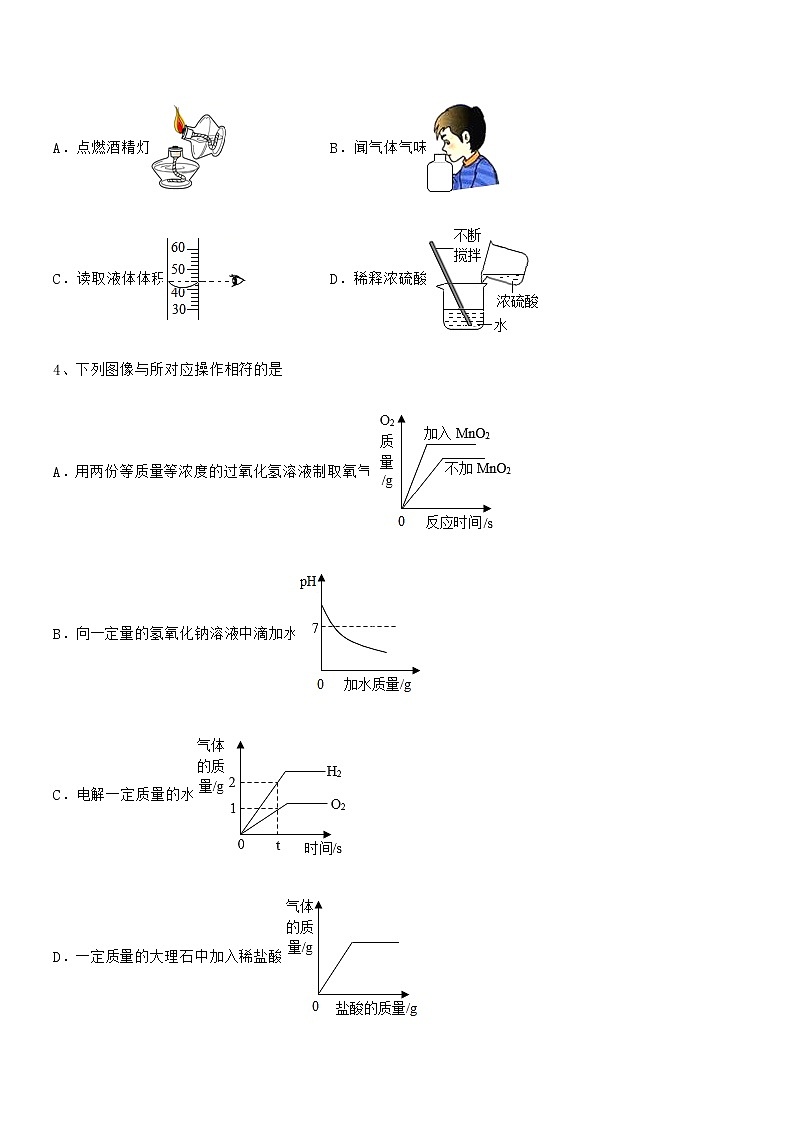
最新人教版九年级化学下册第十单元 酸和碱期末考试卷不含答案(考试时间:90分钟,总分100分)班级:__________ 姓名:__________ 分数:__________一、单选题(每小题3分,共计24分)1、下列实验操作不正确的是A.浓硫酸的稀释 B.过滤C.乙醇溶于水实验 D.蒸发食盐水2、三甲基一氯硅[(CH3)3SiCl]是一种生产有机硅化合物的原料,遇明火或氧化剂会引起爆炸,在空气中燃烧生成一氧化碳、二氧化碳、二氧化硅和氯化氢,与水接触可产生雾状盐酸。则下列说法错误的是A.保存三甲基一氯硅时应密封防水B.三甲基一氯硅水溶液pH小于7C.三甲基一氯硅分子由3个碳原子、9个氢原子、1个硅原子和1个氯原子构成D.扑灭三甲基一氯硅引发的着火,应使用二氧化碳、干粉灭火剂,并用弱碱性水处理3、下列图示实验操作中,正确的是A.点燃酒精灯 B.闻气体气味C.读取液体体积 D.稀释浓硫酸4、下列图像与所对应操作相符的是A.用两份等质量等浓度的过氧化氢溶液制取氧气B.向一定量的氢氧化钠溶液中滴加水C.电解一定质量的水D.一定质量的大理石中加入稀盐酸5、下列实验操作正确的是A.测溶液pH B.熄灭酒精灯C.过滤操作 D.取用液体药品6、物质性质决定用途。下列说法错误的是A.氧气能支持燃烧,用于火箭发射B.烧碱溶液呈碱性,用来治疗胃酸过多C.干冰升华能吸收大量的热,用于人工降雨D.红磷有可燃性,用来测定空气中氧气的含量7、正确规范的操作是实验成功和人身安全的重要保证。下列实验操作正确的是A.氢气验纯 B.二氧化碳验满C.浓硫酸稀释 D.滴进液体8、下列示意图能表示加水稀释pH=0的溶液的是A. B.C. D.二、填空题(每小题4分,共计20分)1、常见金属活动性顺序(1)将上述金属活动顺序表填补充完整___________,___________,___________,___________,___________,___________,___________.(2)在金属活动性顺序里:①___________。②___________(不可用浓硫酸、硝酸)。③___________(K、Ca、Na除外)。④___________。2、水是一种重要的资源,保护水资源从我们做起。(1)电解水的实验如图所示,收集到氧气的试管是__________(填“A”或“B”)。(2)水能与多种物质反应。氧化钙与水激烈反应,并放出大量的热,该反应的化学方程式为___________。(3)图2实验中,水用来隔绝空气的是 (填字母序号)。A.溶解物质 B.铁丝燃烧C. 水的电解 D.保存白磷3、现有18.6g由NaOH和Na2CO3组成的混合物,加入100g19.6%的稀H2SO4充分反应,所得溶液的PH=7,此时溶液的溶质是______(填化学式),则原固体混合物中钠元素的质量为____克。4、运用所学知识回答问题(1)如图是某输液瓶标签上的部分内容。葡萄糖由___________种元素组成,其中碳元素的质量分数为___________。(2)澄清石灰水敞口放置在空气中一段时间后出现白膜,说明空气中含有_______(用化学用语表示)5、金属在人类生产和生活中起着重要的作用。(1)青铜是铜锡合金,青铜属于______(填“合成材料”、“复合材料”、“金属材料”或“无机非金属材料”),它抗腐蚀性比纯铜的______(填“强”或“弱”)。(2)铁是目前世界上使用最多的金属。①从宏观看,铁由______组成(填“元素”、“分子”、“原子”或“离子”,下同);从微观看,铁由______构成。②工厂铁制零件容易锈蚀,工人师傅常用稀盐酸除铁锈,其反应方程式为______。③铝比铁更活泼,却比铁更不容易生锈的原因是______。三、计算题(每小题4分,共计36分)1、根据如图所示的信息计算:(1)加入的稀硫酸质量为______g(2)恰好完全反应后所得溶液的质量分数。2、往150克含有稀硝酸和硝酸钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图(假设生成的气体全部逸出),试分析计算:(1)c→d段溶液的pH大于7的原因是______。(2)反应到c点时,所得溶液的溶质质量分数是多少?(写出计算过程,精确到0.1%)3、维生素C又名抗坏血酸,易溶于水,易被氧化,遇热易被破坏,人体缺乏维生素C可能引发多种疾病,它的化学式是C6H8O6.计算:(1)维生素C中含有______种元素,(2)维生素C的相对分子质量为______;其中氢元素的质量分数为______(结果保留一位小数);(3)小婷遵医嘱,她一天补充到的维生素C为______mg;(4)取一片“维生素C”溶于水,滴入紫色石蕊试液变红色,说明“V-C”的溶液显______性.加热该溶液至沸腾,红色消失,所以在烹调新鲜蔬菜时要减少“V-C”的损失,应采取的措施可以是______.4、小慧称取20g某氯化铜样品放入烧杯中,加入 50g 水使氯化铜完全溶解,逐滴加入一定溶质质量分数的氢氧化钾溶液,反应生成沉淀的质量与所加氢氧化钾溶液质量的关系如图所示,(提示①,氯化铜样品中所含杂质既不溶于水,也不参与反应。)试计算:(1)样品中氯化铜的质量为______克?(2)当恰好完全反应时,所得溶液的溶质质量分数是_____?5、某盐酸试剂瓶标签上的有关数据如图所示。兴趣小组同学想测定该盐酸中HCl的质量分数是否与试剂瓶标签上的数据相符,进行了如下实验。取5 mL该盐酸加入锥形瓶中,加水稀释后,再逐滴滴加溶质质量分数为5%的NaOH溶液,恰好完全反应,共加入48 g NaOH溶液。(1)反应后所得溶液的pH______7(填“>”、“<”或“=”)。(2)该盐酸中HCl的质量分数与试剂瓶标签上的数据是否相符?6、欲测定一瓶标签破损的盐酸中溶质的质量分数,现将50g该盐酸样品与80g溶质的质量分数为10%的氢氧化钠溶液混合,恰好完全反应。(1)80g该氢氧化钠溶液中所含溶质的质量为_______。(2)计算该盐酸中溶质的质量分数_____。7、某同学用浓度为8%的氢氧化钠溶液测定某稀盐酸的溶质质量分数。下图为该氢氧化钠溶液与10g 稀盐酸反应时溶液温度的变化情况。请计算该种盐酸的溶质质量分数。 8、消化药片所含的物质能中和胃里过多的胃酸。某种消化药品的标签如图所示。医生给某胃酸过多的患者开出服用此药的处方为:每日6片。试计算,患者按此处方服用该药一天,理论上可中和HCl多少g?(计算结果精确至0.01)9、黄铜(铜和锌的合金)被广泛用于生活和生产中,铜的质量分数在59%-65%之间的黄铜性能优良。兴趣小组为了解某黄铜螺母的材料性能进行如下实验:取20g黄铜螺母粉碎后放入烧杯中,另取80g稀硫酸,分四次等质量加入,每次均充分反应,实验过程数据记录如表。实验次数1234稀硫酸的用量/g20202020剩余固体的质量/g17.414.812.212分析上述数据,请回答下列问题:(1)第4次实验结束后溶液的pH_____7(选填“>”“=”或“<”)。(2)通过计算,该黄铜螺母中铜的质量分数为________,材料性能属于________(填“优良”或“一般”)。(3)求出所用稀硫酸的溶质质量分数(写出计算过程)。四、实验探究(每小题5分,共计20分)1、鱼浮灵的主要成分是过碳酸钠(2Na2CO3﹒3H2O2),是水产养殖中常用的增氧剂,溶于水后生成 Na2CO3,和 H2O2,能迅速增加水体溶氧量。某课外小组用右图装置探究促进 H2O2分解的因素。 [查阅资料] Na2CO3溶于水解离出 Na+和,与水作用使溶液呈碱性 [猜想与假设]猜想 1: Na+促进 H2O2分解 猜想 2:溶液的碱性促进 H2O2分解 [实验探究一]进行下列3组实验(80mL 蒸馏水中加入6. 7g“鱼浮灵",可得4%的 H2O2溶液) 实验实验内容实验结果pH水中溶氧量(mg/L)1①取80mL蒸馏水6.965.68②加入6.7g“鱼浮灵”9.897.972①取80mL4%的H2O2溶液6.016.44②加入少量NaCl6.006.46③再加入少成Na2CO38.149.113取80mL4%的H2O2溶液中加入少量NaOH9.2610.97 [解释与结论] (1)根据实验1的实验结果,加入“鱼浮灵”后,液体的变化是_____________ 。(2)通过实验__________,证明猜想 1 不成立。(3)证明猜想2成立的依据是_____________。[实验探究二] 向5个烧杯中分别加入 80mL4%的 H2O2溶液,再分别滴加 NaOH 溶液,测得不同 pH 下的水中溶氧量情况如下表所示 烧杯12345pH8.008.599.2910.4311.47水中溶氧量(mg/L)6.889.3013.8217.5713.15(4)实验探究二得出的结论是__________。[反思与评价] (5)下列物质能加快 H2O2分解的是_________。 A.MnO2 B.NaCl C.NaOH D.Na2CO3 (6)实验探究一中,实验 2-①与实验 1-①对比,水中溶氧量增大的原因是__________。2、某混合气体由一氧化碳、甲烷、氢气中的一种或多种组成,北关中学初三化学兴趣小組为确定该气体组成,设计了如图实验。查阅资料获知:Ⅰ. Ⅱ.碱石灰可以吸收水和二氧化碳(1)请写出一氧化碳与氧化铜反应的方程式__________。(2)实验前后均向装置内通入过量氮气,实验前通氮气的目的是___________。(3)若实验过程中发现C中石灰水未变浑浊,则气体的成分为__________。(4)D装置内可能发生的化学方程式为_____。(5)A同学认为实验过程中,C、D、E三个装置质量变化总和即为产生的二氧化碳质量,你在仔细研究后发现没那么简单,可以在E、F之间添加一瓶_____溶液(填名称)使测量结果更精确。(6)经过改良后,待各装置质量不再发生变化后称重。假设通入的气体完全反应,且所有气体均被完全吸收,B装置增重10.8g,C、D、E以及新添装置总共增重8.8g,则该原始混合气体的组成可能为___(填数字)。①CO、H2②CO、CH4③H2、CH4④CO、H2、CH43、实验室中有一瓶长期使用的氢氧化钠固体样品,某兴趣小组的同学对该样品的成分及含量进行探究。(发现问题)该样品中含有哪些物质?(查阅资料)①NaOH在空气中不会转化成 NaHCO3②BaCl2溶液呈中性,Ba(OH)2是可溶性碱。③CO2在饱和的 NaHCO3溶液中几乎不溶解。(提出猜想)猜想Ⅰ:NaOH 猜想Ⅱ:Na2CO3猜想Ⅲ:NaOH和Na2CO3(设计实验)实验操作实验现象①:取少量样品于试管中,滴加足量水样品全部溶解,得到无色溶液②:取步骤①所得无色溶液于试管中,滴加足量X溶液观察到现象A(收集证据)(1)若现象A是有气泡产生,则X溶液为__________,则猜想________(填“Ⅰ”、“Ⅱ”或“Ⅲ”)不成立。(2)若X溶液为BaCl2溶液,现象A是_______________;再取反应后的上层清液,______________(填实验操作和现象),则证明猜想Ⅲ成立。(定量分析)确定部分变质样品中Na2CO3的质量分数。兴趣小组的同学用如图所示装置进行实验。步骤如下:①按图连接好装置,并检查气密性;②准确称取该样品1.0g,放入烧瓶内;③打开活塞,滴加30.0%的稀硫酸至过量,关闭活塞;④反应结束后,量筒内液体的读数为55.0mL。(已知:室温条件下,CO2的密度为1.6g·L-1)(1)B装置集气瓶内原有的空气对实验结果_________(填“有”或“没有”)影响。饱和 NaHCO3溶液如果用水代替,则所测CO2体积____________(填“偏大”、偏小”或“不变”)。(2)该样品中Na2CO3的质量分数_____________(保留一位小数)。(实验反思)实验中量筒的作用是____________。4、某学习小组对铜丝在空气中灼烧后的产物进行探究。实验1甲同学将螺旋状铜丝灼烧至红热,冷却后观察到铜丝表面变为黑色,再伸入质量分数为25%的稀硫酸中,黑色固体消失,溶液出现蓝色,将铜丝取出洗净;重复上述实验2~3次,溶液蓝色逐渐加深。(实验分析)灼烧铜丝生成黑色固体,该反应属于基本反应类型中的________反应。溶液变为蓝色的原因是___________(用化学方程式表示)。实验2乙同学将螺旋状铜丝灼烧至红热,迅速伸入质量分数为25%的稀硫酸中,观察到溶液中有红色固体产生,将铜丝取出洗净;重复上述实验2~3次,红色固体逐渐增多,沉淀后滤出红色固体,滤液呈浅蓝色。(提出问题1)红色固体是什么?(查阅资料1)①Cu与O2在高于900℃时会反应生成红色的Cu2O。②Cu2O能与H2SO4发生反应:。③加热条件下,Cu2O能与H2反应生成Cu和H2O。(提出猜想)丙同学认为红色固体全部是Cu,不含Cu2O。(实验验证1)学习小组取经过干燥的红色固体,采用如图装置验证猜想。(1)仪器X的名称为_________。(2)装置B中浓硫酸的作用是__________。(3)实验时,应先将产生的氢气通入装置C中,待_______________,再开始加热。(4)实验中观察到__________(填实验现象),说明红色固体中含有Cu2O,丙同学猜想错误。(提出问题2)实验2中有稀硫酸存在的情况下,为什么红色固体中仍含有Cu2O?(查阅资料2)Cu2O与H2SO4反应的快慢与稀硫酸的浓度有关。稀硫酸的浓度越大,Cu2O与H2SO4反应越快。(实验验证2)请设计实验验证“稀硫酸的浓度越大,Cu2O与H2SO4反应越快”这一结论。简述实验过程(包括操作和现象):____________。(实验中须使用的试剂:Cu2O、质量分数为5%和40%的稀硫酸)(问题解决)因实验2中稀硫酸浓度变小,Cu2O与H2SO4反应变慢,Cu2O没有完全反应,故红色固体中仍含有Cu2O。
相关试卷
这是一份2022学年最新人教版九年级化学下册第十单元 酸和碱期中考试卷【不含答案】,共14页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
这是一份2022学年最新人教版九年级化学下册第十单元 酸和碱期末复习试卷【不含答案】,共13页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
这是一份2022学年最新人教版九年级化学下册第十单元 酸和碱期末复习试卷不含答案,共12页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。








