2022年最新人教版九年级化学上册第五单元化学方程式期末模拟试卷(A4可打印)
展开
这是一份2022年最新人教版九年级化学上册第五单元化学方程式期末模拟试卷(A4可打印),共10页。试卷主要包含了单选题,填空题,计算题等内容,欢迎下载使用。
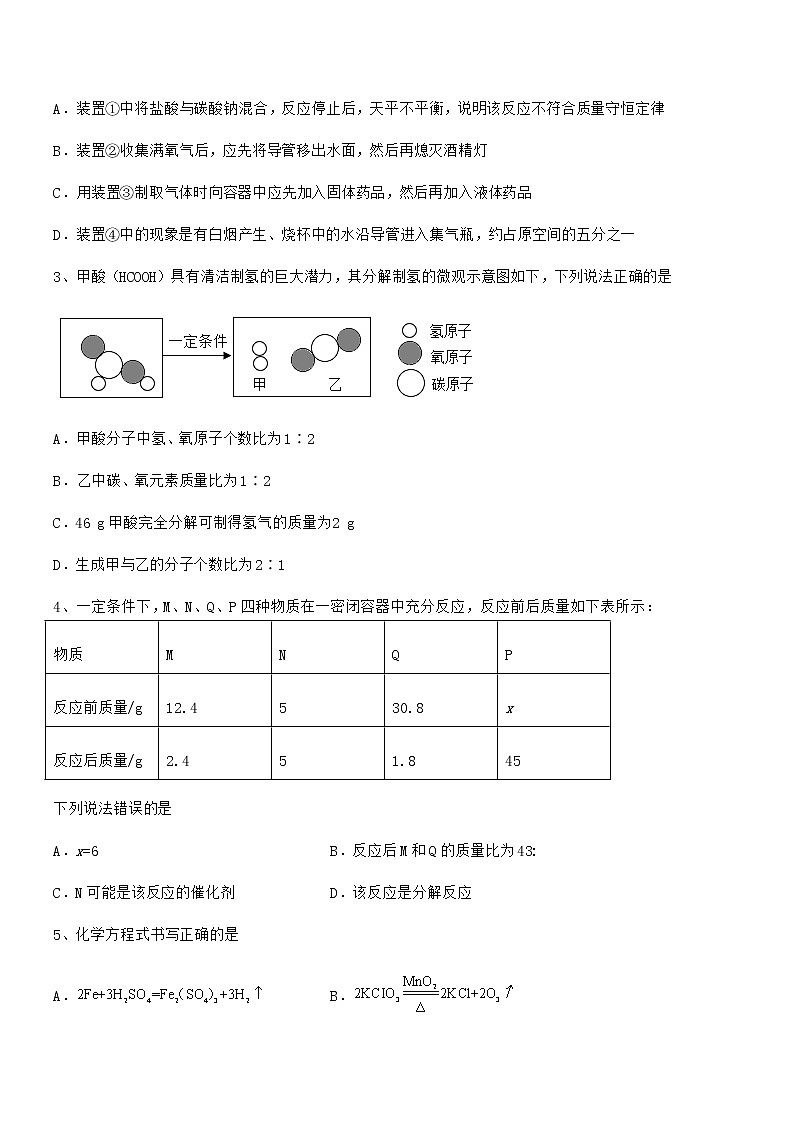
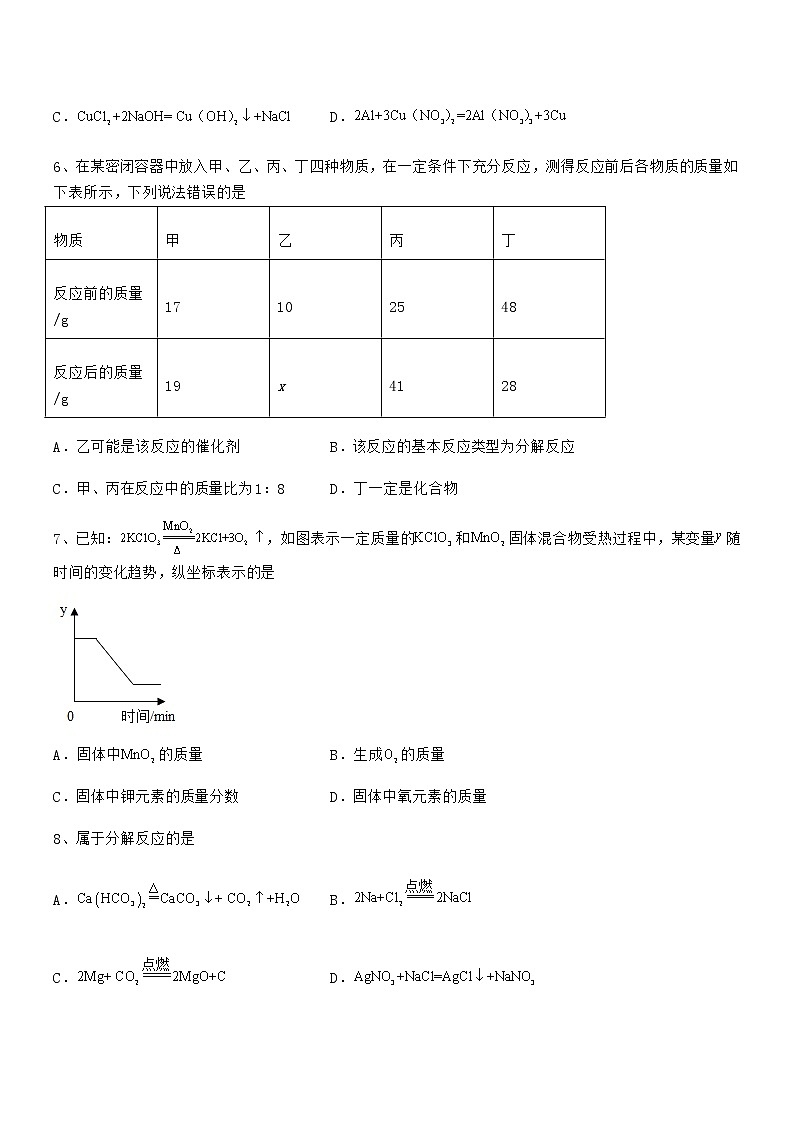
最新人教版九年级化学上册第五单元化学方程式期末模拟试卷(A4可打印)(考试时间:90分钟,总分100分)班级:__________ 姓名:__________ 分数:__________一、单选题(每小题3分,共计24分)1、科学研究发现,在一定条件下,甲、乙两种气体混合发生反应(微观示意图如下图)。该反应产物无污染可用于汽车尾气处理。下列说法正确的是A.甲、乙两种反应物的分子个数比为2:3B.甲物质的化学式是NH3,其中氮元素的化合价为+3价C.在反应前后,原子的种类没有改变,原子数目发生了变化D.四种物质中属于氧化物是乙和丁,乙、丁在反应中的质量比为15:182、下列有关化学实验的说法错误的是A.装置①中将盐酸与碳酸钠混合,反应停止后,天平不平衡,说明该反应不符合质量守恒定律B.装置②收集满氧气后,应先将导管移出水面,然后再熄灭酒精灯C.用装置③制取气体时向容器中应先加入固体药品,然后再加入液体药品D.装置④中的现象是有白烟产生、烧杯中的水沿导管进入集气瓶,约占原空间的五分之一3、甲酸(HCOOH)具有清洁制氢的巨大潜力,其分解制氢的微观示意图如下,下列说法正确的是A.甲酸分子中氢、氧原子个数比为1∶2B.乙中碳、氧元素质量比为1∶2C.46 g甲酸完全分解可制得氢气的质量为2 gD.生成甲与乙的分子个数比为2∶14、一定条件下,M、N、Q、P四种物质在一密闭容器中充分反应,反应前后质量如下表所示:物质MNQP反应前质量/g12.4530.8x反应后质量/g2.451.845下列说法错误的是A.x=6 B.反应后M和Q的质量比为4׃3C.N可能是该反应的催化剂 D.该反应是分解反应5、化学方程式书写正确的是A. B.C. D.6、在某密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,下列说法错误的是物质甲乙丙丁反应前的质量/g17102548反应后的质量/g19x4128A.乙可能是该反应的催化剂 B.该反应的基本反应类型为分解反应C.甲、丙在反应中的质量比为1:8 D.丁一定是化合物7、已知:,如图表示一定质量的和固体混合物受热过程中,某变量随时间的变化趋势,纵坐标表示的是A.固体中的质量 B.生成的质量C.固体中钾元素的质量分数 D.固体中氧元素的质量8、属于分解反应的是A. B.C. D.二、填空题(每小题4分,共计40分)1、用化学方程式回答下列问题。(1)实验室加热高锰酸钾制氧气;___________(2)实验室制取氢气;___________(3)铁丝在氧气中燃烧。___________2、在日常生活中有很多化学知识,请回答:(1)市场上有“加碘食盐”、“高钙牛奶”、“含氟牙膏”等商品,这里的“碘、钙、氟”指的是______;硬水中含较多的Ca2+、Mg2+,常用______区分硬水和软水;生活中为降低水的硬度并杀灭水中病原生物,可采用的方法是______。(2)自来水中的漂白粉是将氯气通入石灰水中制得的:,则X的化学式是______。3、 “宏观辨识与微观探析”是化学学科的核心素养之一、甲烷燃烧时发生化学反应的微观示意图如下所示。(1)写出该反应的化学方程式:___________。(2)将图B的微观粒子示意图补充完整___________。(3)甲烷中含有碳元素和氢元素,碳元素与氢元素的本质区别为___________。(4)甲烷的实验室制取原理为,其中X的化学式为___________。(5)天然气的主要成分为甲烷,液化天然气是天然气经压缩、冷却至1615℃后变成的液体。从微观角度解释此过程发生变化的是___________。4、一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:物质ABCD反应前质量/g022799反应后质量/g待测66027则反应后A的质量为______;该反应所属的基本反应类型是______;5、工业上有多种制取氧气的方法,如:方法一:在低温、加压条件下,将空气液化。然后将温度升高至-196°C~-183°C之间,使液态氮气先蒸发,剩余液态氧气储存于钢瓶里。方法二;利用电解水的方法制取氧气,将得到的氧气干燥。在低温,加压条件下,使之转化为液态,储存于钢瓶里。(1)从微观的角度分析,在方法一空气液化过程中,主要改变的是___。(2)分离液态空气的微观示意图如下,请把图C补充完整___。(3)图D为方法二的实验室装置,请在对应的位置画出产物的微观示意图___(原子模型参照图E)。反应结束后,打开活塞a用燃着的木条点燃a中的气体,出现的实验现象是:______,该现象的化学方程式是:___。(4)氢气和氧气在Pd基催化剂表面可反应生成H2O2,其微观示意图如图E:根据微观示意图写出对应的化学方程式___。6、今年 10 月 17 日,我国的两名航天员——景海鹏和陈冬搭乘神舟十一号飞船进驻天宫二号,完成为期 30 天的驻留。(1)本次运送航天员和神舟十一号飞船的长征二F型火箭使用的燃料是偏二甲肼(化学式为C2H8N2),火箭发射时只要将它和四氧化二氮液体这两种液体在发动机燃烧室混合即可自行燃烧,其反应的化学方程式为: ,则X的化学式为___________。(2)液氢也能用来做火箭的燃料,请写出 1 条液氢作为的燃料的优点:___________。7、水煤气变换是重要的化工过程,主要用于合成氨、制氢等工业领域,反应的化学方程式为。提供44.8L的一氧化碳(密度为1.25g/L),理论上可制出氢气的质量是_____?8、 “见著知微”是化学学习者应该具备的基本素养,也是学习化学的重要思想方法。资料一:资料二:氟及其化合物常运用于原子弹制造、航天工业等领域。氟气(F2)化学性质极其活泼,水都能在氟气中燃烧,且燃烧产物是氧气。结合以上信息,回答下列问题:(1)图1B中x=___________,在氟元素形成的化合物中,氟元素通常显___________价,氟化钠的化学式为___________。(2)图2是水与氟气反应的微观示意图。图2方框内应填图3中的___________选项,选择此选项的理由是___________。9、自来水消毒过程通常发生化学反应,其反应的微观过程可用下图表示。(1)请写出D物质中氯元素的化合价_________。(2)请写出该反应的化学方程式_________。10、2020年12月初,“嫦娥五号”探测器成功着陆在月球,并顺利完成“挖土”,标志着中国航天又取得重大突破。(1)发射“嫦娥五号”探测器的是“长征五号”遥五运载火箭,采用液氢和液氧推进剂,液氢、液氧在点燃条件下发生反应的化学方程式为______。(2)为避免月球样品被污染,采集回地球的月球样品必须存放在充满氮气的密封箱内,充满氮气的目的是:______。三、计算题(每小题4分,共计36分)1、鸡蛋壳能制酸、止痛,研末外用可用于外伤止血、固涩收敛。鸡蛋壳研末内服可用于胃溃疡反酸、胃炎疼痛,并对补钙(钙食品)有益。鸡蛋壳内衬的薄皮有滋阴润燥、润肺止咳作用,适合风燥干咳。已知鸡蛋壳的主要成分为碳酸钙,为了测定鸡蛋壳中碳酸钙的质量分数,某化学兴趣小组取一定量的鸡蛋壳和足量稀盐酸在烧杯中反应(假设鸡蛋壳中的杂质不与稀盐酸反应,反应产生的气体全部放出),有关实验数据如下表:实验数据反应前反应后鸡蛋壳质量烧杯和稀盐酸质量烧杯和其中混合物的质量12g120g127.6g试计算:(1)反应生成二氧化碳的质量是___________克。(2)计算鸡蛋壳中碳酸钙的质量分数(写出计算过程,计算结果保留一位小数)。2、鸡蛋壳的主要成分是碳酸钙,为了测定某鸡蛋壳中碳酸钙的含量,小群同学进行了如下实验:将鸡蛋壳洗净、干燥并捣碎后,称取10g放在烧杯里,然后往烧杯中加入足量的稀盐酸90g,充分反应后,称得烧杯中物质的总质量为97.8g。(假设鸡蛋壳中的其他物质不与盐酸反应)(1)产生二氧化碳气体______g。(2)计算10g该鸡蛋壳中碳酸钙的质量,要求写出完整的解题步骤。3、某兴趣小组用氯酸钾和二氧化锰混合加热制取氧气,某次实验中固体的质量变化如下:(1)生成氧气的质量为_______g。(2)求反应生成氯化钾的质量是______g。4、金属铬常用于提升特种合金性能,常以铬铁矿(主要成分有Cr2O3等)为原料制备铬(Cr)。主要反应为:Cr2O3+2AlAl2O3+2Cr。若制得52 kg Cr,计算参加反应的铝的质量(写出计算过程及结果)。5、尿素[CO(NH2)2]是一种常见的氮肥,工业上制备反应如下:CO2+2NH3CO(NH2)2+H2O,若生产12t尿素,理论上需要氨气的质量是多少?6、为了测定混有杂质的石灰石样品中碳酸钙的质量分数,取20g样品加热(杂质不反应),剩余固体的质量与加热时间的关系如表所示:加热时间/mint0t1t2t3t4t5剩余固体质量/g202017.815.613.413.4(碳酸钙分解: )(1)反应中产生二氧化碳的质量是________________。(2)通过计算求样品中碳酸钙的质量分数_______。7、实验室制取氧气时,某同学取一定量的高锰酸钾加热,记录产生氧气的质量与反应时间的关系如图所示,请回答下列问题:(1)t0-t1和t4-t5时段固体质量都不变,为什么?_______。(2)请根据图中数据计算高锰酸钾的质量。(写出计算过程)。8、乙醇汽油就是在汽油中加入适量酒精混合而成的一种燃料。乙醇完全燃烧的化学方程式为C2H6O+3O22CO2+3H2O。试回答下列问题:(计算结果保留一位小数)(1)乙醇的相对分子质量为___________。(2)乙醇中碳、氢、氧元素的质量比是___________。(3)乙醇中碳元素的质量分数是___________。(4)完全燃烧100g乙醇,能生成二氧化碳多少克?9、为防止新冠病毒的传播,我们经常用75%酒精C2H5OH消毒,乙醇俗称酒精,请计算:(1)乙醇分子中C、H、O的原子个数比为_______________;(2)9.2g乙醇分子中含有碳元素的质量为____________;(3)硝酸钾分解的化学方程式为。根据化学反应方程式计算,生成24g氧气需硝酸钾的质量是_____?
相关试卷
这是一份2022年最新人教版九年级化学上册第五单元化学方程式期末复习试卷【A4可打印】,共10页。试卷主要包含了单选题,填空题,计算题等内容,欢迎下载使用。
这是一份2022年最新人教版九年级化学上册第五单元化学方程式期末考试卷【可打印】,共9页。试卷主要包含了单选题,填空题,计算题等内容,欢迎下载使用。
这是一份2022年最新人教版九年级化学上册第五单元化学方程式期末试卷A4可打印,共8页。试卷主要包含了单选题,填空题,计算题等内容,欢迎下载使用。









