






高中鲁科版 (2019)第3节 氧化还原反应教课ppt课件
展开环顾人们所生活的环境,大到整个地球中生命的维系,小至日常生活中枝枝节节,都可以看到氧化还原反应的痕迹,它是一类重要的化学反应,在工农业生产、科学技术和日常生活中,都有广泛的应用,当然氧化还原反应也会带来危害。让我们一起学习一下吧!
1.认识有化合价变化的反应是氧化还原反应。2.知道氧化还原的特征和实质。3.能举例说明生产、生活中常见的氧化还原反应。
1.能利用氧化还原反应等概念对常见的反应进行分类和分析说明。(证据推理与模型认知)2.能利用氧化还原反应原理,预测物质的化学性质和变化。(变化观念和平衡思想)3.能举例说明生产、生活中常见的氧化还原反,体会氧化还原反应对生产、生活的影响。(科学态度与社会责任)
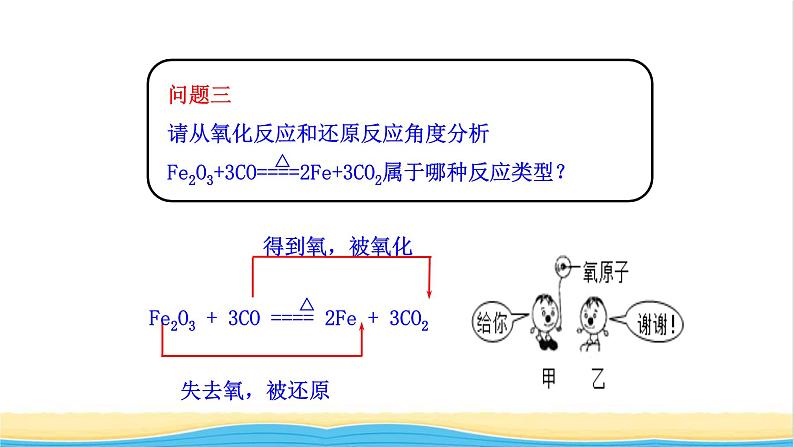
氧化反应:物质得到氧原子的反应还原反应:物质失去氧原子的反应
从得失氧的角度可得出氧化还原反应的定义:一种物质失去氧,同时另一种物质得到氧的反应,叫做氧化还原反应。
氧化反应和还原反应是同时发生的!
标出下列氧化还原反应中的各元素的化合价,观察化合价有无变化,若有变化,有何规律?
H2 + CuO ==== H2O + Cu
CO+ CuO====Cu+CO2
+2 +2 0 +4
0 0 +2 -2
2Mg +O2 ==== 2MgO
从化合价升降的角度来分析:氧化反应即为化合价升高的反应;还原反应即为化合价降低的反应。
氧化还原反应是否一定存在得失氧?请分析下面的反应。
Zn+2HCl==== ZnCl2+H2↑
2Na+Cl2====2NaCl
从化合价升降的角度定义:有元素化合价升降的反应叫氧化还原反应。
氧化还原反应的判断依据是:有无化合价的升降。
下面是我们学过的生成CO2的化学反应。请判断是否是氧化还原反应。
CaCO3 ==== CaO + CO2↑
C + O2 ==== CO2
CaCO3 + 2HCl ==== CaCl2 + CO2↑ + H2O
根据元素化合价是否有变化把化学反应分为:
氧化还原反应和非氧化还原反应
氧化还原反应与四大基本反应类型的关系是怎样的?
氧化还原反应和四大基本反应类型的关系:
1.有单质参加的化合反应一定是氧化还原反应。( )2.有单质生成的分解反应一定是氧化还原反应。( )3.有单质参加或有单质生成的反应一定是氧化还原反应。( )
化学反应发生过程中有电流产生,说明了什么?
提示:说明反应中有电子转移。
化合价升高,失去电子
先分析钠与氯气的反应吧!
在氧化还原反应中,为什么会有元素化合价的升降呢?氧化还原反应的实质到底是什么?
2Na + Cl2 ==== 2NaCl
钠与氯气反应的动画演示
化合价升降的本质 ——电子的得失
氧化反应(化合价升高)的实质是原子失去电子的过程。
还原反应(化合价降低)的实质是原子得到电子的过程。
H2 + Cl2 ==== 2HCl的动画演示
化合价升降的实质——共用电子对的偏移。
有电子的得失或偏移(统称电子的转移)就是氧化还原反应的实质。
在氯化氢分子里, 氯原子对电子的吸引力较强, 共用电子对偏向氯, 偏离氢, 故氯显-1价, 氢显+1价。
对氧化还原反应的认识历程
1.从得氧、失氧的角度分析(有局限性)
2.从化合价升降角度分析 有元素化合价升降的化学反应是氧化还原反应。 特点:可作为氧化还原反应的判断依据。
3.从电子转移角度分析 有电子转移(得失或偏移)的反应是氧化还原反应。 特点:揭示氧化还原反应的本质。
(1)(3)(5)(6)(7)
判断下列哪些反应属于氧化还原反应_____________。(1)2Na + Cl2 ==== 2NaCl(2)CaO + H2O ===Ca(OH)2(3)2KClO3 ==== 2KCl + 3O2↑(4)CaCO3==== CaO + CO2↑(5)Cl2 + 2KI ====2KCl + I2 (6)MnO2 + 4HCl(浓) ==== MnCl2 + Cl2↑ +2H2O(7)Zn + Fe2+ ====Zn2+ + Fe(8)H+ + OH- ====H2O
我们能否方便直观地显示出氧化还原反应中的电子转移情况呢?
化合价降低、被还原、得到2e-
化合价升高、被氧化、失去2×e-
氧化还原反应中的电子转移的表示方法:
1.标价:标出发生变化的元素的化合价;2.连桥:箭头起止于同种元素并且总是从反应物指向生成物;3.标得失(得失电子总数相等);4.标电子转移的数目,格式为:a×b e- a:反应中实际发生电子转移的原子个数; b:1个原子转移的电子数目或者化合价变化值。5.标被氧化、被还原
用双线桥法标出下列反应电子转移的方向和数目:(1)MnO2+4HCl(浓)====MnCl2+Cl2↑+2H2O(2)Cl2+2NaOH====NaCl+NaClO+H2O
(1)MnO2+4HCl(浓)====MnCl2+Cl2↑+2H2O(2)Cl2+2NaOH====NaCl+NaClO+H2O
表示氧化还原反应中的电子转移情况还有一种更简单的方法!
1.标出变化了的元素化合价;
2.箭头总是从失电子的元素指向得电子的元素;
3.在箭桥上只标转移电子数目,不写“得”“失”。
得到电子(电子对偏向)
失去电子(电子对偏离)
电子得失(或电子对偏移)
1.下列有关氧化还原反应的叙述中正确的是( ) A.反应中所有的元素化合价一定都发生变化 B.失去电子的物质,所含元素化合价降低 C.物质被氧化本身发生还原反应 D.一定有电子的转移(得失或偏移)
2.(双选)某元素在化学反应中由化合态变为游离态,则该元素( )A.一定被氧化 B.一定被还原C.可能被氧化 D.可能被还原
3.下列反应中HCl被氧化的是( ) A.NaOH+HCl====NaCl+H2O B.Zn+2HCl====ZnCl2+H2↑ C.MnO2+4HCl(浓)====MnCl2+2H2O+Cl2↑ D.H2+Cl2====2HCl
再思考:C项中作还原剂的HCl与参加反应的HCl的物质的量之比为多少?
4.下列反应属于氧化还原反应的是( )A.CuO+2HCl====CuCl2 +H2O B.Na2CO3+2HCl====2NaCl+CO2↑+H2OC.2KMnO4====K2MnO4+MnO2+O2 ↑ D.Ca(OH)2+CO2====CaCO3↓+ H2O
5.下列化学反应中电子转移的表示方法正确的是( )
高中化学鲁科版 (2019)必修 第一册第3节 氧化还原反应习题课件ppt: 这是一份高中化学鲁科版 (2019)必修 第一册第3节 氧化还原反应习题课件ppt,文件包含鲁科版高中化学必修第一册第2章元素与物质世界第3节氧化还原反应第3课时氧化还原反应的应用课件ppt、鲁科版高中化学必修第一册第2章元素与物质世界第3节氧化还原反应第3课时氧化还原反应的应用课后习题含答案doc等2份课件配套教学资源,其中PPT共42页, 欢迎下载使用。
高中化学鲁科版 (2019)必修 第一册第2章 元素与物质世界第3节 氧化还原反应习题ppt课件: 这是一份高中化学鲁科版 (2019)必修 第一册第2章 元素与物质世界第3节 氧化还原反应习题ppt课件,文件包含鲁科版高中化学必修第一册第2章元素与物质世界第3节氧化还原反应第1课时认识氧化还原反应课件ppt、鲁科版高中化学必修第一册第2章元素与物质世界第3节氧化还原反应第1课时认识氧化还原反应课后习题含答案doc等2份课件配套教学资源,其中PPT共43页, 欢迎下载使用。
高中第3节 氧化还原反应教学ppt课件: 这是一份高中第3节 氧化还原反应教学ppt课件,共60页。PPT课件主要包含了NO1,氧化还原,非氧化还原,元素化合价变化,元素化合价发生变化,电子转移,NO2,学习任务1学习任务2,NO3等内容,欢迎下载使用。













