
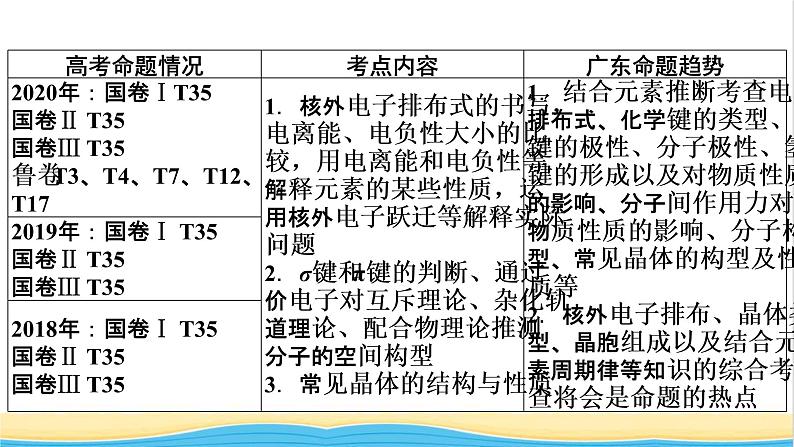





2022版高考化学一轮复习第9章物质结构与性质第1节原子结构与性质课件
展开第一节 原子结构与性质
☞知识点1 原子核外电子排布原理
1.能层、能级与原子轨道(1)能层(n):在多电子原子中,核外电子的______是不同的,按照电子的______差异将其分成不同能层。通常用K、L、M、N……表示,能量依次升高。(2)能级:同一能层里电子的________也可能不同,又将其分成不同的能级,通常用______________等表示,同一能层里,各能级的能量按______________的顺序依次升高,即_______________________。
E(s)<E(p)<E(d)<E(f)
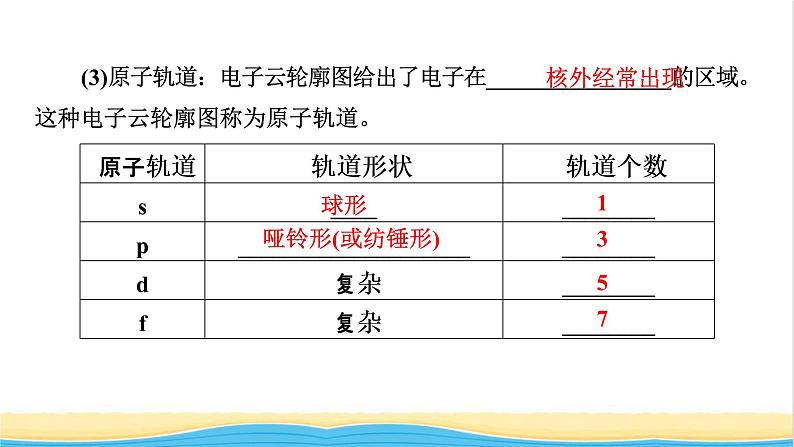
(3)原子轨道:电子云轮廓图给出了电子在________________的区域。这种电子云轮廓图称为原子轨道。
第一能层(K),只有s能级;第二能层(L),有s、p两种能级,p能级上有三个原子轨道px、py、pz,它们具有相同的能量;第三能层(M),有s、p、d三种能级。
(4)完成下表,理解电子层、能级及其最多容纳电子数的关系。
①任一电子层的能级总是从s能级开始,而且能级数等于该电子层序数。②以s、p、d、f……排序的各能级可容纳的最多电子数依次为1、3、5、7……的二倍。
2.基态原子的核外电子排布(1)能量最低原理:即电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于______状态。如图为构造原理示意图,即基态原子核外电子在原子轨道上的排布顺序图:
所有电子排布规则都需要满足能量最低原理。
(4)基态原子核外电子排布的表示方法。
1s22s22p63s23p4
[Ne]3s23p4
(1)原子核外电子排布应熟记前四个能级组的顺序图,1s→(2s→2p)→(3s→3p)→(4s→3d→4p)。(2)与4s、3d有关的问题。①填充时一定是先填充4s后填充3d,但书写顺序则相反,将3d写在3p后4s前。②反应中失去电子时,由于4s轨道位于3d外,故在化学反应中,第4周期过渡元素首先失去4s上的电子,当4s上电子全部失去后才会失去3d上的电子。
(3)Fe3+比Fe2+更稳定的原因。26Fe价层电子的电子排布式为3d64s2,Fe3+价层电子的电子排布式为3d5,Fe2+价层电子的电子排布式为3d6。根据“能量相同的轨道处于全空、全满和半满时能量最低”的原则,3d5处于半满状态,结构更为稳定,所以Fe3+较Fe2+更为稳定。
3.原子状态及原子光谱(1)基态原子:处于______________的原子。(2)激发态原子:基态原子的电子吸收能量后,从________跃迁到________状态的原子。(3)原子光谱:不同元素的原子发生电子跃迁时会______或______不同的光,用光谱仪记录下来便得到原子光谱。利用原子光谱的特征谱线可以鉴定元素,称为光谱分析。
①电子的跃迁是物理变化,是在原子内部进行的,原子组成没有变化。②电子跃迁一般发生在能量相近的能级间。
(4)基态、激发态及光谱示意图。
写出下列原子或离子的①电子排布式、②价电子轨道表示式、③电子占的原子轨道数、④未成对电子数。(1)N:①____________________________________。②___________________________________。③_________________________________________。④_________________________________________。
(2)Cl:①___________________________________。②___________________________________。③_________________________________________。④_________________________________________。(3)Fe2+:①___________________________________。②___________________________________。③_________________________________________。④_________________________________________。
(4)Cu:①___________________________________。②___________________________________。③_________________________________________。④_________________________________________。(5)Se:①___________________________________。②___________________________________。③_________________________________________。④_________________________________________。
(6)Br-:①___________________________________。②___________________________________。③_________________________________________。④_________________________________________。
突破一 电子云和电子运动状态1.(2021·福建宁德期中联考)对核外电子运动状态的描述,较为全面的是( )A.轨道表达式 B.电子式 C.电子排布式 D.结构示意图【答案】A【解析】轨道表达式不仅可以表示出每个原子轨道中的电子数目还可以表示出它们的自旋状态,A最全面。
2.(1)Ti基态原子核外电子排布式为________________________,基态铝原子核外电子云形状有________(填形状名称)。(2)基态硅原子的电子排布图为________________;硫的基态原子能量最高的电子云在空间有________个伸展方向,原子轨道呈________形。(3)航母甲板镍铬钢表面涂有一层耐高温的材料聚硅氧烷。基态铬原子的价电子排布式为____________,基态硅原子占据最高能级的电子云轮廓图为______形,元素C、O、F的电负性由大到小的顺序为___________。
(4)①在现代化学中,常利用________上的特征谱线来鉴定元素,称为光谱分析。②基态N原子的价电子占据的能量最高的能级是________,价电子在该能级上的排布遵循的原则是________。
突破二 微粒核外电子排布3.已知某元素的+2价离子的电子排布式为1s22s22p63s23p6,则该元素在周期表中的位置正确的是( )A.第三周期ⅣA族,p区B.第四周期ⅡB族,s区C.第四周期Ⅷ族,d区D.第四周期ⅡA族,s区【答案】D【解析】该原子最外层有2个电子,有4个电子层,故该元素应为第四周期ⅡA族元素Ca,处于s区,D正确。
4.下列电子排布图所表示的元素原子中,其能量处于最低状态的是( ) 【答案】D
6.(1)(2019·广东汕头模拟)Zn2+在基态时核外电子排布式为________________________________。(2)(2019·江西南昌质检)基态钒的原子结构示意图为_______。(3)(2019·河南新乡质检)基态镁原子核外电子的轨道表达式为__________________,其核外有________种能量不同的电子。(4)(2019·四川成都模拟)已知锡位于第五周期,与C同主族,写出Sn2+的最外层电子排布式______________;Cl-中有______个填充电子的能级。
☞知识点2 原子结构与元素性质
1.原子结构与元素周期表的关系
1s22s22p63s23p6
1s22s22p63s23p63d104s24p6
2.每族元素的价层电子排布特点(1)主族。(2)0族:He 1s2;其他ns2np6。(3)过渡元素(副族和第Ⅷ族):(n-1)d1~10ns1~2。
3.元素周期表的分区(1)根据核外电子排布。分区(如图所示)。
(2)各区元素化学性质及原子最外层电子排布特点(如下表)。
“外围电子排布”即“价电子层”,对于主族元素,价电子层就是最外电子层,而对于过渡元素原子,不仅仅是最外电子层,如Fe的价电子层排布为3d64s2。
4.电离能(1)第一电离能指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的______________,符号:______,单位:kJ·ml-1。(2)规律。①同周期:第一种元素的第一电离能______,最后一种元素的第一电离能______,总体呈现___________________的变化趋势。②同族元素:从上至下第一电离能__________。③同种原子:逐级电离能越来越______(即I1____I2____I3…)。
5.电负性(1)含义:元素的原子在化合物中________________能力的标度。元素的电负性越大,表示其原子在化合物中________________的能力越____。(2)标准:以最活泼的非金属氟的电负性____作为相对标准,计算得出其他元素的电负性(稀有气体未计)。
(3)变化规律:金属元素的电负性一般__________,非金属元素的电负性一般__________,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右。在元素周期表中,同周期从左至右,元素的电负性逐渐______;同主族从上至下,元素的电负性逐渐______。
(1)每个原子轨道里最多能容纳2个自旋方向相同的电子( )(2)电子排布在同一能级的不同轨道时,排满一个轨道排下一个轨道( )(3)基态原子核外电子排布严格按照构造原理排布( )(4)电负性大的元素非金属性强( )(5)价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素( )
(6)在元素周期表中,同周期元素电负性从左到右越来越大( )(7)因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大( )(8)在形成化合物时,电负性越小的元素越容易显示正价( )【答案】(1)× (2)× (3)× (4)√ (5)× (6)√ (7)× (8)√
突破一 原子最外层电子排布与元素化学性质1.(2020·福建宁德期中联考)在核电荷数为1~36的元素中,原子的价电子排布满足ns1的元素共有( )A.3种 B.4种 C.5种 D.6种【答案】B【解析】核电荷数为1~36的元素为前四周期元素,其中原子的价电子排布满足ns1的元素有H、Li、Na、K,共4种,B正确。
2.(2020·吉林乾安七中质检)下列各组中的X和Y两种原子,在周期表中一定位于同一族的是( )A.X原子和Y原子最外层都只有一个电子B.X原子的核外电子排布式为1s2,Y原子的核外电子排布式为1s22s2C.X原子2p能级上有三个电子,Y原子的3p能级上有三个电子D.X原子核外M层上仅有两个电子,Y原子核外N层上也仅有两个电子【答案】C
【解析】最外层都只有一个电子的X、Y原子,可能为H、碱金属元素、ⅠB族元素,A错误;X原子的核外电子排布式1s2为He元素,Y原子的核外电子排布式1s22s2为Be,二者不在同一族,B错误;2p轨道上只有三个电子的X为N, 3p轨道上只有三个电子的Y为P,二者位于周期表同一主族,C正确;原子核外M层上仅有两个电子的X为Mg元素,原子核外N层上仅有两个电子的Y可能为Ca、Ti、V、Fe、C、Ni、Zn等元素,不一定同族,D错误。
突破二 电离能3.下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:(1)元素p为26号元素,请写出其基态原子的电子排布式:______。
(4)第三周期八种元素按单质熔点高低的顺序如图1所示,其中电负性最大的是_____(填下图中的序号)。(5)元素周期表中所列的某主族元素的电离能情况如图2所示,则该元素是________(填元素符号)。
【答案】(1)1s22s22p63s23p63d64s2(2)电子从能量较高的能级跃迁到能量较低的能级时,以光(子)的形式释放能量(3)Mn2+的3d轨道电子处于半满状态,比较稳定(4)2 (5)Al
【解析】(4)第三周期8种元素分别为钠、镁、铝、硅、磷、硫、氯、氩,其单质中钠、镁、铝形成金属晶体,熔点依次升高;硅形成原子晶体;磷、硫、氯、氩形成分子晶体,且常温下磷、硫为固体,氯气、氩为气体,故8种元素按单质熔点由高到低的顺序为硅、铝、镁、硫、磷、钠、氯、氩,其中电负性最大的为氯。(5)由图可知,该元素的电离能I4 远大于I3,故为第ⅢA族元素,周期表中所列的第ⅢA族元素i属于第三周期,应为Al。
突破三 电负性4.(2019·福建宁德期中联考)下列各组元素的各项性质比较正确的是( )A.第一电离能:B
【解析】同周期元素,原子半径越小越难失电子,第一电离能越大,但因N的2p轨道处于半满的稳定结构,第一电离能大于O,所以第一电离能大小为B< C < O < N,A正确;F电负性最大,没有正价,且O没有+6价,B错误;非金属性越强,吸引电子能力越强,电负性越大,所以电负性为O>C>Si>Na,C错误;还原性:I->Cl-,D错误。
5.(2020·山东济南外国语学校期中)图甲和图乙表示的是元素的某种性质随原子序数的变化。下列说法正确的是( )
A.图乙不可能表示元素的电负性随原子序数的变化关系B.图甲可能表示的是元素单质的熔点随原子序数的变化关系C.图乙可能表示的是元素原子的半径随原子序数的变化关系D.图甲可能表示的是元素原子的第一电离能随原子序数的变化关系【答案】D
【解析】电负性是元素的原子在化合物中吸引电子的能力,随着核电荷数的增加呈周期性变化,故图乙可能表示元素的电负性随原子序数的变化,A错误;同周期元素中,非金属单质的熔点较低,与图像不符,B错误;同周期元素从左到右,原子半径逐渐减小,与图像不符,C错误。
1.(2020·山东卷)短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的电子总数是其最高能级电子数的2倍,Z可与X形成淡黄色化合物Z2X2,Y、W最外层电子数相同。下列说法正确的是( )A.第一电离能:W>X>Y>ZB.简单离子的还原性:Y>X>WC.简单离子的半径:W>X>Y>ZD.氢化物水溶液的酸性:Y>W
【答案】C【解析】四种短周期主族元素,基态X原子的电子总数是其最高能级电子数的2倍,Z与X能形成Z2X2的淡黄色化合物,该淡黄色固体为Na2O2,则X为O元素,Z为Na元素;Y与W的最外层电子数相同,则Y为F元素,W为Cl元素。
2.(2020·天津卷)短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是( )A.元素电负性:Z
3.(2020·全国卷Ⅰ,节选)Gdenugh等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:(1)基态Fe2+与Fe3+离子中未成对的电子数之比为________。(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是____________。I1(Be)>I1(B)>I1(Li),原因是_______________。
【答案】 (1)4∶5(2)Na与Li同主族,Na的电子层数更多,原子半径更大,故第一电离能更小 Li、Be和B为同周期元素,同周期元素从左至右,第一电离能呈现增大的趋势;但由于基态Be原子的s能级轨道处于全充满状态,能量更低更稳定,故其第一电离能大于B的【解析】(1)基态铁原子的价电子排布式为3d64s2,失去外层电子转化为Fe2+和Fe3+,这两种基态离子的价电子排布式分别为3d6和3d5,基态Fe2+有4个未成对电子,基态Fe3+有5个未成对电子,所以未成对电子个数比为4∶5。
4.(2020·全国卷Ⅱ,节选)基态Ti原子的核外电子排布式为____。【答案】1s22s22p63s23p63d24s2【解析】钛元素是22号元素,故其基态原子的核外电子排布式为1s22s22p63s23p63d24s2或[Ar]3d24s2。
5.(2020·全国卷Ⅲ,节选)H、B、N中,原子半径最大的是___________。根据对角线规则,B的一些化学性质与元素____________的相似。【答案】B Si(硅)
人教版高考化学一轮复习第12章物质结构与性质第1讲原子结构与性质课件: 这是一份人教版高考化学一轮复习第12章物质结构与性质第1讲原子结构与性质课件
2023届高三化学高考备考一轮复习第11章物质结构与性质第1节原子结构与性质课件: 这是一份2023届高三化学高考备考一轮复习第11章物质结构与性质第1节原子结构与性质课件,共60页。PPT课件主要包含了必备知识·关键能力,低能级,较高能级,ns2np1~6,ⅡB族,真题验收·新题预测等内容,欢迎下载使用。
高考化学一轮复习第11章物质结构与性质第1节原子结构与性质课件: 这是一份高考化学一轮复习第11章物质结构与性质第1节原子结构与性质课件,共60页。PPT课件主要包含了必备知识·关键能力,低能级,较高能级,ns2np1~6,ⅡB族,真题验收·新题预测等内容,欢迎下载使用。












