
所属成套资源:2022高考化学一轮复习专练含解析专题
2022高考化学一轮复习专练43难溶电解质的沉淀溶解平衡含解析
展开
这是一份2022高考化学一轮复习专练43难溶电解质的沉淀溶解平衡含解析,共11页。试卷主要包含了单项选择题,不定项选择题,非选择题等内容,欢迎下载使用。
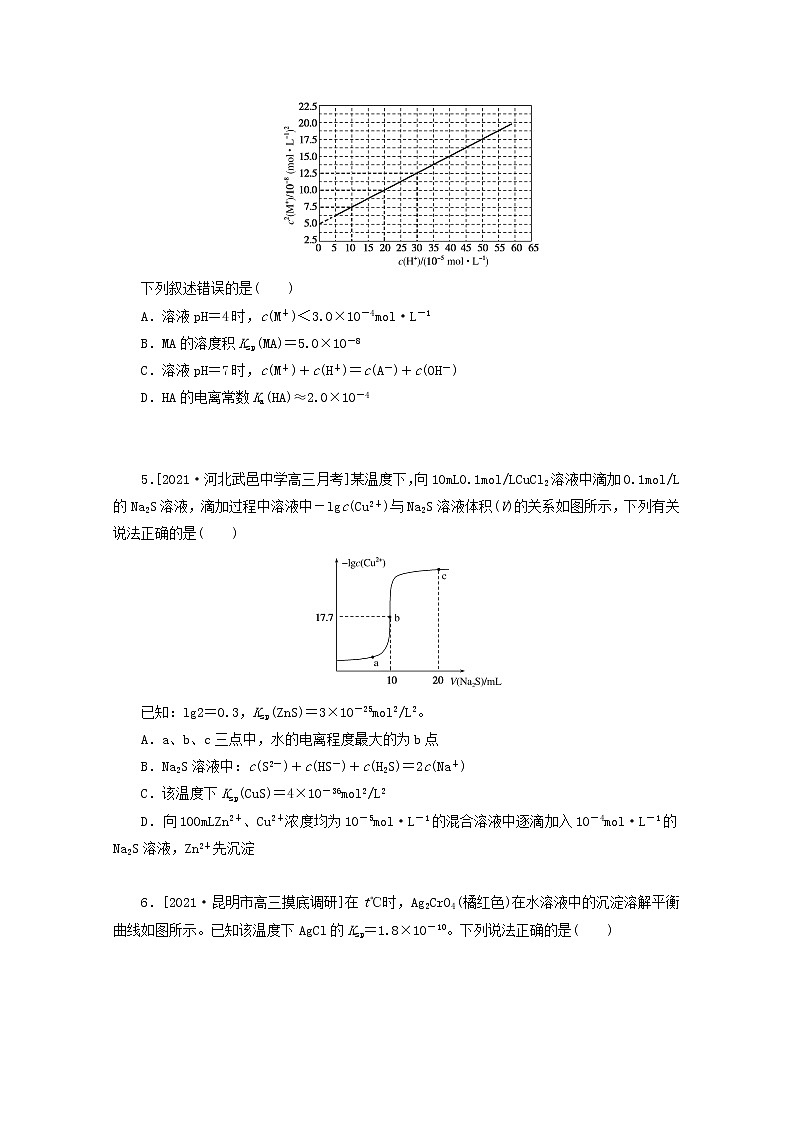
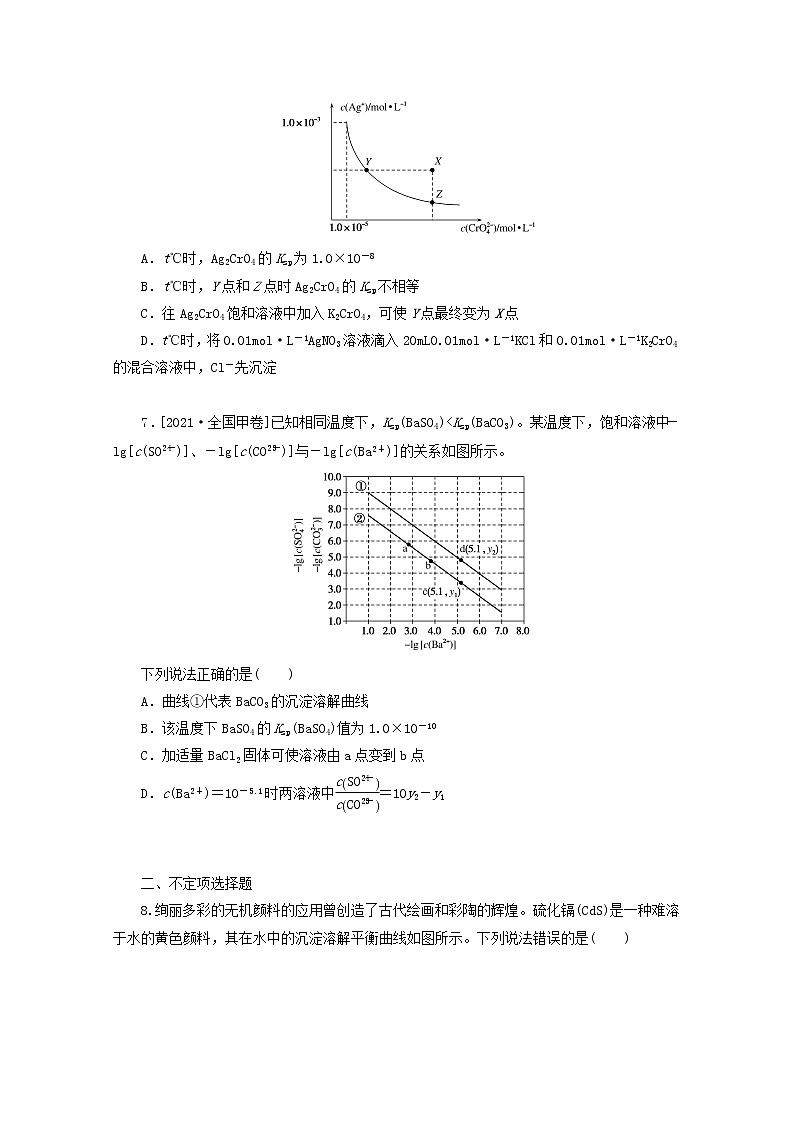
专练43 难溶电解质的沉淀溶解平衡一、单项选择题1.下列有关AgCl沉淀溶解平衡的说法中,正确的是( )A.升高温度,AgCl的溶解度减小B.在任何含AgCl固体的水溶液中,c(Ag+)=c(Cl-)且二者乘积是一个常数C.AgCl沉淀生成和溶解不断进行,但速率相等D.向AgCl沉淀溶解平衡体系中加入NaCl固体,AgCl溶解的质量不变 2.[2021·冀州月考]以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,下列分析正确的是( )A.相同条件下,MnS的溶解度小于CuS、PbS、CdS等硫化物的溶解度B.除杂试剂MnS也可用Na2S替代C.MnS与Cu2+反应的离子方程式是Cu2++S2-===CuS↓D.整个过程中涉及的反应类型有氧化还原反应和复分解反应 3.[2021·荆门调研]25℃时,5种盐的溶度积常数(Ksp)如表所示:Ag2SO4Ag2SAgClAgBrAgI1.4×10-56.3×10-501.8×10-107.7×10-138.51×10-16结合相关数据分析,下列说法不正确的是( )A.除去溶液中的Ag+用硫化钠溶液比硫酸钠效果好B.向AgCl(s)Ag+(aq)+Cl-(aq)平衡体系中加入少量氯化钠固体,溶液中c(Ag+)不变C.向少量溴化银悬浊液中加入足量饱和食盐水,沉淀颜色会由浅黄色变为白色D.向生成的黄色AgI沉淀中滴加少量Na2S溶液,沉淀会变为黑色 4.[2021·全国乙卷]HA是一元弱酸,难溶盐MA的饱和溶液中c(M+)随c(H+)而变化,M+不发生水解。实验发现,298K时c2(M+)~c(H+)为线性关系,如下图中实线所示。下列叙述错误的是( )A.溶液pH=4时,c(M+)<3.0×10-4mol·L-1B.MA的溶度积Ksp(MA)=5.0×10-8C.溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-)D.HA的电离常数Ka(HA)≈2.0×10-4 5.[2021·河北武邑中学高三月考]某温度下,向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是( )已知:lg2=0.3,Ksp(ZnS)=3×10-25mol2/L2。A.a、b、c三点中,水的电离程度最大的为b点B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)C.该温度下Ksp(CuS)=4×10-36mol2/L2D.向100mLZn2+、Cu2+浓度均为10-5mol·L-1的混合溶液中逐滴加入10-4mol·L-1的Na2S溶液,Zn2+先沉淀 6.[2021·昆明市高三摸底调研]在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。已知该温度下AgCl的Ksp=1.8×10-10。下列说法正确的是( )A.t℃时,Ag2CrO4的Ksp为1.0×10-8B.t℃时,Y点和Z点时Ag2CrO4的Ksp不相等C.往Ag2CrO4饱和溶液中加入K2CrO4,可使Y点最终变为X点D.t℃时,将0.01mol·L-1AgNO3溶液滴入20mL0.01mol·L-1KCl和0.01mol·L-1K2CrO4的混合溶液中,Cl-先沉淀 7.[2021·全国甲卷]已知相同温度下,Ksp(BaSO4)<Ksp(BaCO3)。某温度下,饱和溶液中-lg[c(SO)]、-lg[c(CO)]与-lg[c(Ba2+)]的关系如图所示。下列说法正确的是( )A.曲线①代表BaCO3的沉淀溶解曲线B.该温度下BaSO4的Ksp(BaSO4)值为1.0×10-10C.加适量BaCl2固体可使溶液由a点变到b点D.c(Ba2+)=10-5.1时两溶液中=10y2-y1 二、不定项选择题8.绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )A.图中a和b分别为T1、T2温度下CdS在水中的溶解度B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动 9.[2021·四川广安高三调研]相关物质的溶度积常数见下表(25℃):物质Mg(OH)2CH3COOAgAgClAg2CrO4Ksp1.1×10-112.3×10-31.8×10-101.9×10-12下列有关说法中不正确的是( )A.浓度均为0.2mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀B.将0.001mol·L-1AgNO3溶液滴入0.001mol·L-1KCl和0.001mol·L-1K2CrO4的混合溶液中,先产生Ag2CrO4沉淀C.向浓度为0.11mol·L-1MgCl2溶液中通入氨气产生Mg(OH)2沉淀时溶液的pH为11D.在其他条件不变的情况下,向饱和AgCl溶液中加入NaCl溶液,Ksp(AgCl)不变 10.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO)=-lgc(SO)。下列说法正确的是( )A.该温度下,Ksp(BaSO4)=1.0×10-24B.a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)C.d点表示的是该温度下BaSO4的不饱和溶液D.加入BaCl2可以使溶液由c点变到a点 11.[2021·陕西部分学校联考]常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子的浓度变化如图所示[注:第一次平衡时c(I-)=2×10-3mol·L-1,c(Pb2+)=1×10-3mol·L-1],下列有关说法正确的是( )A.常温下,PbI2的Ksp=4×10-9B.温度不变,向PbI2饱和溶液中加入少量KI浓溶液,PbI2的溶度积变大,I-浓度不变C.常温下Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq)PbS(s)+2I-(aq)的化学平衡常数为5×1018D.t时刻改变的条件是升高温度,PbI2的Ksp增大 12.AlPO4在不同温度下的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法正确的是( )A.图像中四个点的Ksp:a=b>c>dB.AlPO4在b点对应的溶解度大于c点C.AlPO4(s)Al3+(aq)+PO(aq) ΔH<0D.升高温度可使d点移动到b点 13.[2021·经典习题选萃]常温下,金属离子(Mn+)浓度的负对数值随溶液pH变化关系如图所示[已知:pM=-lgc(Mn+),当c(Mn+)≤10-5mol·L-1时认为该金属离子已沉淀完全]。下列说法正确的是( )A.常温下,Ksp[Mg(OH)2]<Ksp[Fe(OH)2]B.可以通过调节溶液pH的方法分步沉淀Cu2+和Fe2+C.除去Cu2+中少量Fe3+,可控制溶液3≤pH<4D.pM与Ksp之间的关系式为pM=lgKsp-nlgc(OH-) 三、非选择题14.已知:25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。(1)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是______________________(用溶解平衡原理解释)。万一误服了少量BaCO3,应尽快用大量0.5mol·L-1Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________mol·L-1。(2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。①CaSO4转化为CaCO3的离子方程式为________________________________。②请分析CaSO4转化为CaCO3的原理:________________________________。 15.[2021·专题模块测试](1)H2A在水中存在以下平衡:H2AH++HA-,HA-H++A2-。NaHA溶液显酸性,则溶液中离子浓度的大小顺序为________。(2)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2-(aq)滴加少量Na2A固体,c(Ca2+)________(填“增大”“减小”或“不变”),原因是________。(3)含有Cr2O的废水毒性较大,某工厂废水中含4.00×10-3mol·L-1的Cr2O。为使废水能达标排放,作如下处理:Cr2OCr2+、Fe3+Cr(OH)3、Fe(OH)3①该废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为:______________________。②若处理后的废水中残留的c(Fe3+)=1×10-13mol·L-1,则残留的Cr3+的浓度为________。{已知:Ksp[Fe(OH)3]≈1.0×10-38,Ksp[Cr(OH)3]≈1.0×10-31}(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为________mol·L-1,此时溶液中c(CrO)等于________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。(5)25℃在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。①pH=13时,溶液中的c(H2S)+c(HS-)=________mol·L-1。②某溶液含0.020mol·L-1Mn2+、0.10mol·L-1H2S,当溶液pH=________时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13] 专练43 难溶电解质的沉淀溶解平衡1.C 升高温度,AgCl的溶解度增大,A项错误;在任何含AgCl固体的水溶液中,c(Ag+)与c(Cl-)不一定相等,但二者乘积在一定温度下是一个常数,B项错误;当达到平衡时,AgCl沉淀生成和溶解不断进行,但速率相等,C项正确;向AgCl沉淀溶解平衡体系中加入NaCl固体,溶解平衡逆向移动,AgCl溶解的质量减小,D项错误。2.D 相同条件下,MnS的溶解度应大于CuS、PbS、CdS。A项错误;用Na2S替代MnS,会引入S2-和Na+杂质,同时也能生成MnS沉淀,B项错误;沉淀转化的离子方程式为Cu2+(aq)+MnS(s)===CuS(s)+Mn2+(aq),C项错误;整个反应过程中,由MnO2制得MnCl2的反应是氧化还原反应,沉淀转化是复分解反应,D项正确。3.B Ag2S的溶度积比Ag2SO4的小,更易生成Ag2S沉淀,Ag+除去得更完全,A项正确;由于温度一定时氯化银的溶度积一定,加入少量氯化钠会增加氯离子浓度,平衡逆向移动,所以溶液中银离子浓度会减小,B项错误;由于饱和NaCl溶液中Cl-的浓度较大,溴化银沉淀会转化为氯化银沉淀,C项正确;因为硫化银更难溶,所以碘化银会转化为黑色的硫化银,D项正确。4.C 溶液pH=4时c(H+)=1×10-4mol·L-1,由图知,此时c2(M+)=7.5×10-8(mol·L-1)2,c(M+)<3.0×10-4mol·L-1,A项正确;由图知,当c(H+)=0,即不向溶液中加酸时,c2(M+)=5.0×10-8(mol·L-1)2,c(M+)=×10-4mol·L-1,由MA(s)M+(aq)+A-(aq)知,MA的饱和溶液中c(M+)=c(A-),则Ksp(MA)=c(M+)×c(A-)=5.0×10-8,B项正确;MA的饱和溶液因A-水解而显碱性,只有加入一定量的酸才能使溶液显中性,若加入的酸不是HA,则溶液中除含有M+、H+、OH-、A-四种离子外还含有其他阴离子,由电荷守恒原理知,C项错误;溶液中c(M+)===,根据MAM++A-,A-+H+HA知,溶液中c(HA)=c(M+)-c(A-)=c(M+)-,两式联立可得c(M+)·Ka(HA)·[c(M+)-]=Ksp·c(H+),化简可得c2(M+)=Ksp[+1],将Ksp=5×10-8代入,由图知,c(H+)=20×10-5mol·L-1时,c2(M+)=10.0×10-8 (mol·L-1)2,将数据代入计算得Ka(HA)=2.0×10-4,D项正确。5.C CuCl2、Na2S水解促进水电离,b点是CuCl2与Na2S溶液恰好完全反应的点,溶质是氯化钠,对水的电离没有作用,水的电离程度最小,A错误;根据物料守恒,Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),故B错误;b点是CuCl2与Na2S溶液恰好完全反应的点,c(Cu2+)=c(S2-),根据b点数据,c(Cu2+)=2×10-18mol/L,该温度下Ksp(CuS)=4×10-36mol2/L2,故C正确;Ksp(ZnS)=3×10-25mol2/L2大于Ksp(CuS),所以向100mLZn2+、Cu2+浓度均为10-5mol·L-1的混合溶液中逐滴加入10-4mol·L-1的Na2S溶液,Cu2+先沉淀,D错误。6.D Ag2CrO4的沉淀溶解平衡为:Ag2CrO4(s)2Ag++CrO;Ksp=c2(Ag+)·c(CrO)=(1×10-3)2×(1×10-5)=1×10-11;A错误;一定温度下溶度积是常数,随温度变化,不随浓度变化,所以t℃时,Y点和Z点时的Ksp相等,B错误;在饱和Ag2CrO4溶液中加入K2CrO4,仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故C错误;t℃时,将0.01mol·L-1AgNO3溶液滴入20mL0.01mol·L-1KCl和0.01mol·L-1K2CrO4Ag2CrO4的混合溶液中,Cl-开始沉淀时c(Ag+)==mol/L=1.8×10-8mol/L,CrO开始沉淀时,c(Ag+)==mol·L-1=10-4.5mol/L,故Cl-先沉淀,D正确。7.B 根据相同温度下,Ksp(BaSO4)<Ksp(BaCO3),可进行如下分析:当横坐标均为5.1时,即c(Ba2+)=10-5.1mol·L-1时,阴离子浓度:d点<c点;c、d两点均在沉淀溶解平衡曲线上,即溶度积常数:d点<c点,故曲线①代表BaSO4的沉淀溶解曲线。结合上述分析,可知曲线①代表BaSO4的沉淀溶解曲线,曲线②代表BaCO3的沉淀溶解曲线,A项错误;根据曲线①过横、纵坐标均为5.0的点可知,溶解平衡体系中c(Ba2+)=c(SO)=1×10-5.0mol·L-1,则该温度下Ksp(BaSO4)=c(Ba2+)·c(SO)=1×10-(5.0+5.0)=1×10-10,B项正确;加适量BaCl2固体,溶液中c(Ba2+)增大,由于温度保持不变,即溶液中c(CO)减小,可使溶液由b点向a点移动,C项错误;当c(Ba2+)=10-5.1mol·L-1时,d点平衡时c(SO)=10-y2mol·L-1,c点平衡时c(CO)=10-y1mol·L-1,即两溶液中==10y1-y2,D项错误。8.B 本题涉及的知识点为难溶电解质的溶解平衡及Ksp大小的比较;通过图像考查了考生接受、吸收、整合化学信息的能力;考查温度和浓度变化对溶解平衡的影响,体现了变化观念与平衡思想的学科核心素养。以古代绘画和彩陶为素材,贯彻了弘扬中华民族优秀传统文化的价值观念。CdS在水中达到溶解平衡时Cd2+、S2-浓度相等,可求出一定温度下CdS在水中的溶解度,A项正确;m、p、n为同一温度下的CdS的溶解平衡状态,三点的Ksp相等,B项错误;向m点溶液中加入Na2S,S2-浓度增大,但Ksp不变,则溶液组成由m沿T1时的平衡曲线向p方向移动,C项正确;温度降低,Ksp减小,q沿qp线向p方向移动,D项正确。9.BC 浓度均为0.2mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合后,浓度均变为0.1mol·L-1,此时c(Ag+)·c(CH3COO-)=0.01>2.3×10-3,所以一定产生CH3COOAg沉淀,A项正确;根据AgCl和Ag2CrO4的溶度积常数可知,在Cl-和CrO浓度均为0.001mol·L-1的条件下,开始出现沉淀时,Ag+的浓度分别为1.8×10-7mol·L-1, mol·L-1,所以先产生AgCl沉淀,B项错误;根据Mg(OH)2的溶度积常数可知,0.11mol·L-1MgCl2溶液中通入氨气产生Mg(OH)2沉淀时溶液中OH-的浓度为mol·L-1=1×10-5mol·L-1,因此H+的浓度为1×10-9mol·L-1,则溶液的pH为9,C项错误;溶度积常数只与温度有关系,则在其他条件不变的情况下,向饱和AgCl溶液中加入NaCl溶液,Ksp(AgCl)不变,D项正确。10.D 由图像可知,p(Ba2+)=4,p(SO)=6则Ksp=c(Ba2+)·c(SO)=10-10,A项错误;处于同一温度下,Ksp相等,B项错误;d点时p(Ba2+)偏小,则c(Ba2+)偏大,溶液过饱和,C项错误;加入BaCl2,c(Ba2+)增大,有沉淀析出,c(SO)减小,平衡正向移动,则可使溶液由c点变到a点,D项正确。11.AC 由PbI2(s)Pb2+(aq)+2I-(aq)得Ksp=c(Pb2+)·c2(I-)=1×10-3×(2×10-3)2=4×10-9,A项正确;由于KI是强电解质,完全电离产生I-,温度不变,PbI2的溶度积不变,I-浓度增大,B项错误;PbI2(s)+S2-(aq)PbS(s)+2I-(aq)的平衡常数K===5×1018,C项正确;若t时刻改变的条件是升高温度,则c(Pb2+)、c(I-)均呈增大趋势,D项错误。12.B 由图像可知,温度越高溶度积常数越大,则图像中四个点Ksp的大小关系为a=c=d<b,A项错误;b点温度高,溶解度大,AlPO4在b点对应的溶解度大于c点,B项正确;根据图像可知,温度升高溶度积常数增大,则AlPO4(s)Al3+(aq)+PO(aq) ΔH>0,C项错误;升高温度,阴、阳离子浓度均增大,不可能使d点移动到b点,D项错误。13.C 常温下,pH一定时c(Mg2+)>c(Fe2+),所以Ksp[Mg(OH)2]>Ksp[Fe(OH)2],A项错误;当Cu2+完全沉淀时,Fe2+已经开始沉淀,所以不能通过调节溶液pH的方法分步沉淀Cu2+和Fe2+,B项错误;当3≤pH<4时,Fe3+完全沉淀,而Cu2+不会沉淀,所以除去Cu2+中少量Fe3+,可控制溶液3≤pH<4,故C项正确;Ksp=c(Mn+)·cn(OH-),c(Mn+)=,pM=-lgc(Mn+)=-lg=-lgKsp+nlgc(OH-),D项错误。14.(1)对于平衡BaSO4(s)Ba2+(aq)+SO(aq),H+不能减少Ba2+或SO的浓度,平衡不能向溶解的方向移动 2×10-10(2)①CaSO4(s)+CO(aq)CaCO3(s)+SO(aq)②CaSO4存在沉淀溶解平衡,加入Na2CO3溶液后,CO与Ca2+结合生成CaCO3沉淀,Ca2+浓度减小,使CaSO4的沉淀溶解平衡向溶解方向移动解析:BaSO4(s)Ba2+(aq)+SO(aq),由于Ba2+、SO均不与H+反应,无法使平衡移动。c(Ba2+)==2×10-10mol·L-1。15.(1)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)(2)减小 加少量Na2A固体,A2-浓度增大,CaA的溶解平衡向左移动,所以c(Ca2+)减小(3)①Cr2O+14H++6Fe2+===2Cr3++6Fe3++7H2O②1×10-6mol·L-1(4)2.0×10-5 5.0×10-3(5)①0.043 ②5解析:(1)因为钠离子不水解,HA-既水解又电离,所以c(Na+)>c(HA-),因为NaHA溶液显酸性,所以HA-的电离大于水解,又因为水电离也能产生H+,所以c(H+)>c(A2-),水的电离很微弱,OH-浓度很小,所以c(A2-)>c(OH-),综上,c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。(2)由于加入Na2A固体,c(A2-)增大,从而导致溶解平衡左移,c(Ca2+)减小。(3)①Cr2O有较强氧化性,FeSO4·7H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,由实验流程可知,第①步反应中Cr2O在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,根据元素守恒及所处环境可知,还应有水生成,反应离子方程式为Cr2O+14H++6Fe2+===2Cr3++6Fe3++7H2O;②根据Ksp[Fe(OH)3]=1.0×10-38和Ksp[Cr(OH)3]≈1.0×10-31,若处理后的废水中残留的c(Fe3+)=1×10-13mol·L-1,=,c(Cr3+)=×1×10-13mol/L=1×10-6mol·L-1。(4)结合Ksp(AgCl)和溶液中c(Cl-)=1.0×10-5mol·L-1,可求出溶液中c(Ag+)==2.0×10-5mol·L-1。结合溶液中c(Ag+)=2.0×10-5mol·L-1和Ksp(Ag2CrO4)可求出溶液中c(CrO)==5.0×10-3mol·L-1。(5)①根据物料守恒:c(S2-)+c(H2S)+c(HS-)=0.10mol·L-1,故c(H2S)+c(HS-)=0.10mol·L-1-c(S2-)=0.10mol·L-1-5.7×10-2mol·L-1=0.043mol·L-1。②要使Mn2+沉淀,需要的c(S2-)最小值===1.4×10-11,再对照图像找出pH=5。
相关试卷
这是一份高考化学一轮复习一遍过专题32难溶电解质沉淀溶解平衡(含解析),共21页。
这是一份新高考2024版高考化学一轮复习微专题小练习专练43难溶电解质的沉淀溶解平衡,共6页。试卷主要包含了100 ml·L-1,75等内容,欢迎下载使用。
这是一份统考版2024版高考化学一轮复习微专题小练习专练43难溶电解质的沉淀溶解平衡,共6页。









