所属成套资源:2022届高三化学一轮复习化学反应原理题型必练含解析专题
2022届高三化学一轮复习化学反应原理题型必练15化学平衡基于图标的分析计算含解析
展开
这是一份2022届高三化学一轮复习化学反应原理题型必练15化学平衡基于图标的分析计算含解析,共25页。试卷主要包含了工业合成氨反应为等内容,欢迎下载使用。
化学平衡基于图标的分析计算
非选择题(共20题)
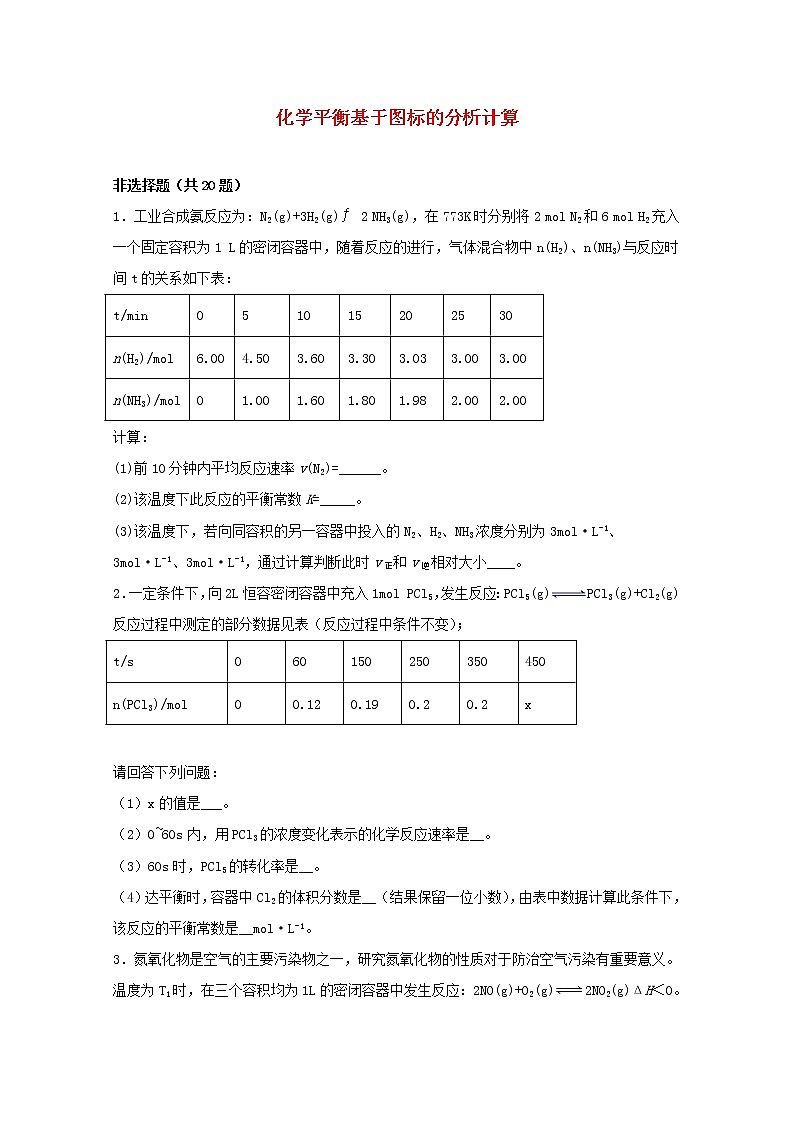
1.工业合成氨反应为:N2(g)+3H2(g)2 NH3(g),在773K时分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min
0
5
10
15
20
25
30
n(H2)/mol
6.00
4.50
3.60
3.30
3.03
3.00
3.00
n(NH3)/mol
0
1.00
1.60
1.80
1.98
2.00
2.00
计算:
(1)前10分钟内平均反应速率v(N2)=______。
(2)该温度下此反应的平衡常数K=_____。
(3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3浓度分别为3mol·L-1、3mol·L-1、3mol·L-1,通过计算判断此时v正和v逆相对大小____。
2.一定条件下,向2L恒容密闭容器中充入1mol PCl5,发生反应:PCl5(g)PCl3(g)+Cl2(g)反应过程中测定的部分数据见表(反应过程中条件不变);
t/s
0
60
150
250
350
450
n(PCl3)/mol
0
0.12
0.19
0.2
0.2
x
请回答下列问题:
(1)x的值是___。
(2)0~60s内,用PCl3的浓度变化表示的化学反应速率是__。
(3)60s时,PCl5的转化率是__。
(4)达平衡时,容器中Cl2的体积分数是__(结果保留一位小数),由表中数据计算此条件下,该反应的平衡常数是__mol·L-1。
3.氮氧化物是空气的主要污染物之一,研究氮氧化物的性质对于防治空气污染有重要意义。
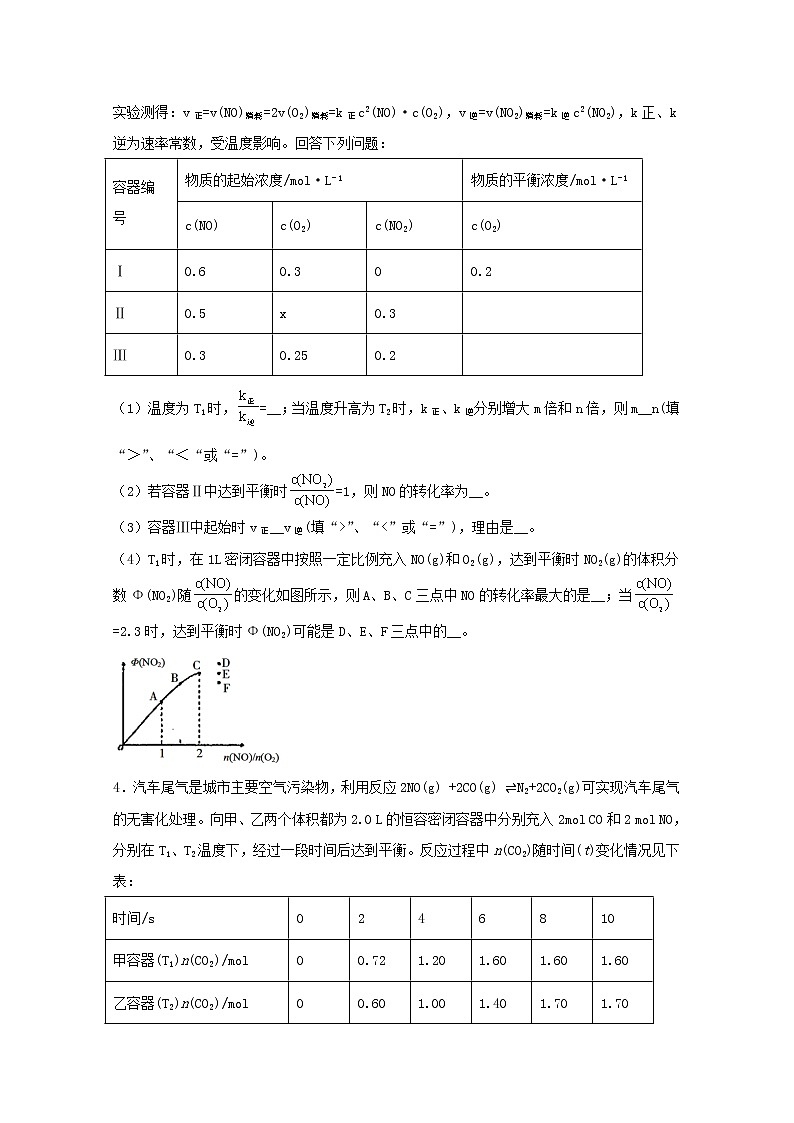
温度为T1时,在三个容积均为1L的密闭容器中发生反应:2NO(g)+O2(g)2NO2(g)ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。回答下列问题:
容器编号
物质的起始浓度/mol·L−1
物质的平衡浓度/mol·L−1
c(NO)
c(O2)
c(NO2)
c(O2)
Ⅰ
0.6
0.3
0
0.2
Ⅱ
0.5
x
0.3
Ⅲ
0.3
0.25
0.2
(1)温度为T1时,=__;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m__n(填“>”、“<“或“=”)。
(2)若容器Ⅱ中达到平衡时=1,则NO的转化率为__。
(3)容器Ⅲ中起始时v正__v逆(填“>”、“”“”、“=”、“<”或“无法判断”);丙容器中n(CO)为___________mol。
20.向VL恒容密闭容器中充入amolCO与2amolH2,发生如下反应:CO(g)+2H2(g)CH3OH(g)。CO在不同压强下的平衡转化率与温度的关系如图所示。
(1)压强P1___P2(填“<”、“>”或“=”)
(2)在100℃、P1压强时,反应的平衡常数为___(用含a,V的代数式表示)。
(3)上述条件下达平衡后,再向容器中充入amolCO与2amolH2,重新达到平衡后,CO的体积分数___(填“增大”、“减小”或“不变”)。
参考答案
1.0.08 mol·L-1·min-1 (mol·L-1)-2 v正>v逆
【详解】
(1) 由化学反应方程式N2(g)+3H2(g)2 NH3(g)可知,前10min氨气的反应速率为v(NH3)=,速率之比等于化学计量数之比,所以v(N2)= v(NH3)= 0.08 mol·L-1·min-1,故答案为:0.08 mol·L-1·min-1
(2)
此时平衡常数为:(mol·L-1)-2,故答案为:(mol·L-1)-2;
(3) 该温度下,若向同容积的另一容器中投入的N2、H2、NH3浓度分别为3mol·L-1、3mol·L-1、3mol·L-1,根据(mol·L-1)-2<K,因为Qc<K,所以反应正向进行,故v正>v逆,故答案为:v正>v逆。
2.0.2 0.001mol·L-1·s-1 12% 16.7% 0.025
【详解】
(1)250s时反应即已经达到了平衡状态,所以450s时仍然为平衡状态,x=0.2;
(2)0~60s内,PCl3的物质的量增加了0.12mol,容器体积为2L,则PCl3浓度增加了0.06mol/L,用PCl3的浓度变化表示的化学反应速率是=0.001mol·L-1·s-1;
(3)60s时,PCl3的物质的量增加了0.12mol,则PCl5消耗了0.12mol,PCl5的转化率是×100%=12%;
(4)达平衡时,PCl3的物质的量为0.2mol,根据方程式,Cl2的物质的量也为0.2mol,反应的PCl5为0.2mol,剩余的PCl5为0.8mol,所以容器中Cl2的体积分数是×100%=16.7%;平衡时各物质的浓度为:c(PCl3)=c(Cl2)=0.1mol/L,c(PCl5)=0.4mol/L,则该反应的平衡常数是=0.025mol·L-1。
3.1.25 < 20% < 通过计算可知Qc=1.78>K,反应向逆反应方向移动,所以v正<v逆 A F
【分析】
依据公式并结合平衡状态V正=V逆,借助平衡三行式进行计算即可。
【详解】
(1)结合v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)•c(O2),得出k正=;利用v逆=v(NO2)消耗=k逆c2 (NO2),得出k逆=,因为v(NO)消耗=v(NO2)消耗,
所以=K;
K===1.25;
2NO(g)+O2(g)⇌2NO2(g)△H<0,此反应正反应是放热反应,升高温度,平衡逆向移动,平衡常数减小,由于K,当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m<n;
(2)设起始量氧气物质的量浓度为x,消耗浓度为y,
达到平衡时=1,故0.5-2y=0.3+2y,y=0.05,NO的转化率==20%;
(3)容器Ⅲ中起始时v正<v逆,因为 Qc===1.78>K=1.25,反应向逆反应方向进行,所以v正<v逆;
(4)总物质的量一定时,氧气的浓度越大,NO的转化率越大,故A点最大,两者按2:1充入时,NO2的体积分数最大,当比值增大后,二氧化氮的体积分数减小,当=2.3时,达到平衡时Φ(NO2)可能是F点。
【点睛】
考查化学平衡计算,注意掌握三段式在化学平衡计算中的应用,特别注意平衡时V正=V逆,Qc>K时平衡逆向移动。
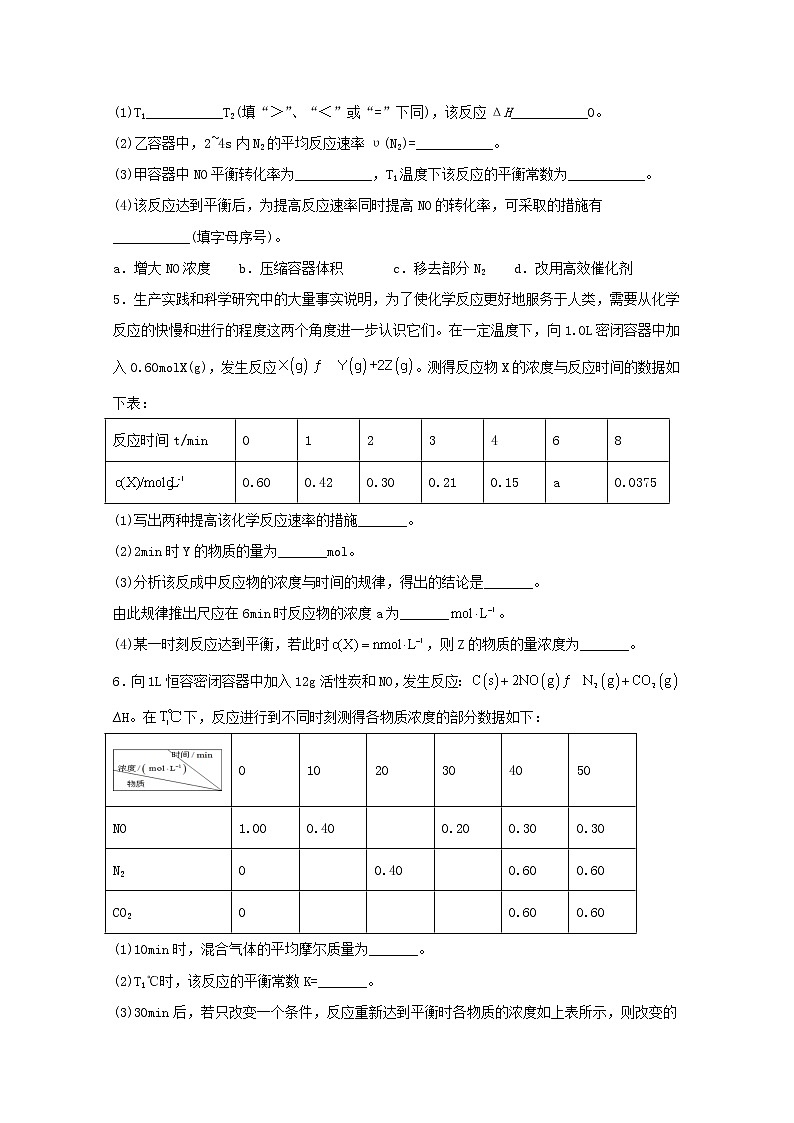
4.> < 0.05mol/(L·s) 80% 160 b
【分析】
根据表格数据,甲容器中达到平衡时间短,反应的温度高,结合温度对平衡的影响和v=,利用三段式分析解答。
【详解】
(1) 2NO(g) +2CO(g) ⇌N2+2CO2(g),向甲、乙两个体积都为2.0L的恒容密闭容器中分别充入2mol CO和2 mol NO,分别在T1、T2温度下,经过一段时间后达到平衡,甲容器达到平衡需要的时间短,则反应速率快,说明反应温度T1>T2;达到平衡状态时,乙中CO2的物质的量大于甲中CO2的物质的量,说明降低温度,平衡正向进行,则正反应为放热反应,△H<0,故答案为:>;<;
(2)乙容器中,2~4s内N2的平均反应速率v(N2)=v(CO2)= ×=0.05mol•L-1•s-1,故答案为:0.05mol•L-1•s-1;
(3) 甲容器中,
NO平衡转化率=×100%=80%;容器的体积为2L,则平衡常数K==160,故答案为:80%;160;
(4)a.增大NO浓度,NO的转化率降低,故a不选;b.压缩容器体积,压强增大,反应速率加快,平衡正向移动,NO的转化率增大,故b选;c.移去部分N2,反应速率减慢,故c不选;d.改用高效催化剂,平衡不移动,NO的转化率不变,故d不选;故答案为:b。
5.升高温度、增大X的浓度等 0.30 每间隔2min,x的浓度减少为原来的一半 0.075 2(0.6-n)
【详解】
(1)增大反应物X的浓度,升高温度均可以提高该反应的化学反应速率;
(2)由表中数据可知,0-2min内消耗X的物质的量为(0.60mol/L-0.30mol/L)×1.0L=0.30mol,由化学方程式可知,2min时生成Y的物质的量为0.30mol;
(3)从表中数据可知,X的浓度变化的规律为每间隔2min,X的浓度为原来的一半,根据此规律可知,a为0.15的一半,即0.075;
(4)在某一时刻反应达到平衡,若此时c(X)=nmol/L,则消耗X的物质的量浓度为(0.60-n)mol/L,由化学方程式可知,生成Z的物质的量浓度为2(0.6-n)mol/L。
6.33.6g∙mol-1 4 cd <
【分析】
10min时,由表知:,假如不另外加入物质,则可得下表:
0
10
20
30
40
50
NO
1.00
0.40
0.20
0.20
0.30
0.30
N2
0
0.30
0.40
0.40
0.60
0.60
CO2
0
0.30
0.40
0.40
0.60
0.60
【详解】
(1)据分析:混合气体的平均摩尔质量为。(2)平衡常数只与温度有关,据分析,T1℃平衡时,该反应的平衡常数。
(3)30min后,若只改变一个条件,则改变的条件:
a.加入一定量的活性炭固体或粉末,不影响平衡 ,a错误;
b.改变反应体系的温度,平衡移动,平衡常数会改变,由数据知:,条件改变而平衡常数没有变化,则温度不变,b错误;
c.由数据知,改变条件达新的平衡时各组分浓度同等程度的增大,则可以是缩小容器的体积 ,c正确;
d.由勒夏特列原理知:通入一定量的NO,平衡右移,达到新平衡时各成分的数据满足理论、满足K=4,d正确;
答案为cd;
(4)据分析,30min时容器中NO、、的浓度之比为1:2:2,若30min后升高温度至,重新达到平衡时,容器中NO、、的浓度之比为7:3:3,则平衡左移,按勒夏特列原理知,该反应为放热反应,∆H0。
7.0.0045mol·L-1·s-1 0.02mol·L-1 16:15 25%
【详解】
(1)0~2s内消耗0.09mol CO,则生成0.045mol N2,用N2表示的反应速率是0.0045mol·L-1·s-1。
(2)根据表格数据,3s时反应达到平衡状态,消耗0.1molCO,生成0.1mol CO2,平衡时CO2的物质的量浓度为0.02mol·L-1;
(3)
同温、同体积,压强比等于物质的量比,达到平衡时,反应前后总压强之比p(前):p(后)=(0.4+0.4):(0.3+0.3+0.1+0.05)=16:15。
(4)达到平衡时,消耗0.1molNO,NO的转化率为25%。
8.> 97.56% 0.16mol/(L⋅min)
【分析】
(1)根据反应的平衡常数表达式为K= 计算;
(2)利用三段式计算平衡时各组分浓度,根据v=计算反应速率。
【详解】
(1)该反应的平衡常数表达式为:K=,将所给浓度带入平衡常数表达式:=1.86>400,故反应向正反应方向进行,正反应速率大于逆反应速率;
(2)由题意,列三段式:
K==400,解得x=0.2mol/L,故平衡时c(CH3OH)=0.44mol/L−0.2mol/L×2=0.04mol/L,起始时在密闭容器中加入CH3OH,则起始时甲醇的浓度为0.44moL/L+0.6mol/L×2=1.64mol/L,平衡时c(CH3OH)=0.04mol/L,则10min转化甲醇1.64moL/L−0.04moL/L=1.6mol/L,甲醇的转化率=×100%=97.56%,甲醇的反应速率为v(CH3OH)===0.16mol/(L⋅min)。
9.0.0023
计算过程:V(Zn)=,因为锌层有上下两层h=,m(Zn)= =0.821g,S(Zn)= =25cm2,h==0.0023cm。
【详解】
根据表格数据,第3组实验数据误差较大,舍去,根据V(Zn)=,因为镀锌铁皮中锌层有上下两层,根据体积=底面积(S)×高(厚度h),因此铁皮的厚度h=,反应的锌的质量平均值为=0.821g,锌层的面积平均值S(Zn)=cm2=25cm2,则厚度h==0.0023cm。
10.0.0875mol/(L·s) 8 >
【详解】
(1)根据表中数据计算出前2s内v(NO2)= ;
(2)建立平衡时,反应三段式为:
根据化学平衡常数;
(3)2NO(g)+O2(g)⇌2NO2(g)化学平衡常数,化学反应达到平衡时v正=v逆,即k正c2(NO)⋅c(O2)=k逆c2(NO2),则,即;温度改变为T2时其k正=k逆,则T2时化学平衡常数K=1,小于T1温度时的化学平衡常数,即T1→T2时,平衡逆向移动,而2NO(g)+O2(g)⇌2NO2(g)△HT1,故答案为:;>。
11. 通入一定量的NO;适当缩小容器的体积;增大压强;通入等物质的量的和
【分析】
(1)Tl℃时,由表格数据可知20min达到平衡,平衡浓度c(N2)=0.3mol/L、c(CO2)=0.3mol/L、c(NO)=0.4mol/L,以此计算反应的平衡常数;
(2)30min后,只改变某一条件,反应重新达到平衡,C(s)+2NO(g)⇌N2(g)+CO2(g),由图表数据分析计算平衡常数K′,根据平衡常数结合影响化学平衡的因素分析解答。
【详解】
(1)时,由表格数据可知20min达到平衡,平衡浓度、、,则,故答案为:;
(2)后,只改变某一条件,反应重新达到平衡,,由图表数据分析,平衡状态物质浓度增大,平衡常数,平衡常数随温度变化,平衡常数不变,说明改变的条件一定不是温度;由氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体系数和相等,则改变的条件可能是通入一定量的NO或适当缩小容器的体积或增大压强或通入等物质的量的和,故答案为:通入一定量的NO或适当缩小容器的体积或增大压强或通入等物质的量的和。
12.吸热 0.025 0.48mol
【分析】
(1) 根据三段式分别计算T1、T2时的平衡常数K,结合温度对平衡的影响分析判断;
(2)温度相同,平衡常数相同,根据三段式计算解答;
(3) 温度相同,平衡常数相同,首先根据Qc与K的大小判断反应进行的方向,再根据三段式计算解答。
【详解】
(1) T1时,
2SiHCl3(g)SiH2Cl2(g)+ SiCl4(g)
起始(mol) 1 0 0
反应(mol)0.2 0.1 0.1
平衡(mol)0.8 0.1 0.1
平衡常数K1==,同理T2时,K3==0.25>K1,说明平衡正向移动,即升高温度,平衡正向移动,因此正反应为吸热反应,故答案为:吸热;
(2)温度相同,平衡常数相同,
T1时2SiHCl3(g)SiH2Cl2(g)+ SiCl4(g)
起始(mol)0.4 a a
反应(mol)0.04 0.02 0.02
平衡(mol)0.36 a+0.02 a+0.02
则K==,解得:a=0.025,故答案为:0.025;
(3) 温度相同,平衡常数相同,此时Qc==0.5>K=0.25,不是平衡状态,反应需要逆向进行,设从起始时到建立平衡, SiHCl3物质的量增加了2bmol,则:
T2时, 2SiHCl3(g)SiH2Cl2(g)+ SiCl4(g)
起始(mol) 0.4 0.4 0.2
反应(mol) 2b b b
平衡(mol)0.4+2b 0.4-b 0.2-b
则K==0.25,解得:b=0.04,则0.4+2b=0.48,故答案为:0.48mol。
13.1.5a 0 0.5 2(b-4c) (b-3c)a
【分析】
在一个盛有催化剂、容积可变的密闭容器中,温度、压强一定时,反应达平衡,几种情况下平衡时各组分的体积分数不变,则为等效平衡体系。平衡时,各物质的对应浓度相等。
【详解】
(1)n(N2)、n(H2)、n(NH3)的起始物质的量分别为1.5mol、6mol、0,即起始浓度分别为已知体系的1.5倍,平衡时压强相等,则平衡时物质的量也应分别为已知体系的1.5倍,从而得出平衡时n(NH3)= 1.5a mol。答案为:1.5a;
(2)从平衡时n(NH3)= 0.5a mol看,若起始时生成物的物质的量为0,则N2、H2物质的量也应为已知体系中对应物质的0.5倍,从而得出n(NH3)= 0.5a mol时,n(N2)=0.5mol-0.5mol=0、n(H2)=2mol-1.5mol=0.5mol。答案为:0;0.5;
(3)设起始时n(NH3)=x,采用一边倒后,n(N2)=(c+0.5x)mol、n(H2)= (b+1.5x)mol,则,x=2(b-4c)mol,从而得出平衡时n(NH3)=(b-3c)a mol。答案为:2(b-4c);(b-3c)a。
【点睛】
对于恒温恒容条件下的等效平衡体系,平衡时各物质的浓度等效,若起始时a容器的体积是b容器体积的二倍,则平衡时a容器的体积也应是b容器体积的二倍,各气体的物质的量也应是二倍关系。
14.ac K1•K2 = 25 等于
【详解】
(1)由表中数据可知,化学反应②的平衡常数随着温度升高而增大,据此分析:
a.根据平衡常数的定义,温度升高平衡常数增大,说明反应向正反应方向移动,a项正确;
b.反应前后气体体积不变,则气体的平均相对分子质量不随时间而变化,b项错误;
c.随着温度升高,平衡常数增大,反应向正反应方向移动,CO2的转化率增大,c项正确;
答案选ac;
(2)根据盖斯定律可知,反应③=①+②,由平衡常数定义可得,K3= K1•K2。答案为:K1•K2;
(3)由(2)可知,500℃时,K3= K1•K2=2.50。此时反应③的浓度商Qc== K3,则此时反应③达到平衡状态,则v正=v逆。答案为:=;
(4)根据题意,H2的平衡转化率为80%,则反应过程中H2的转化浓度为,平衡时H2的浓度=2mol/L-1.6mol/L=0.4mol/L。根据反应方程式,可知,平衡时CO的浓度=,平衡时CH3OH的浓度为0.8mol/L。根据化学平衡常数的定义,此温度下,该反应的化学平衡常数=;答案为:25;
(5)根据题给信息,甲中平衡时c(H2O)=0.05mol/L,则平衡时c(CO2)=0.05mol/L,c(H2)=0.05mol/L,c(CO)=0.05mol/L。甲中CO2的转化率=。此时甲中的平衡常数=。温度不变,平衡常数也不变,则乙中的平衡常数等于1。设乙中CO2的转化率为x,则根据化学反应方程式和平衡常数的定义,有:,解得:x=50%。由此可知乙中CO2的转化率与甲相等。答案为:50%;等于。
15.= 0.05mol/(L·min) 60% 1 a、b
【详解】
(1)时,根据表格数据可列出三段式,,时,,与3min时一样,则3min时,反应达到平衡状态,则v(正)=v(逆);
(2)0~2min,,则,;
(3)反应达到平衡时,的转化率为;该温度下反应的平衡常数为;
(4)850℃时,在体积可变的密闭容器中,按表中物质不同的起始浓度进行反应,达到平衡时CO的百分含量与原平衡相同,即为恒温恒压条件下的等效平衡,则按照方程式中的化学计量数转化到反应物一边时,与原投入量成比例,即等于;
a组:转化后为,等于,符合;
b组:投入量,符合;
c组:转化后为,,不符合;
d组:转化后为,,不符合;故选ab。
16.0.05 mol/(L•min) 40% < T1时K=2.6,T2时K=1
【分析】
(1)可逆反应的△H表示1mol反应物完全反应时候的焓变,实验甲中,若2min 时测得放出的热量是4.2kJ,据此计算消耗的反应物,再根据化学反应速率的计算公式计算;
(2)根据实验乙中的数据,可计算在温度为T2时的平衡常数,再结合三段式计算实验丙中达到平衡时NO2的转化率;
(3)分别计算甲、乙实验平衡常数,结合温度对平衡的影响分析判断。
【详解】
(1)二氧化硫在一定条件下发生反应:SO2(g)+NO2(g)⇌SO3(g)+NO (g)△H=-42kJ/mol,△H表示完全反应时候的焓变,实验甲中,若2min 时测得放出的热量是4.2kJ,表明各组分均反应了0.1mol,则SO2的物质的量改变量为△n=0.1mol,恒容密闭容器的体积V=1L,反应所经历的时间t=2min,因此以SO2表示的化学反应的平均速率为v====0.05mol/(L•min),故答案为:0.05mol/(L•min);
(2)根据实验乙中的数据,平衡时NO的物质的量为0.16mol,根据反应方程式:SO2(g)+NO2(g)⇌SO3(g)+NO (g),反应物均消耗了0.16mol,生成了SO3 0.16mol,则平衡时,c(SO2)==0.04mol/L,c(NO2)= =0.64mol/L,c(NO)= =0.16mol/L,c(SO3)= =0.16mol/L,该反应的平衡常数为K==1,温度不变,平衡常数不变,因此在实验丙中,K=1,起始时,c(SO2)=0.2mol/L,c(NO2)=0.3mol/L,设反应消耗了xmol/L,则平衡时,c(NO2)=(0.3-x)mol/L,c(SO2)=(0.2-x)mol/L,c(SO3)=c(NO)=cmol/L,则有K==1,解得:x=0.12mol/L,因此,平衡时,NO2的转化率=×100%=40%,故答案为:40%;
(3)实验甲中,若2min时测得放出的热量是4.2kJ,则消耗二氧化硫物质的量为0.1mol,平衡时NO为0.18mol,
T1温度下平衡常数K==2.613≈2.6;
根据(2)的计算乙实验中T2温度下的平衡常数K=1,该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,故T1<T2,故答案为:<;T1时,K≈2.6,T2时,K=1。
17.> 0.375 10%
【分析】
①根据反应正在建立得到正逆反应速率关系,再根据变化量得到速率。
②根据三段式建立关系,得到体积分数和压强平衡常数。
【详解】
①根据图示,反应进行到4 min 后,甲醇的物质的量继续增大,反应正向进行,υ(正) >υ(逆);0~4 min,甲醇的浓度变化为0.5 mol/L,H2的浓度变化为1.5mol/L,,故答案为:>;0.375。
②根据图示,15min 时达到平衡状态,CO2的平衡浓度为0.25mol/L,则
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
开始(mol/L) 1 3 0 0
转化(mol/L) 0.75 2.25 0.75 0.75
平衡(mol/L) 0.25 0.75 0.75 0.75
CO2平衡时的体积分数为10%;根据压强比等于气体物质的量比,平衡时的总压强为,,故答案为:10%;。
18.3L 0.15 50% acd
【分析】
图象信息告诉我们,H2的起始浓度为2mol/L,而H2的起始量为6mol,由此可求出容器的体积;反应进行10min后,达到化学平衡状态,此时H2与CH3OH的浓度都为0.5mol/L。
【详解】
(1)容器容积V==3L;答案为:3L;
(2)从反应开始到10min过程中,H2的平均反应速率υ(H2)==0.15 mol·L-1·min-1 ;答案为:0.15;
(3)10min后,H2的浓度变化量为1.5mol/L,则CO2的浓度变化量为0.5mol/L,CO2的平衡转化率是=50%;答案为:50%;
(4)a.甲醇的浓度不再发生变化,则表明正、逆反应速率相等,反应达平衡状态;
b.3 υ正(H2) =υ逆(甲醇),虽然表明反应进行的方向相反,但二者的速率之比不等于化学计量数之比,表明反应未达平衡状态;
c.因为反应前后气体的分子数不等,压强是一个变量,当容器内的压强不再发生变化时,反应达平衡状态;
d.因为CO2和H2的起始浓度之比不等于化学计量数之比,而变化量之比等于化学计量数之比,所以达平衡前,浓度之比始终发生改变,当浓度不再发生变化时,反应达平衡状态;
综合以上分析,acd符合题意,故选acd。答案为:acd。
【点睛】
当反应物的起始投入量之比等于化学计量数之比时,不管反应进行到什么程度,反应物的物质的量之比都是定值。
19.反应放热,体系的温度升高,反应速率加快 225 > 该反应是放热反应,甲容器温度高于乙容器,升高温度,平衡逆向移动,所以p甲>p乙 < 50% 0.10
【详解】
(1)① 0~3 s内,甲容器中NO2的反应速率增大的原因是: 甲为绝热容器,2NO2(g) ⇌N2O4,反应放热,体系的温度升高,对反应速率影响大于浓度降低的影响,反应速率加快。
② 甲达到平衡时,温度若为T ℃,
,此温度下的平衡常数。
③甲容器中温度升高,平衡逆向移动,气体的物质的量增大且温度更高,气体压强增大,则p甲>p乙。
④平衡逆向移动,平衡时,平衡常数减小,则K甲
相关试卷
这是一份2022届高三化学一轮复习化学反应原理题型必练36平衡移动及图像分析含解析,共19页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
这是一份2022届高三化学一轮复习化学反应原理题型必练23溶液PH的计算含解析,共18页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
这是一份2022届高三化学一轮复习化学反应原理题型必练13化学平衡常数的有关计算含解析,共30页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。









