
2022届高三化学一轮复习化学反应原理题型必练18与物质的百分含量有关图像的分析含解析
展开与物质的百分含量有关图像的分析
一、单选题(共18题)
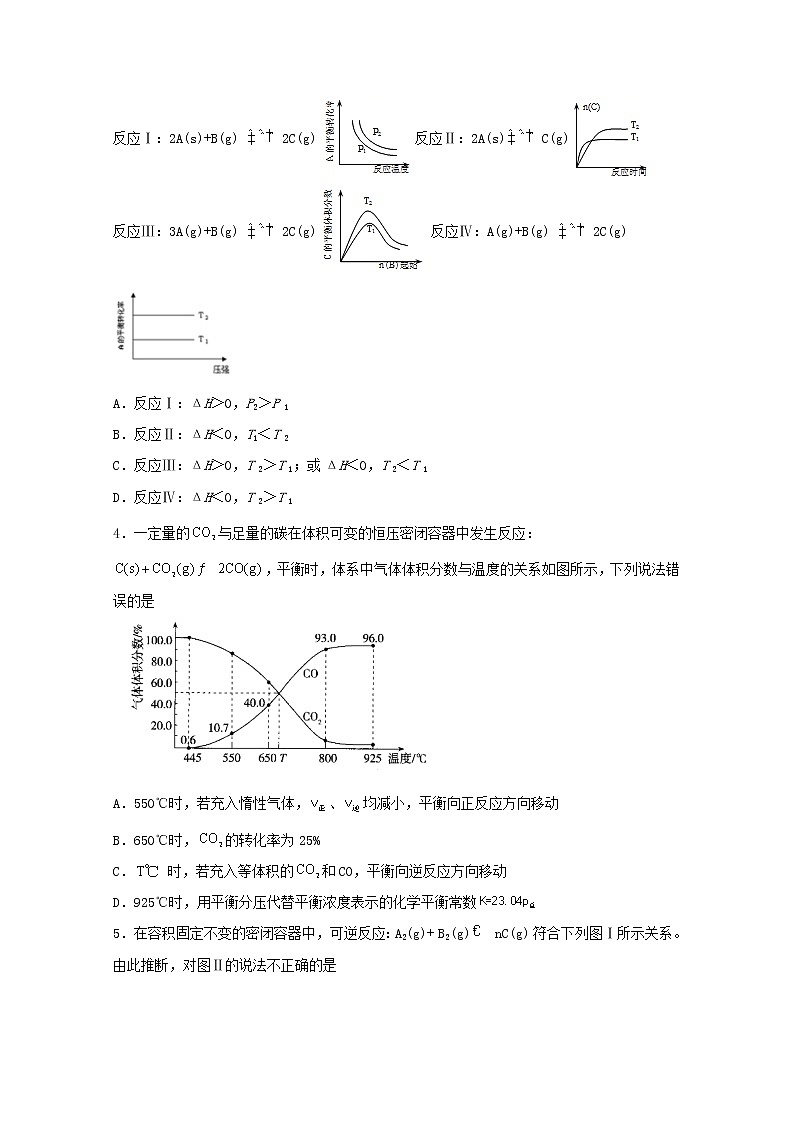
1.己知可逆反应aA+bB⇌cC中,A与C物质在混合物中的质量分数随温度T的变化曲线如图所示。下列说法中,正确的是
A.该反应在T1温度时正、逆反应速率相等
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
2.一定温度下,在容积为2 L的刚性容器中充入1 mol A(g)和2 mol B(g),发生反应A(g)+2B(g) C(g) ∆H<0,反应过程中测得容器内压强的变化如下图所示。下列说法错误的是
A.0~20 min内,B的平均反应速率为0.025 mol/(L∙min)
B.达到平衡时,A的转化率为50%
C.该温度下,反应的压强平衡常数Kp=4.0 MPa-2
D.在20 min时,向该容器中充入1 molC(g)达到新平衡,此时C的百分含量增大
3.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(p表示压强,T表示温度,n表示物质的量):根据以上规律判断,下列结论正确的是
反应Ⅰ:2A(s)+B(g) 2C(g)反应Ⅱ:2A(s)C(g)
反应Ⅲ:3A(g)+B(g) 2C(g)反应Ⅳ:A(g)+B(g) 2C(g)
A.反应Ⅰ:ΔH>0,P2>P 1
B.反应Ⅱ:ΔH<0,T1<T 2
C.反应Ⅲ:ΔH>0,T 2>T 1;或ΔH<0,T 2<T 1
D.反应Ⅳ:ΔH<0,T 2>T 1
4.一定量的与足量的碳在体积可变的恒压密闭容器中发生反应:,平衡时,体系中气体体积分数与温度的关系如图所示,下列说法错误的是
A.550℃时,若充入惰性气体,、均减小,平衡向正反应方向移动
B.650℃时,的转化率为25%
C. 时,若充入等体积的和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数
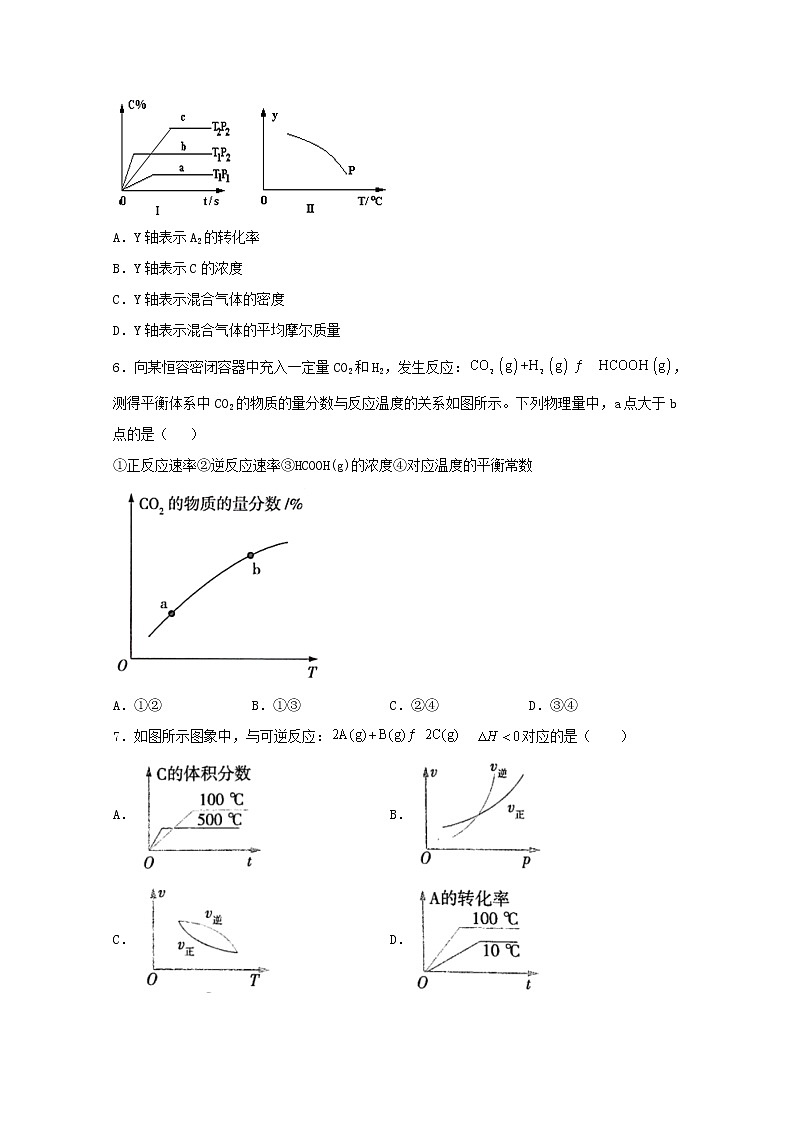
5.在容积固定不变的密闭容器中,可逆反应:A2(g)+ B2(g) nC(g) 符合下列图Ⅰ所示关系。由此推断,对图Ⅱ的说法不正确的是
A.Y轴表示A2的转化率
B.Y轴表示C的浓度
C.Y轴表示混合气体的密度
D.Y轴表示混合气体的平均摩尔质量
6.向某恒容密闭容器中充入一定量CO2和H2,发生反应:,测得平衡体系中CO2的物质的量分数与反应温度的关系如图所示。下列物理量中,a点大于b点的是( )
①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度的平衡常数
A.①② B.①③ C.②④ D.③④
7.如图所示图象中,与可逆反应: 对应的是( )
A. B.
C. D.
8.某化学科研小组研究在其他条件不变时,改变某一条件对反应的化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图象得出的结论正确的是( )
①正反应一定是放热反应
②达到平衡时的转化率大小为
③若,则正反应一定是吸热反应
④b点时,平衡体系中A、B原子数之比接近1:3
A.①② B.①③ C.②④ D.③④
9.如图表示外界条件(温度、压强)的变化对反应:的影响,则在图中Y表示( )
A.平衡混合气体中R的质量分数 B.平衡混合气体中G的体积分数
C.G的平衡转化率 D.L的平衡转化率
10.在某恒容的密闭容器中,可逆反应A(g)+B(g)⇌xC(g)有如图所示的关系曲线,下列说法正确的是
A.温度:T1>T2 B.压强:p1>p2
C.正反应是吸热反应 D.x的值是2
11.将Ce(SO4)2·4H2O(摩尔质量为404 g·mol-1)在空气中加热,样品的固体残留率(×100%)随温度的变化如下图所示。
当固体残留率为70.3%时,所得固体可能为
A.Ce(SO4)2 B.Ce2(SO4)3 C.CeOSO4 D.无法计算
12.已知某可逆反应mA(g)+nB(g)pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
A.T1>T2 P1<P2 m+n<p 吸热反应
B.T1<T2 P1<P2 m+n>p 放热反应
C.T1<T2 P1>P2 m+n>p 放热反应
D.T1>T2 P1<P2 m+n>p 吸热反应
13.在铂—铑合金网上发生反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。该反应是一个自发的反应且铂—铑合金网未预热也会发热,下列像图不正确的是
A. B.
C. D.
14.可逆反应aA(g)+bB(g)cC(g)+dD(s)ΔH=QkJ·mol-1,反应过程中,当其他条件不变时,化学平衡常数(K)与温度,C的百分含量与时间的关系如图所示。据图分析,以下说法错误的是
A.Q>0
B.增大压强,B的转化率增大
C.当反应达平衡时,混合气体的密度不再变化
D.p1>p2,a+b<c
15.反应2NO(g) + 2CO(g) N2(g) + 2CO2(g) ΔH<0可用于消除汽车尾气中的有害气体。在密闭容器中充入4 mol NO 和5 mol CO,平衡时NO的体积分数随温度、压强的变化关系如图。下列说法不正确的是
A.温度:T1>T2
B.a点达到平衡所需时间比c点短
C.c点NO的平衡转化率:50%
D.若在e点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中的c点
16.一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)。设起始=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示。下列说法正确的是
A.该反应的焓变ΔH<0
B.图中Z的大小为a<3
D.温度不变时,图中X点对应的平衡在加压后φ(CH4)减小
17.在某固定容积密闭容器中,发生可逆反应:A(g)+B(g) xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ说法中正确的是(T 表示温度,P 表示压强,C%表示 C 的体积分数) ( )
A.P3<P4,y 轴表示 C 的体积分数
B.P3<P4,y 轴表示混合气体的密度
C.P3>P4,y 轴表示 B 的百分含量
D.P3>P4,y 轴表示混合气体的平均摩尔质量
18.将1molM和2 molN置于体积为2L的恒容密闭容器中,发生反应:M(s)+2N(g)P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
A.若X、Y两点的平衡常数分别为K1、K2,则K1<K2
B.温度为T1时,N的平衡转化率为80%,平衡常数K=4.0
C.无论T1还是T2,当容器中混合气体平均摩尔质量和压强不变时,反应达平衡状态
D.降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
二、填空题(共5题)
19.二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
图中,表示C2H4、CO2变化的曲线分别是___、___。CO2催化加氢合成C2H4反应的ΔH___0(填“大于”或“小于”)。
(2)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=___(MPa)−3(列出计算式。以分压表示,分压=总压×物质的量分数)。
20.反应为CO(g)+2H2(g)⇌CH3OH(g) ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________。
②X轴上a点的数值比b点________(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是____________________________________________。
21.用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO 和 NO2 不同配比混合气通入尿素溶液中,总氮还原率与配比关系如下图。
(1)用尿素[(NH2)2CO]水溶液吸收体积比为 1∶1 的 NO 和 NO2 混合气,可将 N 元素转变为对环境无害的气体。写出该反应的化学方程式___________________。
(2)随着 NO 和 NO2 配比的提高,总氮还原率降低的主要原因是__________________。
22.已知N2(g)+3H2(g)2NH3(g) △H<0,平衡时NH3的体积分数φ(NH3)与氢氮比x(H2与N2的物质的量比)的关系如图:
①T1____T2(填“>”、“=”或“<”)。
②a点总压为50MPa,T2时Kp=_______(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
23.Ⅰ.工业上利用H2和CO2合成二甲醚的反应如下:6H2g+2CO2g⇌CH3OCH3g+3H2Og ΔH<0。
温度升高,该化学平衡移动后达到新的平衡,CH3OCH3的产率将__________(填“变大”“变小”或“不变”,下同),混合气体的平均相对分子质量将__________。
Ⅱ.某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2g+O2⇌2N2O5g ΔH<0的影响。
(1)图中T1和T2的关系是T1________(填“>”“<”或“=”)T2。
(2)比较a、b、c三点所处的平衡状态中,反应物NO2的转化率最大的是__________(填字母)。
(3)若容器体积为1L,n=1mol,NO2的转化率为50%,则此条件下T2,反应的平衡常数K=___________。
参考答案
1.B
【详解】
略
2.C
【详解】
A.0~20 min内,,,则y=0.5,B的平均反应速率为,故A正确;
B.达到平衡时,A的转化率为,故B正确;
C.该温度下,反应的压强平衡常数,故C错误;
D.在20 min时,向该容器中充入1 molC(g)达到新平衡,相当于在另外的容器中充入1molC,达到平衡与原容器相同,将两个容器压缩到一个容器中,平衡正向移动,因此C的百分含量增大,故D正确。
综上所述,答案为C。
3.C
【详解】
A.反应Ⅰ,由图象可知,升高温度A的转化率降低,说明升高温度平衡向逆反应方向移动,则正反应放热,ΔH<0;由方程式中气体的计量数关系可知增大压强平衡向逆反应方向移动,A的转化率减小,则P2<P 1,A项错误;
B.反应Ⅱ,由到达平衡所用时间可知T1>T 2,升高温度C的物质的量减小,说明平衡向逆反应方向移动,则正反应放热,ΔH<0,B项错误;
C.反应Ⅲ,若ΔH>0,反应吸热,升高温度平衡向正反应方向移动,C的体积分数增大,T 2>T1;若ΔH<0,反应放热,升高温度平衡向逆反应方向移动,C的体积分数减小,T 2<T 1,C项正确;
D.反应Ⅳ,若ΔH<0,则升高温度平衡向逆反应方向移动,A的平衡转化率减小,则T 2<T1,D项错误。
故选C。
4.C
【详解】
A.体积可变的恒压密闭容器,550℃时,若充入惰性气体,容器体积增大,反应物、生成物浓度减小,、均减小,各气体分压强减小,相当于减压,平衡向正反应方向移动,故A正确;
B.设初始CO2的物质的量是amol,反应消耗CO2的物质的量为xmol,生成CO的物质的量是2xmol,650℃时,CO的体积分数是40%,,x=0.25a,的转化率为25%,故B正确;
C. T℃时,反应达平衡后CO和CO2的体积分数都为50%为平衡状态,所以充入等体积的和CO,平衡不移动,故C错误;
D.925℃时,CO的体积分数为96%,则CO2的体积分数都为4%,所以用平衡分压代替平衡浓度表示的化学平衡常数Kp=,故D正确;
选C。
5.C
【分析】
由图Ⅰ可知,温度为T1时,根据到达平衡的时间可知P2>P1,且压强越大,C的含量越高,说明平衡向正反应方向移动,正反应为气体体积减小的反应;压强为P2时,根据到达平衡的时间可知T1>T2,且温度越高,C的含量越低,说明平衡向逆反应方向移动,则正反应为放热反应;
由图Ⅱ可知,y随温度的升高而降低,结合温度对平衡移动的影响判断y表示的物理量。
【详解】
A.该反应正反应是放热反应,升高温度平衡向逆反应方向移动,A2的转化率降低,图象与实际相符,故A正确;
B.该反应正反应是放热反应,升高温度平衡向逆反应方向移动,C的浓度降低,图象与实际相符,故B正确;
C.混合气体的总质量不变,容器的体积不变,密度始终不变,图象与实际不相符,故C错误;
D.该反应正反应是放热反应,升高温度平衡向逆反应方向移动,总的物质的量增大,混合气体的总质量不变,混合气的平均摩尔质量减小,图象与实际相符,故D正确;
故选C。
6.D
【详解】
温度升高,反应速率增大,a点的正、逆反应速率都小于b点的正、逆反应速率,①②错误;温度升高,平衡体系中的物质的量分数增大,说明平衡逆向移动,正反应为放热反应;的浓度和对应温度时的平衡常数都将减小,即a点时的浓度和对应温度的平衡常数都大于b点,③④正确,答案选D。
7.A
【详解】
A.因,升高温度平衡逆向移动,C的体积分数减小,A图像与题意相符;
B.增大压强,平衡正向移动,,B图像与题意不相符;
C.升高温度,正、逆反应速率都增大,C图像与题意不相符;
D.因,升高温度平衡逆向移动,A的转化率减小,D图像与题意不相符。
答案选A。
8.D
【详解】
①根据反应和图像分析可知:由于与的大小不确定,所以不能确定该可逆反应的正反应是吸热反应还是放热反应,若,温度升高,平衡体系中的体积分数增大,则正反应是吸热反应;若,降低温度,平衡体系中的体积分数增大,则正反应是放热反应,故①错误,③正确。
②由图像可知a→b→c过程中B2的初始物质的量逐渐增大,根据勒夏特列原理,平衡向正反应方向移动,因A2的初始量不变,所以A2的转化率逐渐增大,即a
综合上述分析可知③④符合题意。故答案:D。
9.B
【详解】
A.正反应吸热,升高温度平衡向正反应方向进行,则平衡混合气中R的质量分数增大,选项A不符合;
B.正反应吸热,升高温度平衡向正反应方向进行,则平衡混合气体中G的体积分数减小,又因为正反应体积增大,增大压强,平衡混合气体中G的体积分数增大,选项B符合;
C.正反应吸热,升高温度平衡向正反应方向进行,则G的转化率增大,选项C不符合;
D.正反应吸热,升高温度平衡向正反应方向进行,则L的转化率增大,选项D不符合;
答案选B。
10.A
【分析】
根据“先拐先平数值大”知p1、p2及T1、T2的相对大小,升高温度,平衡向吸热反应方向移动,增大压强,平衡向气体体积减小的方向移动,根据压强改变、温度改变时C含量的变化确定x值、反应热,据此分析解答.
【详解】
A.温度越高反应速率越快,则反应到达平衡的时间越短,结合曲线Ⅰ和Ⅱ并根据“先拐先平数值大”知T1>T2,故A正确;
B.压强越大,反应速率越快,则反应到达平衡的时间越短,结合曲线Ⅱ和Ⅲ并根据“先拐先平数值大”知p1<p2,故B错误;
C.相同压强下,升高温度,C的含量减少,由曲线Ⅰ和Ⅱ说明升高温度平衡向逆反应方向移动,则正反应是放热反应,故C错误;
D.相同温度下,增大压强,C的含量增大,由曲线Ⅱ和Ⅲ说明增大压强平衡向正反应方向移动,则x=1,故D错误;
故答案为A。
11.B
【详解】
将Ce(SO4)2•4H2O(摩尔质量为404g/mol)在空气中加热分解;
A.若为Ce(SO4)2,原子守恒计算固体残留率=×100%=82.2%,
B.若为Ce2(SO4)3,原子守恒计算固体残留率=×100%=70.3%,
C.若为CeOSO4,原子守恒计算固体残留率=×100%=62.4%,
所以当固体残留率为70.3%时,所得固体为Ce2(SO4)3,故B正确;答案为B。
12.A
【详解】
由T1P2、T2P2图像可知,在压强不变时,升高温度,反应速率加快,到达平衡所用时间越短,故T1>T2,选项B、C错误;升高温度,反应物B在混合气体中的体积分数越小,说明该反应的正反应为吸热反应;由T1P1、T1P2图像可知,当温度相同时,增大压强,化学反应速率越快,到达平衡所用时间越短,则P1<P2;根据平衡移动原理:增大压强,化学平衡向气体体积减小的方向移动,而根据图象可知:增大压强,反应物B在混合气体中的体积分数越大,说明逆反应为气体体积减小的反应,则该反应正反应是气体体积增大的反应,故m+n<p,选项D错误,选项A正确;故合理选项是A。
13.D
【详解】
A. 4NH3(g)+5O2(g) 4NO(g)+6H2O(g)正反应气体物质的量增大,增大压强,反应速率加快,平衡逆向移动,NH3转化率降低,故A正确;
B.催化剂能加快反应速率,不能使平衡移动,NH3转化率不变,故B正确;
C. 4NH3(g)+5O2(g) 4NO(g)+6H2O(g)正反应气体物质的量增大,增大压强,反应速率加快,平衡逆向移动,NO产率降低,故C正确;
D. 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) 正反应放热,升高温度,平衡逆向移动,H2O产率降低,故D错误;
选D。
【点睛】
本题考查温度、压强对化学反应速率、化学平衡移动的影响,明确升高温度平衡向吸热方向移动,增大压强平衡向气体系数和减小的方向移动。
14.B
【详解】
A.由图可知,随着温度升高,平衡常数逐渐增大,说明平衡向正向移动,因此正向为吸热反应,Q>0,故A不符合题意;
B.根据“先拐先平”可知,p1>p2,增大压强,C的百分含量减小,说明平衡逆向移动,因此增大压强B的转化率将减小,故B符合题意;
C.该反应中D为固体,因此在反应未达到平衡状态时,气体的总质量会发生变化,当反应达到平衡状态时,气体总质量不变,气体体积不变,混合气体的密度不再变化,故C不符合题意;
D.由B可知,p1>p2,增大压强,平衡逆向移动,增大压强,平衡向气体体积减小的方向移动,因此a+b<c,故D不符合题意;
故答案为:B。
【点睛】
判断化学平衡状态的方法:各种“量”不变:①各物质的质量、物质的量或浓度不变;②各物质的百分含量、物质的量分数、质量分数等不变(反应中存在至少两种相同状态的物质);③温度(绝热体系)、压强(化学反应方程式两边气体体积不相等且恒容装置中进行)或颜色(某组分有颜色)不变;总之,若物理量由变量变成了不变量,则表明该可逆反应达到平衡状态;若物理量始终为“不变量”,则不能作为平衡标志。
15.D
【详解】
A.由图可知,相同压强下,T1温度时NO的体积分数更大,说明T1温度下,反应向右进行的程度更小;由于该反应为放热反应,所以温度越低,越有利于反应正向进行,所以T1>T2;A项正确;
B.一般,温度越高,反应速率越大,达到平衡所需的时间会越短,所以a点达到平衡所需的时间比c点短;B项正确;
C.c点对应的平衡状态,NO的体积分数为25%,所以列三段式:
,所以有:,解得x=2,那么NO的平衡转化率即:50%,C项正确;
D.由图可知,e点对应的NO的体积分数与c点对应的相同;结合反应可知,升温会使反应逆向移动,导致NO的体积分数会增加,减压也会使反应逆向移动,导致NO的体积分数增加;所以升温和减压后,NO的体积分数必然增加,达到平衡状态时,NO的体积分数一定比c点对应的体积分数大,D项错误;
答案选D。
【点睛】
分析恒温线或恒压线的图像时,可采用“控制变量,定一议二”的方法;若反应的焓变已知,方程式也明确给出,那么可以根据恒温线和恒压线的图像结合反应特点,判断温度或压强的大小关系;反之,若图中明确了温度或压强的大小关系,则结合图像可分析反应的特点。
16.B
【分析】
由图象可知升高温度,甲烷的体积分数减小,说明升高温度平衡正向移动,则正反应为吸热反应,起始=Z,Z越小,说明加入甲烷的物质的量相对水来说越多,含量越大,以此解答该题。
【详解】
A. 升高温度,甲烷的体积分数减小,说明升高温度平衡正向移动,则该反应的焓变△H>0,故A错误;
B. 起始=Z,Z越小,说明甲烷相对越多,达到平衡时甲烷的含量越多,则Z的大小为b>3>a,故B正确;
C. 起始=3,水和甲烷按1:1反应,达到平衡时,二者比值不等于3,故C错误;
D. 增大压强,平衡逆向移动,所以平衡在加压后φ(CH4)增大,故D错误。
故答案选:B。
17.D
【分析】
由图Ⅰ可知,压强为P2时,温度T1先到达平衡,故温度T1>T2,且温度越高,平衡时C的体积分数越低,故升高温度平衡向逆反应移动,正反应为放热反应;温度为T1时,压强P2先到达平衡,故压强P2>P1,且压强越大,平衡时C的质量分数越高,故增大压强平衡向正反应移动,正反应为体积减小的反应,故x=1。
【详解】
A. P3<P4,在相同温度下由P3到P4,增大压强平衡向正反应方向移动,则C的含量增大,体积分数增大。同时升高温度平衡向逆反应方向移动,C的含量减小,图象与实际不符合,故A错误;
B. 密度=质量÷体积,混合气体的质量和体积都不变,密度不变,故B错误;
C. P3>P4,由P4到P3,增大压强,在相同温度下平衡向正反应移动,B的百分含量减小。温度升高平衡向逆反应移动,B的体积分数增大,图象与实际不符,故C错误;
D. P3>P4,由P4到P3,增大压强,平衡向正反应移动,混合气体总的物质的量减小,混合气体的总质量不变,平均摩尔质量增大。温度升高平衡向逆反应移动,混合气体总的物质的量增大,平均相对分子质量减小,图象与实际相符,故D正确。
正确答案是D。
【点睛】
本题考查化学平衡图象、化学平衡的影响因素等,注意根据图(1)分析反应的特征是解题的关键。化学平衡图像题的解题技巧:①紧扣特征,弄清可逆反应的正反应是吸热还是放热,体积增大、减小还是不变,有无固体、纯液体物质参与反应等。②先拐先平,在含量(转化率)—时间曲线中,先出现拐点的则先达到平衡,说明该曲线反应速率快,表示温度较高、有催化剂、压强较大等。③定一议二,当图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系,有时还需要作辅助线。④三步分析法,一看反应速率是增大还是减小;二看v正、v逆的相对大小;三看化学平衡移动的方向。
18.B
【分析】
A. 先拐先平衡,数据大,由图象可知T2>T1,温度升高,P的体积分数减小,平衡逆向移动,正向为放热反应;
B. 依据三段式和平衡时P的体积分数为40%,计算N的平衡转化率和平衡常数;
C. 该反应为气体分子数不变的反应;
D. 降低温度,平衡向着放热的方向移动,增大压强,平衡向着体积缩小的方向移动,减小生成物的浓度,平衡正向移动。
【详解】
A. 由图象可知T2>T1,温度升高,P的体积分数减小,平衡逆向移动,正向为放热反应,温度升高,放热反应的平衡常数K减小,因此K1>K2,A项错误;
B. 温度为T1时,平衡时P的体积分数为40%,设起始到平衡转化P的浓度为xmol/L,
M(s) + 2N(g) P(g) + Q(g)
始(mol/L) 1 0 0
转(mol/L) 2x x x
平(mol/L) 1-2x x x
则=40%,解得x=0.4,N的平衡转化率为×100%=80%,
平衡常数K===4.0,B项正确;
C. 该反应为气体分子数不变的反应,容器中压强不变时,不能说明反应达到平衡状态,C项错误;
D. 降低温度,平衡向着放热的方向移动,即平衡正向移动,有利于提高反应物的平衡转化率;该反应为气体分子数不变的反应,增大压强,平衡不移动,无法提高反应物的平衡转化率;减小生成物的浓度,平衡正向移动,有利于提高反应物的平衡转化率,D项错误;
答案选B。
19.d c 小于 或
【详解】
(1)由题中信息可知,两反应物的初始投料之比等于化学计量数之比,由图中曲线的起点坐标可知,c和a所表示的物质的物质的量分数之比为1:3,d和b表示的物质的物质的量分数之比为1:4,则结合化学计量数之比可以判断,表示乙烯变化的曲线是d,表示二氧化碳变化曲线的是c;由图中曲线的变化趋势可知,升高温度,乙烯的物质的量分数减小,则化学平衡向逆反应方向移动,则该反应为放热反应,∆H小于0;
(2)原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1Mpa建立平衡。由A点坐标可知,该温度下,氢气和水的物质的量分数均为0.39,则乙烯的物质的量分数为水的四分之一,即,二氧化碳的物质的量分数为氢气的三分之一,即,因此,该温度下反应的平衡常数K=或(MPa)−3。
20.25% 小 随着Y值的增大,c(CH3OH)减小,平衡CO(g)+2H2(g)⇌CH3OH(g)向逆反应方向进行,故Y为温度
【详解】
①设反应中消耗xmolCO,由题意建立如下三段式:
由M点CH3OH的体积分数为10%可得关系式:×100%=10%,解得x=0.25,则α(CO)=×100%=25%;
②由图可知,X轴上,从a到b点数值逐渐增大,则a点的数值比b点小;该反应为气态物质分子数减小的放热反应,增大压强,φ(CH3OH)增大,升高温度,φ(CH3OH)减小;随着Y值的增大,c(CH3OH)减小,平衡CO(g)+2H2(g)⇌CH3OH(g)向逆反应方向进行,故Y轴表示温度,X轴代表压强。
21.NO+NO2+(NH2)2CO==2N2+CO2+2H2O NO难溶于水,难以与尿素接触反应
【分析】
从图中可以看出,当NO 和 NO2 的体积比在0.5与1之间时,由于相同体积的混合气体消耗尿素的量不断减少,所以气体被还原的越来越充分,总氮还原率不断提高;当NO 和 NO2 的体积比在1与4之间时,虽然相同体积的混合气体消耗尿素的量不断减少,但由于混合气在尿素水溶液中的溶解量不断减少,反应进行的程度反而减小,所以总氮还原率不断降低。
【详解】
(1)用尿素[(NH2)2CO]水溶液吸收体积比为 1∶1 的 NO 和 NO2 混合气,N 元素转变为N2,同时生成CO2和水,该反应的化学方程式为NO+NO2+(NH2)2CO==2N2+CO2+2H2O。答案为:NO+NO2+(NH2)2CO==2N2+CO2+2H2O;
(2)随着 NO 和 NO2 配比的提高,NO的含量不断增大,在尿素水溶液中的溶解量不断减少,所以总氮还原率不断降低,从而得出其主要原因是NO难溶于水,难以与尿素接触反应。答案为:NO难溶于水,难以与尿素接触反应。
【点睛】
气体与溶液发生反应前,应与溶液充分接触,否则反应难以顺利进行。
22.>
【分析】
①根据温度影响平衡移动,得出答案。
②根据题意得到氨气、氮气、氢气体积分数,再得到它们的压强,再根据压强平衡常数进行计算。
【详解】
①该反应是放热反应,当升高温度时,平衡向逆向移动,氨气的体积分数减小,故可知T1>T2;
②由题意可知,a点总压为50MPa,平衡时氢气与氮气之比为3:1,氨气的体积分数为0.2,则氮气的体积分数为0.2,氢气的体积分数为0.6,氨气的体积分数为0.2,平衡时氮气分压为10MPa,氢气分压为30MPa,氨气分压为10MPa,T2时,故答案为。
23.变小 变小 > c 0.125
【解析】
【分析】
本题主要考查平衡移动以及化学反应图像。
Ⅰ.温度升高,化学平衡逆反应方向移动,CH3OCH3的产率变小;逆反应方向气体分子数增加,即气体的物质的量增加,气体质量不变,混合气体的平均相对分子质量将变小。
Ⅱ.(1)图像中T1→T2时N2O5%增加,平衡向放热的正反应方向移动,应为降温。
(2)O2越多,NO2的转化率越大。
(3)b点时N2O5的百分含量最大,则此点通入O2、NO2的物质的量之比与化学方程式的计量数相等,即通入4 mol NO2,列三段式计算平衡常数。
【详解】
I.该反应正向为放热反应,升高温度,平衡逆向移动,CH3OCH3的产率变小;逆反应方向气体分子数增加,即气体的物质的量增加,气体质量不变,混合气体的平均相对分子质量将变小。
II.(1)该反应正向为放热反应,T1→T2时N2O5%增加,平衡向放热的正反应方向移动,应为降温。
(2)增加氧气的物质的量,平衡将正向移动,反应物NO2的转化率将会上升,故c点时NO2转化率最大。
(3)b点时N2O5的百分含量最大,则此点通入O2、NO2的物质的量之比与化学方程式的计量数相等,即通入4 mol NO2;
由反应4NO2g+O2g⇌2N2O5g
起始(mol/L) 4 1 0
转化(mol/L) 4x x 2x
平衡(mol/L)4-4x 1-x 2x
由4x4=0.5解得x=0.5,故平衡常数K=1224•0.5=0.125。
【点睛】
当反应物投料比按照反应物计量数之比投料时,生成物的体积分数存在最大值,但生成物的物质的量不一定最大。
2022届高三化学一轮复习化学反应原理题型必练36平衡移动及图像分析含解析: 这是一份2022届高三化学一轮复习化学反应原理题型必练36平衡移动及图像分析含解析,共19页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
2022届高三化学一轮复习化学反应原理题型必练18与物质的百分含量有关图像的分析含解析: 这是一份2022届高三化学一轮复习化学反应原理题型必练18与物质的百分含量有关图像的分析含解析,共21页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
2022届高三化学一轮复习化学反应原理题型必练17与转化率有关图像的分析含解析: 这是一份2022届高三化学一轮复习化学反应原理题型必练17与转化率有关图像的分析含解析,共17页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。












