






人教版中考化学一轮复习课件物质的检验、提纯和推断
展开一、物质的检验1.类型物质的检验包括两个方面的内容:物质的鉴定和物质的鉴别。(1)物质的鉴定。根据物质特有的性质确定是否为该物质。
(2)物质的鉴别。根据物质性质的差异,将物质一一区分开来。①物理方法:根据组内物质的物理性质的差异进行鉴别。例如,Na2SO4溶液和CuSO4溶液(颜色);CO2和NH3(气味);浓硫酸和浓盐酸(挥发性)等。②化学方法:利用组内各物质化学性质的差异进行鉴别,即依据物质间反应时所产生的特殊的现象,如变色、产生气泡、生成沉淀等。
③物质鉴别的思路。对于不用试剂的鉴别题要从被鉴别物质的物理性质(如颜色、气味)寻找突破口,从而鉴别出一种试剂,然后再用这种试剂与其他物质间的两两反应出现的不同现象去鉴别其他试剂。④解题方法:先取样,再操作,观现象,得结论。
2.原则物质检验的原则为:方法力求简单、试剂消耗要少、现象直观明显、防止干扰。3.步骤物质检验的一般步骤为:先用物理方法、后用化学方法。
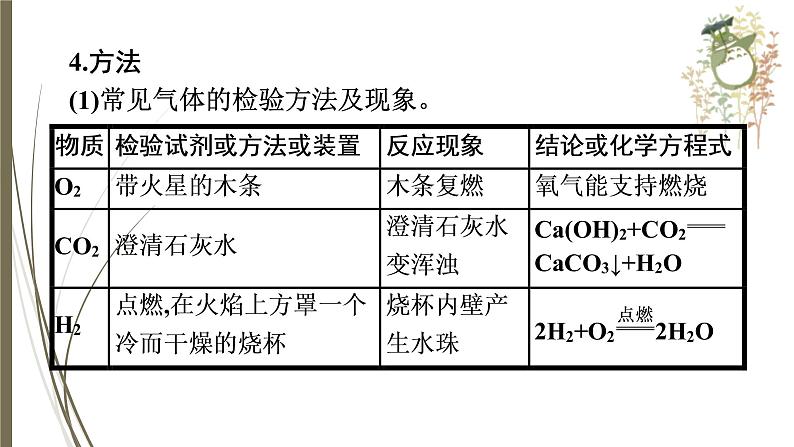
4.方法(1)常见气体的检验方法及现象。
(2)常见离子的检验方法及现象。
注意可溶性碱是常用的试剂。如Ba(OH)2溶液中的OH-能使阳离子Fe3+、Cu2+、Mg2+产生不同颜色的沉淀,并能使
别、鉴定、推断中成为较为理想的试剂。碳酸盐和酸反应产生气体这一特性也常是推断的“关键”。
(3)日常生活中物质的特定检验方法。①棉织品、毛织品、化纤织品的鉴别,分别燃烧会产生不同现象:棉织品燃烧产生棉花燃烧的气味,没有熔珠;毛织品燃烧产生与毛发燃烧相同的气味,没有熔珠;化纤织品燃烧产生与石油燃烧相同的气味,燃烧处有熔珠。②硬水、软水的鉴别:用肥皂水鉴别。③化肥的鉴别:磷肥呈灰白色,铵态氮肥有氨味。
二、物质的推断1.原理根据已知实验现象或物质间的转化关系进行分析推理。2.突破口物质推断的常见突破口为:沉淀、气体、特征颜色、特征反应等。3.主要类型(1)涉及物质鉴定的推断;(2)涉及物质鉴别的推断;(3)涉及物质分离、提纯的推断。
4.常见题型(1)文字叙述题;(2)两两组合实验题;(3)迷宫(或几何图形)转化题;(4)综合实验装置图形题;(5)实验推断结论评价题。
注意突破口的选择:①颜色特征。
6.物质推断的一般方法(1)一点击破,顺逆推断。抓住“突破口”,直接得出结论,然后用顺向、逆向或两边向中间推断,逐一导出其他结论。(2)相遇组合,对比推断。采用类似数学中的“相遇”方法用图中列出的各物质反应次数,再由各物质的性质及反应规律列出各物质反应次数,然后对号入座推断出各物质。(3)提出假设,讨论推断。在分析题目所给条件的基础上,提出假设后进行反复验证,逐步缩小范围,排除不合题意的结论。
三、物质的分离和提纯1.分离:物质的分离是指运用合适的化学或物理方法把混合物里的几种物质分开,得到各种成分的纯净物质的过程。2.提纯:物质的提纯是指运用合适的化学或物理方法把某物质中含有的少量杂质除去而得到纯净物质的过程。
3.方法:物质的分离和提纯的原理是根据混合物中各物质的物理性质或化学性质的不同进行分离或提纯。(1)物理方法。①过滤法:适用于液体和不溶于液体的固体的分离及可溶性固体和不溶性固体的分离,如粗盐的提纯。②结晶法:适用于溶解度受温度影响有明显差异的两种可溶性固体的分离,如KNO3和NaCl的分离。
(2)化学方法。①生成沉淀法:将混合物中某种成分与某一试剂反应生成沉淀而分离出来。②生成气体法:利用混合物中某种成分与某一试剂反应生成气体而分离出来。③转化法:将杂质用化学试剂转化为待提纯物。(3)分离和提纯的区别。分离:将混合物中各物质分开,要保留其中各种物质,且要恢复到原来的状态。提纯:需加入试剂除去杂质,被提纯物质必须恢复原状态且不能引入新杂质。
4.注意:(1)分离提纯的方法中优先考虑物理方法,如过滤、蒸发、结晶等。(2)所选试剂或方法能将杂质除尽,不能带进新的杂质。(3)分离提纯过程中,被提纯的物质已转化为其他物质,分离后应将其复原回来。
【例1】 下列各组溶液,不用其他试剂无法鉴别的是( )A.H2SO4 NaCl Na2CO3 CaCl2B.HCl NaOH CuSO4 MgSO4C.Na2CO3 K2SO4 BaCl2 HClD.NaNO3 HCl CaCl2 KOH
解析:碳酸钠能够与硫酸反应产生二氧化碳气体,与氯化钙反应产生碳酸钙沉淀,因此四种物质两两混合,既能够产生沉淀又能够产生气体的是碳酸钠,能够与碳酸钠反应产生气体的是硫酸,与碳酸钠反应产生沉淀的是氯化钙,剩下的是氯化钠,故A可以鉴别;根据物质的颜色,首先鉴别出硫酸铜,然后将硫酸铜与其他三种物质混合,能产生蓝色沉淀的是氢氧化钠,然后将氢氧化钠和剩下的两种溶液混合,能够产生白色沉淀的是硫酸镁,无明显现象的是盐酸,故B可以鉴别;
氯化钡与硫酸钾、碳酸钠反应均能产生沉淀,故能与两种物质产生沉淀的是氯化钡,不与氯化钡反应的物质为盐酸,向其他两种物质中滴加盐酸,有气体生成的为碳酸钠,无现象的为硫酸钾,故C可以鉴别;四种物质两两混合均没有明显现象,因此D不能鉴别。答案:D
【例2】 下列框图中的物质均为中学化学常见物质,其中A是大理石的主要成分,B是黑色粉末,H是蓝色沉淀。如图是它们之间的转化关系,请回答:(1)写出下列物质的化学式:B ,C ; (2)写出F+G→H的化学方程式: ; (3)写出物质E的一种用途: 。
解析:根据A是大理石的主要成分可知,A是碳酸钙,A在高温下又会生成C和D,D能够与水反应产生E,E能够与碳酸钠溶液反应,所以C是二氧化碳,D是氧化钙,氧化钙与水反应生成氢氧化钙,E就是氢氧化钙,氢氧化钙与碳酸钠生成碳酸钙沉淀和氢氧化钠;B是黑色粉末,H是蓝色沉淀,因此H是氢氧化铜,B是氧化铜,氧化铜与硫酸反应产生硫酸铜和水,硫酸铜与F反应产生氢氧化铜沉淀,因此F是氢氧化钠溶液。答案:(1)CuO CO2(2)2NaOH+CuSO4══Cu(OH)2↓+Na2SO4(3)改良酸性土壤等(合理即可)
【例3】 下列除去杂质的方法中正确的是( )
解析:本题考查应用物质性质除杂的内容。解答本题的关键应明确两点:(1)题中所涉及物质的基本性质;(2)所选试剂只能与杂质反应,与主体物质不反应,且不能引入新的杂质。A中,碳酸钙只与盐酸反应,且能生成氯化钙,同时碳酸钙不溶于水,反应完成后过滤即可得到纯净的CaCl2溶液,故A正确;B中,盐酸不与KCl反应而能与主体物质KOH反应,故B不正确;C中,硝酸钙与碳酸钠反应能除去氯化钠中的碳酸钠,但又生成了新杂质硝酸钠,故C不正确;D中,CO能与氧化铜反应被除去,但又生成CO2杂质,另外在有氧气的情况下,CO受热易发生危险,且氧气还能与生成的灼热的铜反应,故D不正确。答案:A
中考化学一轮复习课件14专题十四 物质的检验与提纯 (含答案): 这是一份中考化学一轮复习课件14专题十四 物质的检验与提纯 (含答案),共60页。
中考化学一轮复习精讲课件专题17 物质的检验与鉴别、分离与提纯 (含详解): 这是一份中考化学一轮复习精讲课件专题17 物质的检验与鉴别、分离与提纯 (含详解),共19页。PPT课件主要包含了聚焦中考复习目标,复习目标,聚焦中考命题解读,命题解读,聚焦中考考点梳理,SO2,紫色石蕊试液,无色酚酞试液,物质的检验方法,带火星的木条等内容,欢迎下载使用。
初中化学中考复习 14专题十四 物质的检验与提纯 课件 2021年中考化学(全国)一轮复习: 这是一份初中化学中考复习 14专题十四 物质的检验与提纯 课件 2021年中考化学(全国)一轮复习,共60页。












