
所属成套资源:高中化学课时学案人教版必修第一册
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应第2课时学案
展开
这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应第2课时学案,共12页。学案主要包含了氧化剂和还原剂,常见的氧化剂和还原剂,氧化性和还原性等内容,欢迎下载使用。
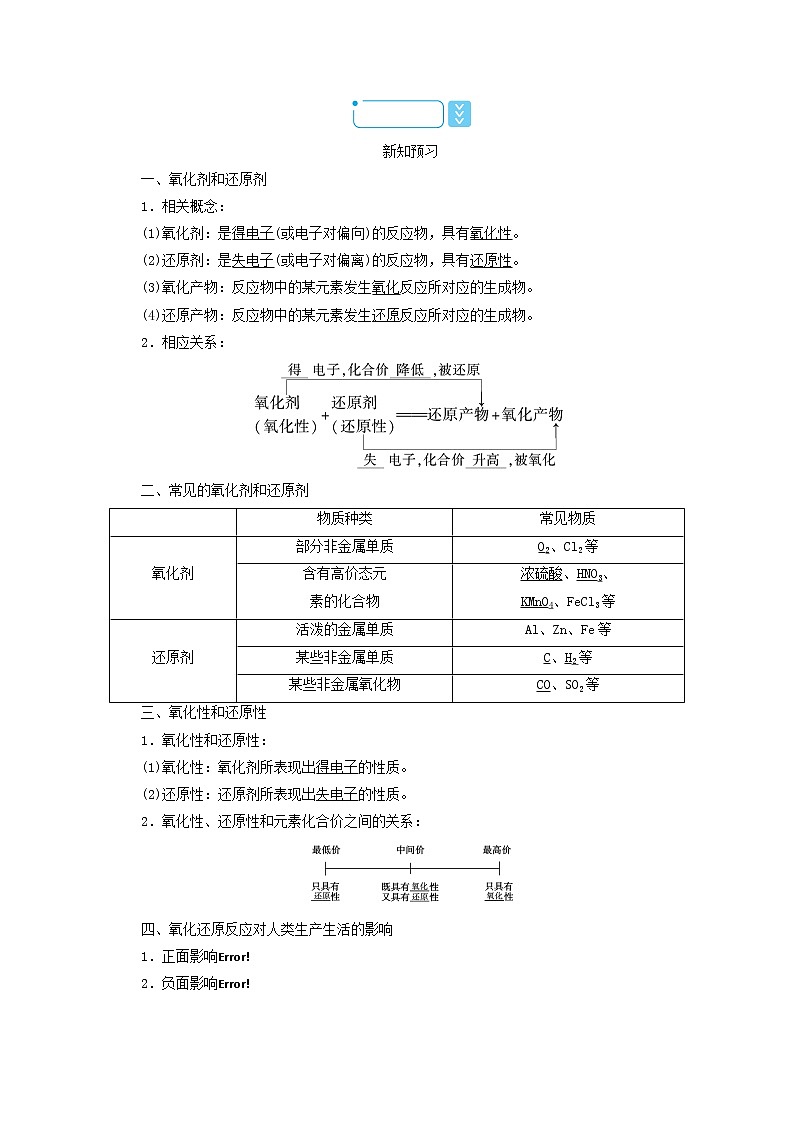
第2课时 氧化剂和还原剂学习目标核心素养1.会判断常见的氧化剂和还原剂,会比较物质氧化性和还原性的强弱。2.认识氧化还原反应的实际应用。1.通过对“氧化剂和还原剂”的学习,培养证据推理与模型认知能力。2.通过对“氧化还原反应的实际应用”的学习,培养科学态度和社会责任感。新课情境呈现在这些反应中各物质的作用是什么,让我们一起学习氧化剂和还原剂。课前素能奠基知识回顾 1.氧化还原反应的特征是反应前后有元素的化合价发生变化。实质是电子得失或共用电子对的偏移。2.四种基本反应类型中,置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;化合反应和分解反应可能是氧化还原反应。3.在反应MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O中,氧化产物是Cl2,还原产物是MnCl2。4.O2、Cl2在参与一些反应时的共同之处是易得电子、被还原,Fe、Cu的共同之处是易失电子、被氧化。新知预习 一、氧化剂和还原剂1.相关概念:(1)氧化剂:是得电子(或电子对偏向)的反应物,具有氧化性。(2)还原剂:是失电子(或电子对偏离)的反应物,具有还原性。(3)氧化产物:反应物中的某元素发生氧化反应所对应的生成物。(4)还原产物:反应物中的某元素发生还原反应所对应的生成物。2.相应关系:二、常见的氧化剂和还原剂 物质种类常见物质氧化剂部分非金属单质O2、Cl2等含有高价态元素的化合物浓硫酸、HNO3、KMnO4、FeCl3等还原剂活泼的金属单质Al、Zn、Fe等某些非金属单质C、H2等某些非金属氧化物CO、SO2等三、氧化性和还原性1.氧化性和还原性:(1)氧化性:氧化剂所表现出得电子的性质。(2)还原性:还原剂所表现出失电子的性质。2.氧化性、还原性和元素化合价之间的关系:四、氧化还原反应对人类生产生活的影响1.正面影响2.负面影响应用体验 1.(2021·海口高一检测)下列关于氧化还原反应的叙述,正确的是( B )A.失去电子的反应是还原反应B.失去电子的物质是还原剂C.发生氧化反应的物质是氧化剂D.作氧化剂的物质不能是还原剂解析:失去电子的反应是氧化反应,失去电子的物质是还原剂,发生氧化反应的物质是还原剂,作氧化剂的物质也可能作还原剂,故选B。2.在含有Cu(NO2)、Mg(NO3)、AgNO3的溶液中加入适量锌粉,首先置换出的是( C )A.Mg B.CuC.Ag D.H2解析:氧化性Ag+、Cu2+、Mg2+依次减弱,加入锌粉,Ag+先反应,先置换出Ag,故选C。3.单宁是葡萄酒中所含有的两种酚类化合物其中的一种物质,单宁有独特的抗氧化性,能有效抵御生物氧化作用,它还有清除活性氧的功能。下列对于单宁在保护葡萄酒过程中的有关说法中,正确的是( A )A.单宁作还原剂B.单宁作氧化剂C.单宁被还原D.单宁中某元素化合价降低解析:活性氧具有氧化性,单宁能清除活性氧,单宁作还原剂,所以选A。4.在一定条件下,RO+F2+aOH-===RO+2F-+H2O,下列叙述正确的是( D )A.n=2,a=2B.n=2,a=1C.RO中R的化合价为+6D.n=1,a=2解析:先根据质量守恒求得a=2,再根据电荷守恒求得n=1,所以选D。要点归纳 课堂素能探究知识点 物质氧化性、还原性强弱的比较问题探究:1.一种物质具有氧化性,则不具有还原性,反之亦然,这种观点是否正确?2.在氧化还原反应中金属元素被还原一定得到金属单质吗?非金属元素被还原一定得到非金属单质吗?探究提示:1.不正确。物质具有氧化性或还原性,与物质的性质有关,有些物质只具有氧化性,如F2,有些物质只具有还原性,如K、Ca等,有些物质既具有氧化性又具有还原性,如SO2在反应SO2+2H2S===3S↓+2H2O中表现氧化性,而在反应2SO2+O22SO3中表现还原性。2.均不一定,如Fe3+被还原为Fe2+、CO2被C还原为CO等。知识归纳总结:1.根据氧化还原反应方程式判断:较强氧化性的氧化剂跟较强还原性的还原剂反应,生成较弱还原性的还原产物和较弱氧化性的氧化产物。氧化性:氧化剂>氧化产物还原性:还原剂>还原产物特点:比什么性,找什么剂,产物之性小于剂。2.根据金属、非金属活动性顺序判断:特点:上左下右可反应,隔之越远越易反应。即根据活动性顺序,处于上行左侧的单质与下行右侧的离子可以发生反应,且间隔越大越容易反应。3.根据反应的条件及反应的剧烈程度比较:反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,如是否加热、反应温度高低、有无催化剂和反应物浓度大小等。例如,MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O氧化性:KMnO4>MnO24.比较氧化性、还原性强弱的其他方法:根据氧化还原反应的程度比较:不同氧化剂与相同还原剂作用时,还原剂化合价升高的数值越大,氧化剂的氧化性越强。例如:→典例1 (2021·银川高一检测)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(1)已知KBrO3在反应中得到电子,则该反应的还原剂是AsH3。(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为Br2。(3)根据上述反应可推知a、c。a.氧化性:KBrO3>H3AsO4b.氧化性:H3AsO4>KBrO3c.还原性:AsH3>Xd.还原性:X>AsH3(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:解析:(1)已知KBrO3为得电子物质,故其化合价一定降低,作氧化剂,那么还原剂只能是题目所提供的AsH3,AsH3中As的化合价为-3价,反应后变为含+5价As的H3AsO4 ,故还原剂为AsH3。(2)0.2 mol KBrO3在反应中得1 mol电子,故1 mol KBrO3得5 mol电子,即反应后Br的化合价应从+5价降为0价,故另一物质为Br2。(3)此题的考点为氧化还原反应中的基本规律:氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物,故选a、c。(4)因为氧化剂、还原剂、氧化产物、还原产物已知,可直接进行配平。As:-3价→+5价 升8价Br:+5价→0价 降5价根据化合价升降相等,在AsH3前配系数5,在KBrO3前配系数8,在Br2前配系数4;再根据K原子守恒,K2SO4应在生成物中,系数为4;则H2SO4应在反应物中,系数为4;H2O在生成物中,系数为4;配平后用单线桥标出电子转移方向和数目。〔素养应用1〕从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强。(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质。则在Cu、Fe、Ag中,Fe的还原性最强,在Cu2+、Fe2+、Ag+中,Ag+的氧化性最强。(2)铁钉在氯气中被锈蚀为棕褐色物质(FeCl3),而在盐酸中生成淡绿色溶液(FeCl2)。则在氯气分子(Cl2)、氯离子、氢离子中,Cl2、H+具有氧化性,Cl2的氧化性更强。解析:(1)涉及反应的两个化学方程式为① Fe + CuSO4 === FeSO4 + Cu 还原剂 氧化剂 氧化产物 还原产物② Cu+ 2AgNO3===Cu(NO3)2 + 2Ag 还原剂 氧化剂 氧化产物 还原产物根据①知,还原性:Fe>Cu,氧化性:Cu2+>Fe2+;根据②知,还原性:Cu>Ag,氧化性:Ag+>Cu2+;故还原性:Fe>Cu>Ag,氧化性:Ag+>Cu2+>Fe2+。(2)发生反应的两个化学方程式为①2Fe+3Cl22FeCl3②Fe+2HCl===FeCl2+H2↑由上可知,Cl2将Fe氧化为Fe3+,而HCl将Fe氧化为Fe2+,所以Cl2、H+有氧化性,且Cl2的氧化性更强。知识点 氧化还原反应基本规律问题探究:1.把少量铁粉加入到硝酸铜和硝酸银的混合溶液中,结果只有银白色物质析出,你能比较出Ag+和Cu2+的氧化性强弱吗?2.已知硫元素的常见价态有-2价、0价、+4价、+6价,从硫元素的角度分析,SO2、浓硫酸分别具有什么性质?二者能反应吗?探究提示:1.因为铁能与Ag+、Cu2+发生反应,结果只有银白色物质析出,说明少量铁粉先与Ag+发生反应,因此Ag+的氧化性强。2.SO2中硫元素处于中间价态,具有氧化性和还原性,浓硫酸中硫元素处于最高价态,浓硫酸只具有氧化性。由于二者的价态分别为+4价和+6价,而+4价和+6价之间,无其他价态,故二者不发生氧化还原反应。知识归纳总结:1.守恒规律:— |— |—应用:有关氧化还原反应的计算与化学方程式的配平。2.强弱规律:在一个氧化还原反应中,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。应用:比较物质间氧化性或还原性的强弱。3.先后规律:在浓度相差不大的溶液中含有(1)几种还原剂时将按照还原性由强到弱的顺序依次反应。(2)几种氧化剂时将按照氧化性由强到弱的顺序依次反应。应用:判断氧化性、还原性强弱和判断反应的先后顺序。4.价态规律:(1)高低规律:最高价态只有氧化性,最低价态只有还原性,中间价态既有氧化性又有还原性。(2)“价态归中,互不交叉”规律:同种元素不同价态之间发生氧化还原反应时可总结为价态相邻能共存,价态相间能归中,归中价态不交叉,价升价降只靠拢。 “价态归中,互不交叉”的三种情况:应用:可判断氧化还原反应能否进行及反应产物。规律方法指导:(1)元素处于最高价时只有氧化性,但氧化性不一定强。如CO2中C为+4价,是最高价,但CO2的氧化性很弱。(2)元素处于最低价态时只有还原性,但还原性不一定强。如H2O中O为-2价,是最低价,但H2O的还原性非常弱。典例2 氰化钠是一种重要的基本化工原料,用于化学合成、电镀、冶金和有机合成医药、农药及金属处理方面。氰化钠有剧毒,皮肤伤口接触、吸入、吞食微量可中毒死亡。(1)NaCN(N为-3价)属于剧毒物质,可用H2O2进行无害化处理:NaCN+H2O2→N2↑+X+H2O。X的化学式是什么?NaHCO3(2)TiO2作催化剂,用NaClO将CN-氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。写出CNO-在酸性条件下被NaClO氧化的离子方程式2CNO-+6ClO-+8H+===N2↑+2CO2↑+3Cl2↑+4H2O。解析:(1)根据氧化还原反应中得失电子守恒和原子守恒可以推出X为NaHCO3。(2)CNO-在酸性条件下与NaClO反应生成N2、CO2、Cl2,根据元素守恒可知还有H2O生成,结合原子守恒、得失电子守恒和电荷守恒可写出该离子方程式。〔素养应用2〕一定条件下,氨气与一氧化氮发生反应:NH3+NO→N2+H2O(未配平)。在该反应中,被氧化与被还原的氮原子数之比为( A )A.23 B.32C.45 D.56解析:在氧化还原反应中,得失电子数目相等。NH3中N的化合价为-3,反应后变为0,作还原剂被氧化;NO中N的化合价为+2,反应后为0,作氧化剂被还原。为保持得失电子数目相等,则应为2个NH3和3个NO反应,所以被氧化与被还原的氮原子的原子个数比为23。名师博客呈现1.氧化还原反应方程式的配平 (1)配平原则①得失电子守恒:氧化剂和还原剂得失电子总数相等,表现为化合价升降总数相等。②质量守恒:反应前后原子的种类和个数不变。③电荷守恒:反应前后离子所带电荷总数相等,主要针对离子方程式。(2)配平步骤(以C与HNO3反应为例)标价态列变化求总数配系数根据化学式,标出发生氧化反应和还原反应的元素的正负化合价+HO3——O2↑+O2↑+H2O再用观察法配平其他物质的化学计量数,配平后再增添必要的符号和反应条件C+4HNO34NO2↑+CO2↑+2H2O(3)氧化还原离子方程式的配平氧化还原离子方程式的配平与其化学方程式的配平基本原理相同,都遵循得失电子守恒,但由于阴阳离子的存在,氧化还原离子方程式还要遵循电荷守恒。④配系数3Cu+H++2NO——3Cu2++2NO↑+H2O电荷守恒:左2NO与8H+===右3Cu2+原子守恒:左侧8H===右侧4H2O(8H)⑤细检查,验其他:左侧6O===右侧2NO+4H2O(6O)3Cu+8H++2NO===3Cu2++2NO↑+4H2O3.氧化还原反应的计算(1)计算方法在任何氧化还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。(2)计算步骤①找出氧化剂、还原剂及相应的还原产物和氧化产物。②找准一个原子或离子得失电子数(注意化学式中粒子的个数)。③根据题中物质的系数和得失电子守恒列出等式。氧化剂系数×变价原子个数×化合价变化值(高价-低价)=还原剂系数×变价原子个数×化合价变化值(高价-低价)。〔即时训练〕M2O和S2-在酸性溶液中发生反应:M2O+3S2-+14H+===2M3++3S↓+7H2O,则M2O中M的化合价是( D )A.+2 B.+3C.+4 D.+6解析:M2O+3S2-+14H+===2M3++3S↓+7H2O中,S元素的化合价升高,M元素的化合价降低,设M2O中M元素的化合价为n,由得失电子数相等可知,2×(n-3)=3×[0-(-2)],解得n=+6。课堂达标验收1.针对二氧化硫的以下反应说法不正确的是( D )①SO2+2NaOH===Na2SO3+H2O②SO2+2H2S===3S↓+2H2O③SO2+Cl2+2H2O===H2SO+2HClA.①反应由于元素的化合价没有发生变化,因此该反应不是氧化还原反应B.②反应中二氧化硫作氧化剂C.②中氧化产物和还原产物的质量之比为21D.③中二氧化硫作氧化剂解析:A项中所有元素化合价都没有发生变化,因此不是氧化还原反应;B项中二氧化硫中硫元素的化合价降低因此作氧化剂;C项中产物中的3个硫原子其中两个是化合价升高得到,一个是化合价降低得到,因此氧化产物和还原产物的质量之比为21;D项中二氧化硫中的硫元素化合价升高在反应中作还原剂。2.氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C2AlN+3CO合成。下列叙述不正确的是( B )A.AlN中N显-3价B.上述反应中,Al2O3是氧化剂C.上述反应中N2被还原D.上述反应中碳发生氧化反应解析:AlN中铝元素显+3价,根据化合价规则,所以氮的化合价为-3,故A正确;反应中氮元素化合价降低,N2是氧化剂被还原,碳元素化合价升高,所以C是还原剂被氧化,而Al2O3中两元素的化合价没有发生变化,因此既不是氧化剂也不是还原剂,故B错误,C、D正确。3.随着人们生活水平的提高,汽车进入寻常百姓家,安全驾驶很重要,汽车都安装有车安全气囊,在发生剧烈的汽车碰撞时,汽车安全气囊会发生反应10NaN3+2KNO3K2O+5Na2O+16N2↑,有关该反应说法正确的是( B )A氧化剂与还原剂的物质的量之比为51B.N2既是氧化产物也是还原产物C.NaN3是氧化剂D.KNO3发生氧化反应解析:NaN3中N元素化合价升高,是还原剂,KNO3中N元素化合价降低,是氧化剂,则氧化剂与还原剂的物质的量之比为15,故A错误;反应中只有N元素的化合价变化,则N2既是氧化产物也是还原产物,故B正确;NaN3中N元素化合价升高,是还原剂,故C错误;KNO3中N元素化合价降低,被还原,发生还原反应,故D错误。4.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。(1)某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应(其中N均为-3价、O均为-2价)KCN+2KOH+Cl2===KOCN+2KCl+H2O:该反应中,被氧化的元素是C,氧化产物是KOCN。处理上述废水20.0 L,使KCN完全转化为KOCN,至少需氯气14.2g.(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请用单线桥法标出电子转移方向和数目:2KOCN+4KOH+3Cl2===2CO2↑+6KCl+2H2O+N2↑2H2O。解析:(1)该反应中,Cl元素化合价由0价变为-1价,C元素化合价由+2价变为+4价,被氧化的元素为C,氧化产物为KOCN;废水中KCN的质量为650 mg·L-1×20 L=13 000 mg=13 g,根据方程式可知,每有65 g KCN反应消耗71 g氯气,所以13 g KCN完全反应,消耗14.2 g氯气。(2)Cl元素化合价由0降低为-1价,N元素的化合价由-3价升高为0,该反应转移6e-,用单线桥法标出电子转移方向和数目为
相关学案
这是一份高中化学第一章 物质及其变化第三节 氧化还原反应第2课时学案,共17页。
这是一份人教版 (2019)必修 第一册第三节 氧化还原反应第2课时学案,共12页。学案主要包含了氧化剂和还原剂,常见的氧化剂和还原剂,氧化性和还原性等内容,欢迎下载使用。
这是一份化学必修 第一册第二节 离子反应第1课时导学案,共9页。学案主要包含了电解质,电解质的电离等内容,欢迎下载使用。