





还剩8页未读,
继续阅读
所属成套资源:九年级化学下册专题复习课件PPT鲁教版
成套系列资料,整套一键下载
- 九年级化学下册专题复习二工艺流程题课件鲁教版 课件 0 次下载
- 九年级化学下册专题复习三化学图表题课件鲁教版 课件 0 次下载
- 九年级化学下册专题复习四科学探究题课件鲁教版 课件 0 次下载
- 九年级化学下册专题复习五综合计算题课件鲁教版 课件 0 次下载
九年级化学下册专题复习一下册记忆专项练习课件鲁教版
展开
这是一份九年级化学下册专题复习一下册记忆专项练习课件鲁教版,共15页。PPT课件主要包含了CO2,CH4,NH3,H2O,天然气,金刚石,活性炭,稀盐酸,稀硫酸,AlOH3等内容,欢迎下载使用。
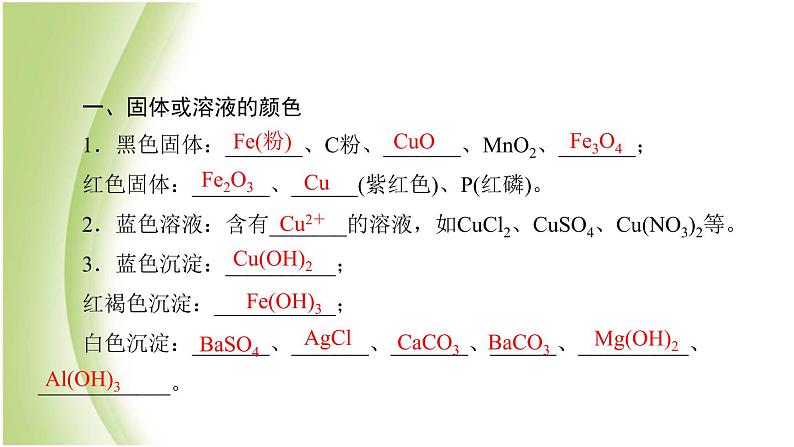
二、反应的特征现象1.能使澄清石灰水变浑浊的无色无味气体是____。2.能使黑色CuO变红、使红色Fe2O3变黑的气体是____或____,固体是____。3.能使燃着的木条燃烧得更旺的气体是____,使火焰熄灭的气体是___或____等,能使带火星的木条复燃的气体是____。4.在O2中燃烧火星四射的物质是____。5.在O2中燃烧发出耀眼的白光的物质是____。6.在空气中燃烧生成水和二氧化碳的物质是有机物,如____、C2H5OH等。7.溶于水呈碱性的气体是____。
三、元素或物质之最1.地壳中含量最多的元素是____。2.形成化合物最多的元素是____。3.地壳中含量最多的金属元素是____。4.人体中含量最多的元素是____。5.空气中含量最多的元素是____。6.最理想的清洁燃料是___。7.最简单的有机物是____。8.最常用的溶剂是____。9.人体中含量最多的物质是____。10.空气中含量最多的气体是____。11.相对分子质量最小的有机物是____。12.相对分子质量最小、密度最小的气体是____。13.三大化石燃料是____、石油和_________。
四、物质的用途1.供给呼吸且能支持燃烧的气体是_____。2.可作为生产氮肥的原料、食品保护气的是______。3.用作电极、制铅笔芯的是______。4.用作玻璃刀刀头、钻探机钻头的是_________。5.用作灭火剂、制冷剂、人工降雨和气体肥料的是____。6.引起温室效应的气体是_______。7.用作吸附剂的是_______。8.可以作燃料的是CH4、______。9.胃酸的主要成分是______。
10.能除去水垢、除铁锈的是________、_______。11.能治疗胃酸过多的是Mg(OH)2、________、NaHCO3。12.可作干燥剂的是_______、_______。13.能改良酸性土壤的是________。14.食盐的主要成分是________。15.小苏打的化学式是________。16.可用于生产玻璃、洗涤剂的是________。17.配制波尔多液的两种原料是________、Ca(OH)2。18.可作补钙剂的是________。19.常用作复合肥的盐是________。20.家用调味品食醋的主要成分是____________。21.酒精的主要成分是________。
五、组成元素相同的物质1.组成元素相同且常温下为气态的物质是______和______。2.组成元素相同且常温下为液态的物质是_______和_______。
六、重要的化学方程式(一)化合反应1.__________________________(镁在空气或氧气中燃烧,产生耀眼的白光,生成白色粉末)2.________________________(铁丝在氧气中燃烧,火星四射,生成黑色固体。铁丝在空气中不燃烧)
2Mg+O2 2MgO
3Fe+2O2 Fe3O4
3.____________________(铜在空气中受热,固体由红色变成黑色)4.____________________(铝在空气中被氧化,表面生成一层致密的氧化物薄膜)5.____________________(氢气在空气中燃烧,发出淡蓝色火焰,放出热量,产物是水。氢气是清洁能源)6.______________________(红磷或白磷燃烧,产生大量白烟)7.______________________(硫在空气中燃烧发出淡蓝色火焰,在氧气中燃烧发出蓝紫色火焰)8.______________________(碳在空气或氧气中充分燃烧,生成的气体能使澄清的石灰水变浑浊)
2Cu+O2 2CuO
4Al+3O2===2Al2O3
2H2+O2 2H2O
4P+5O2 2P2O5
S+O2 SO2
C+O2(充足) CO2
9.______________________(碳在空气中不充分燃烧,生成有毒气体CO)10._________________________(一氧化碳在空气中燃烧,发出蓝色火焰)11._________________________(由CO2→CO,该反应是吸热反应)12.____________________________(二氧化碳溶于水,生成碳酸)13.____________________________(生石灰溶于水变成熟石灰,该反应大量放热)
2C+O2(不足) 2CO
2CO+O2 2CO2
C+CO2 2CO
CO2+H2O===H2CO3
CaO+H2O===Ca(OH)2
14._______________________________(水在直流电的作用下分解,负氢正氧,氢二氧一)15.___________________________(实验室用氯酸钾和二氧化锰制取氧气)16.________________________________(实验室用高锰酸钾制取氧气)17.___________________________(实验室用双氧水和二氧化锰制取氧气)18.__________________________(高温煅烧石灰石;二氧化碳的工业制法)19._____________________________________(碳酸不稳定,容易分解)20.__________________________________(碳酸氢钠受热分解)
2H2O 2H2↑+O2↑
2KClO3 2KCl+3O2↑
2KMnO4 K2MnO4+MnO2+O2↑
2H2O2 2H2O+O2↑
CaCO3 CaO+CO2↑
H2CO3===H2O+CO2↑
2NaHCO3 Na2CO3+H2O+CO2↑
(三)置换反应21._______________________________(氢气还原氧化铜)22.__________________________________(木炭还原氧化铜)23._____________________________________(焦炭还原氧化铁)24._______________________________(锌与稀硫酸反应)25._____________________________________ (铁与稀硫酸反应,有气泡产生,溶液由无色变成浅绿色)26._____________________________________(镁与稀硫酸反应)27._____________________________________(铝与稀硫酸反应)
H2+CuO Cu+H2O
C+2CuO 2Cu+CO2↑
3C+2Fe2O3 4Fe+3CO2↑
Zn+H2SO4===ZnSO4+H2↑
Fe+H2SO4===FeSO4+H2↑
Mg+H2SO4===MgSO4+H2↑
2Al+3H2SO4===Al2(SO4)3+3H2↑
28.____________________________(锌与稀盐酸反应)29.____________________________(铁与稀盐酸反应)30.____________________________(镁与稀盐酸反应)31._____________________________(铝与稀盐酸反应)32._______________________________(湿法冶铜;铁与硫酸铜溶液反应)33.________________________________(锌与硫酸铜溶液反应)34._________________________________(铜与硝酸银溶液反应)
Zn+2HCl===ZnCl2+H2↑
Fe+2HCl===FeCl2+H2↑
Mg+2HCl===MgCl2+H2↑
2Al+6HCl===2AlCl3+3H2↑
Fe+CuSO4===FeSO4+Cu
Zn+CuSO4===ZnSO4+Cu
Cu+2AgNO3===Cu(NO3)2+2Ag
(四)复分解反应35.__________________________________(用稀盐酸除铁锈)36.__________________________________(用稀硫酸除铁锈)37.__________________________________(氧化镁与稀盐酸反应)38.__________________________________(氧化铜与稀硫酸反应)39.__________________________________(稀盐酸与氢氧化钠反应)40.__________________________________(稀盐酸与氢氧化铜反应)41.__________________________________(稀盐酸与氢氧化钙反应)42._________________________________(用含氢氧化铝的药物治疗胃酸过多)43.__________________________________(稀硫酸与氢氧化钠反应)
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
MgO+2HCl===MgCl2+H2O
CuO+H2SO4===CuSO4+H2O
HCl+NaOH===NaCl+H2O
2HCl+Cu(OH)2===CuCl2+2H2O
2HCl+Ca(OH)2===CaCl2+2H2O
3HCl+Al(OH)3===AlCl3+3H2O
H2SO4+2NaOH===Na2SO4+2H2O
44._________________________________________(实验室制二氧化碳)45._________________________________________(碳酸钠与稀盐酸反应)46.___________________________________________(稀盐酸与硝酸银反应)47.________________________________________(碳酸钠与稀硫酸反应)48._______________________________________(稀硫酸与氯化钡反应)49.__________________________________________(氢氧化钠溶液与硫酸 铜溶液反应)50.______________________________________(澄清石灰水与碳酸钠反应)51.___________________________________(氯化钠溶液与硝酸银溶液反应)52.__________________________________(硫酸钠溶液与氯化钡溶液反应)
CaCO3+2HCl===CaCl2+H2O+CO2↑
Na2CO3+2HCl===2NaCl+H2O+CO2↑
HCl+AgNO3===AgCl↓(白)+HNO3
Na2CO3+H2SO4===Na2SO4+H2O+CO2↑
H2SO4+BaCl2===BaSO4↓(白)+2HCl_
2NaOH+CuSO4===Cu(OH)2↓(蓝)+Na2SO4
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
NaCl+AgNO3===AgCl↓(白)+NaNO3
Na2SO4+BaCl2===BaSO4↓+2NaCl
(五)其他反应53.__________________________________(甲烷燃烧,发出明亮的蓝色火焰,烧杯内壁有水珠,澄清石灰水变浑浊)54.____________________________________(酒精燃烧)55.____________________________________(一氧化碳还原氧化铜,黑色粉末变成红色,澄清石灰水变浑浊)56.____________________________________(一氧化碳还原氧化铁;工业炼铁的原理)57.__________________________________(一氧化碳还原四氧化三铁)
CH4+2O2 CO2+2H2O
C2H5OH+3O2 2CO2+3H2O
CO+CuO Cu+CO2
3CO+Fe2O3 2Fe+3CO2
Fe3O4+4CO 3Fe+4CO2
二、反应的特征现象1.能使澄清石灰水变浑浊的无色无味气体是____。2.能使黑色CuO变红、使红色Fe2O3变黑的气体是____或____,固体是____。3.能使燃着的木条燃烧得更旺的气体是____,使火焰熄灭的气体是___或____等,能使带火星的木条复燃的气体是____。4.在O2中燃烧火星四射的物质是____。5.在O2中燃烧发出耀眼的白光的物质是____。6.在空气中燃烧生成水和二氧化碳的物质是有机物,如____、C2H5OH等。7.溶于水呈碱性的气体是____。
三、元素或物质之最1.地壳中含量最多的元素是____。2.形成化合物最多的元素是____。3.地壳中含量最多的金属元素是____。4.人体中含量最多的元素是____。5.空气中含量最多的元素是____。6.最理想的清洁燃料是___。7.最简单的有机物是____。8.最常用的溶剂是____。9.人体中含量最多的物质是____。10.空气中含量最多的气体是____。11.相对分子质量最小的有机物是____。12.相对分子质量最小、密度最小的气体是____。13.三大化石燃料是____、石油和_________。
四、物质的用途1.供给呼吸且能支持燃烧的气体是_____。2.可作为生产氮肥的原料、食品保护气的是______。3.用作电极、制铅笔芯的是______。4.用作玻璃刀刀头、钻探机钻头的是_________。5.用作灭火剂、制冷剂、人工降雨和气体肥料的是____。6.引起温室效应的气体是_______。7.用作吸附剂的是_______。8.可以作燃料的是CH4、______。9.胃酸的主要成分是______。
10.能除去水垢、除铁锈的是________、_______。11.能治疗胃酸过多的是Mg(OH)2、________、NaHCO3。12.可作干燥剂的是_______、_______。13.能改良酸性土壤的是________。14.食盐的主要成分是________。15.小苏打的化学式是________。16.可用于生产玻璃、洗涤剂的是________。17.配制波尔多液的两种原料是________、Ca(OH)2。18.可作补钙剂的是________。19.常用作复合肥的盐是________。20.家用调味品食醋的主要成分是____________。21.酒精的主要成分是________。
五、组成元素相同的物质1.组成元素相同且常温下为气态的物质是______和______。2.组成元素相同且常温下为液态的物质是_______和_______。
六、重要的化学方程式(一)化合反应1.__________________________(镁在空气或氧气中燃烧,产生耀眼的白光,生成白色粉末)2.________________________(铁丝在氧气中燃烧,火星四射,生成黑色固体。铁丝在空气中不燃烧)
2Mg+O2 2MgO
3Fe+2O2 Fe3O4
3.____________________(铜在空气中受热,固体由红色变成黑色)4.____________________(铝在空气中被氧化,表面生成一层致密的氧化物薄膜)5.____________________(氢气在空气中燃烧,发出淡蓝色火焰,放出热量,产物是水。氢气是清洁能源)6.______________________(红磷或白磷燃烧,产生大量白烟)7.______________________(硫在空气中燃烧发出淡蓝色火焰,在氧气中燃烧发出蓝紫色火焰)8.______________________(碳在空气或氧气中充分燃烧,生成的气体能使澄清的石灰水变浑浊)
2Cu+O2 2CuO
4Al+3O2===2Al2O3
2H2+O2 2H2O
4P+5O2 2P2O5
S+O2 SO2
C+O2(充足) CO2
9.______________________(碳在空气中不充分燃烧,生成有毒气体CO)10._________________________(一氧化碳在空气中燃烧,发出蓝色火焰)11._________________________(由CO2→CO,该反应是吸热反应)12.____________________________(二氧化碳溶于水,生成碳酸)13.____________________________(生石灰溶于水变成熟石灰,该反应大量放热)
2C+O2(不足) 2CO
2CO+O2 2CO2
C+CO2 2CO
CO2+H2O===H2CO3
CaO+H2O===Ca(OH)2
14._______________________________(水在直流电的作用下分解,负氢正氧,氢二氧一)15.___________________________(实验室用氯酸钾和二氧化锰制取氧气)16.________________________________(实验室用高锰酸钾制取氧气)17.___________________________(实验室用双氧水和二氧化锰制取氧气)18.__________________________(高温煅烧石灰石;二氧化碳的工业制法)19._____________________________________(碳酸不稳定,容易分解)20.__________________________________(碳酸氢钠受热分解)
2H2O 2H2↑+O2↑
2KClO3 2KCl+3O2↑
2KMnO4 K2MnO4+MnO2+O2↑
2H2O2 2H2O+O2↑
CaCO3 CaO+CO2↑
H2CO3===H2O+CO2↑
2NaHCO3 Na2CO3+H2O+CO2↑
(三)置换反应21._______________________________(氢气还原氧化铜)22.__________________________________(木炭还原氧化铜)23._____________________________________(焦炭还原氧化铁)24._______________________________(锌与稀硫酸反应)25._____________________________________ (铁与稀硫酸反应,有气泡产生,溶液由无色变成浅绿色)26._____________________________________(镁与稀硫酸反应)27._____________________________________(铝与稀硫酸反应)
H2+CuO Cu+H2O
C+2CuO 2Cu+CO2↑
3C+2Fe2O3 4Fe+3CO2↑
Zn+H2SO4===ZnSO4+H2↑
Fe+H2SO4===FeSO4+H2↑
Mg+H2SO4===MgSO4+H2↑
2Al+3H2SO4===Al2(SO4)3+3H2↑
28.____________________________(锌与稀盐酸反应)29.____________________________(铁与稀盐酸反应)30.____________________________(镁与稀盐酸反应)31._____________________________(铝与稀盐酸反应)32._______________________________(湿法冶铜;铁与硫酸铜溶液反应)33.________________________________(锌与硫酸铜溶液反应)34._________________________________(铜与硝酸银溶液反应)
Zn+2HCl===ZnCl2+H2↑
Fe+2HCl===FeCl2+H2↑
Mg+2HCl===MgCl2+H2↑
2Al+6HCl===2AlCl3+3H2↑
Fe+CuSO4===FeSO4+Cu
Zn+CuSO4===ZnSO4+Cu
Cu+2AgNO3===Cu(NO3)2+2Ag
(四)复分解反应35.__________________________________(用稀盐酸除铁锈)36.__________________________________(用稀硫酸除铁锈)37.__________________________________(氧化镁与稀盐酸反应)38.__________________________________(氧化铜与稀硫酸反应)39.__________________________________(稀盐酸与氢氧化钠反应)40.__________________________________(稀盐酸与氢氧化铜反应)41.__________________________________(稀盐酸与氢氧化钙反应)42._________________________________(用含氢氧化铝的药物治疗胃酸过多)43.__________________________________(稀硫酸与氢氧化钠反应)
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
MgO+2HCl===MgCl2+H2O
CuO+H2SO4===CuSO4+H2O
HCl+NaOH===NaCl+H2O
2HCl+Cu(OH)2===CuCl2+2H2O
2HCl+Ca(OH)2===CaCl2+2H2O
3HCl+Al(OH)3===AlCl3+3H2O
H2SO4+2NaOH===Na2SO4+2H2O
44._________________________________________(实验室制二氧化碳)45._________________________________________(碳酸钠与稀盐酸反应)46.___________________________________________(稀盐酸与硝酸银反应)47.________________________________________(碳酸钠与稀硫酸反应)48._______________________________________(稀硫酸与氯化钡反应)49.__________________________________________(氢氧化钠溶液与硫酸 铜溶液反应)50.______________________________________(澄清石灰水与碳酸钠反应)51.___________________________________(氯化钠溶液与硝酸银溶液反应)52.__________________________________(硫酸钠溶液与氯化钡溶液反应)
CaCO3+2HCl===CaCl2+H2O+CO2↑
Na2CO3+2HCl===2NaCl+H2O+CO2↑
HCl+AgNO3===AgCl↓(白)+HNO3
Na2CO3+H2SO4===Na2SO4+H2O+CO2↑
H2SO4+BaCl2===BaSO4↓(白)+2HCl_
2NaOH+CuSO4===Cu(OH)2↓(蓝)+Na2SO4
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
NaCl+AgNO3===AgCl↓(白)+NaNO3
Na2SO4+BaCl2===BaSO4↓+2NaCl
(五)其他反应53.__________________________________(甲烷燃烧,发出明亮的蓝色火焰,烧杯内壁有水珠,澄清石灰水变浑浊)54.____________________________________(酒精燃烧)55.____________________________________(一氧化碳还原氧化铜,黑色粉末变成红色,澄清石灰水变浑浊)56.____________________________________(一氧化碳还原氧化铁;工业炼铁的原理)57.__________________________________(一氧化碳还原四氧化三铁)
CH4+2O2 CO2+2H2O
C2H5OH+3O2 2CO2+3H2O
CO+CuO Cu+CO2
3CO+Fe2O3 2Fe+3CO2
Fe3O4+4CO 3Fe+4CO2
相关课件
鲁教版化学九年级下册 专题六 化学计算课件: 这是一份鲁教版化学九年级下册 专题六 化学计算课件,共26页。
鲁教版化学九年级下册 专题二 图表题课件: 这是一份鲁教版化学九年级下册 专题二 图表题课件,共26页。
鲁教版化学九年级下册 专题一 化学用语课件: 这是一份鲁教版化学九年级下册 专题一 化学用语课件,共26页。












