






所属成套资源:九年级化学下册单元课件鲁教版专题
九年级化学下册第九单元金属质量评估试卷课件鲁教版
展开
这是一份九年级化学下册第九单元金属质量评估试卷课件鲁教版,共22页。
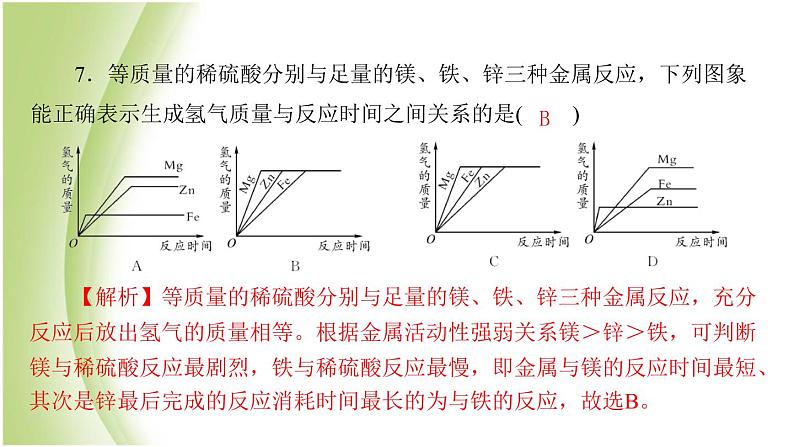
可能用到的相对原子质量:H—1 O—16 Mg—24 S—32 Fe—56 Ca—64 Zn—65第Ⅰ卷(选择题 共30分)一、单项选择题(每小题3分,共30分)1.人类开发利用金属单质的年代与金属活动性顺序有着某种关系,因此,人类开发利用的年代最迟的金属是( )A.铜 B.铁 C.铝 D.铅2.铜的下列用途中,主要与化学性质有关的是( )A.制成火锅 B.塑造铜像 C.制造电线 D.制硫酸铜CD3.美国“深度撞击”飞行器成功炮轰坦普尔1号彗星,其撞击器采用的是一种含铍(一种金属)3%的铜合金。关于合金,下列说法错误的是( )A.合金也是“金属材料”B.合金的硬度一般比各成分金属大C.多数合金的熔点低于组成它的成分金属 D.合金只能由金属与金属熔合而成D4.2018年5月我国自主建造的第一艘航母下海。为保证航母的使用寿命,下列防锈措施不可行的是( )A.用抗锈蚀性能优异的合金制造航母零部件 B.刷防锈漆C.船体表面镀一层黄金 D.给某些部位涂油5.下列关于金属的说法正确的是( )A.人类使用金属铝的年代早于铜、铁B.“真金不怕火炼”表明金(Au)在高温条件下也很难与氧气反应C.通过高炉炼得的铁为纯铁D.武德合金的熔点高,可用于制造保险丝CB6.炼铁高炉中发生了下列反应,其中属于化合反应的是( )①焦炭充分燃烧;②灼热的焦炭和二氧化碳反应;③高温煅烧石灰石;④高温下一氧化碳将铁矿石还原为铁。A.①和② B.③和④C.①和③ D.只有④A7.等质量的稀硫酸分别与足量的镁、铁、锌三种金属反应,下列图象能正确表示生成氢气质量与反应时间之间关系的是( )【解析】等质量的稀硫酸分别与足量的镁、铁、锌三种金属反应,充分反应后放出氢气的质量相等。根据金属活动性强弱关系镁>锌>铁,可判断镁与稀硫酸反应最剧烈,铁与稀硫酸反应最慢,即金属与镁的反应时间最短、其次是锌最后完成的反应消耗时间最长的为与铁的反应,故选B。B8.某兴趣小组进行实验探究,向盛有硝酸亚铁和硝酸银混合液的烧杯中加入一定量的锌粉,反应停止后过滤,向滤渣中加入稀盐酸,有气泡产生。下列说法正确的是( )A.滤液中一定含有Zn2+和Fe2+,一定没有Ag+B.滤液中一定含有Zn2+,一定没有Fe2+和Ag+C.滤渣中一定含有银,可能含有锌和铁D.滤渣中一定含有银和铁,可能含有锌D9.金属锰与氯化亚铁溶液可发生如下反应:Mn+FeCl2===MnCl2+Fe,下列说法错误的是( )A.该反应属于置换反应 B.锰的金属活动性比铁强C.锰能置换出盐酸中的氢 D.反应前后元素的化合价都不变10.向一定量的硝酸铜、硝酸银的混合溶液中加入5.6 g铁粉,充分反应后过滤、洗涤、干燥,称得固体14 g。向固体中加入稀盐酸,无气泡产生,则下列分析正确的是( )A.滤液中一定不含有硝酸银 B.滤液中一定含有硝酸铜C.滤出的固体中含有银7.6 g D.滤出的固体中含有铜6.4 gDA第Ⅱ卷(非选择题 共70分)二、填空题(共35分)11.(6分)请根据常见金属性质回答问题:(1)将以下常见金属的活动顺序补充完整。(2)黄金首饰不易锈蚀的主要原因是________________________________________________________________。黄金的金属活动性弱(或黄金的化学性质稳定,黄金不易跟氧气反应等)(3)从Mg、Zn、Cu、Fe中选出适当的物质与稀硫酸反应,写出反应的化学方程式(写一个即可):___________________________________________________________________________________________。(4)用CuSO4 配制农药波尔多液时不能在____(填序号)中进行。A.塑料桶 B.铁桶 C.木桶 Zn+H2SO4===ZnSO4+H2↑(或Mg+H2SO4===MgSO4+H2↑或Fe+H2SO4===FeSO4+H2↑)B12.(10分)铁合金在生产、生活中应用广泛。(1)地球上的铁元素以________(填“单质”或“化合物”)的形式存在。可用于炼铁的一种矿石是________________________。(2)用生铁制防盗门而不用纯铁的主要原因是______________________________。在防盗门表面喷漆,其防锈原理是____________________,喷漆前用稀盐酸除铁锈的化学方程式为____________________________________。 化合物赤铁矿或磁铁矿等 生铁为铁的合金,硬度更高隔绝外界的氧气和水Fe2O3+6HCl===2FeCl3+3H2O13.(10分)A~H是初中化学中的常见物质。已知A属于盐,常用作建筑材料,E是赤铁矿石的主要成分,F可用于中和酸性土壤, H的溶液呈浅绿色。它们的转化关系如图所示(反应条件未完全标出)。(1)写出A、F的化学式:A_______;F_________。(2)写出反应②的化学方程式:____________________________________。(3)反应④属于四种基本反应类型中的______反应。(4)少量气体B通入F的溶液中有白色沉淀产生,反应的化学方程式为_________________________________________。CaCO3Ca(OH)2Fe2O3+3CO 2Fe+3CO2置换CO2+Ca(OH)2===CaCO3↓+H2O14.(11分)[2017·苏州]某工厂产生的烧渣(主要含FeO、Fe2O3,还有一定量的SiO2)可用于制备七水合硫酸亚铁晶体(FeSO4 ·7H2O),其工艺流程如下:查阅资料:SiO2不溶于水,也不与稀硫酸反应。(1)“浸取”步骤中,FeO、Fe2O3和稀硫酸发生反应的化学方程式分别为FeO+H2SO4===FeSO4+H2O、____________________________________。Fe2O3+3H2SO4===Fe2(SO4)3+3H2O(2)为提高“浸取”步骤的反应速率,可采取的具体措施有__________________________________________(写2条,不考虑“搅拌”和 “使用催化剂”)。(3)“还原”步骤的目的是将Fe3+转化为Fe2+,试剂X可用SO2或Fe。①若试剂X是SO2,转化原理为SO2+Fe2 (SO4)3+2Y===2FeSO4+2H2SO4,则Y的化学式是____。②若试剂X是Fe,转化原理为Fe+Fe2 (SO4)3===3FeSO4。测得“还原”后溶液的pH明显增大,其原因是__________________________________。增大硫酸的浓度、升高温度或将烧渣粉碎H2O铁消耗过量的硫酸,溶液酸性减弱【解析】(1)氧化铁与稀硫酸反应生成硫酸铁和水。(2)为了加快反应速率可增大溶液的浓度、升高温度、增大固体的表面积,故可增大硫酸的浓度、 升高温度或将烧渣粉碎。(3)①根据反应前后原子的种类和个数不变,可求出Y的化学式为H2O。②根据流程图可知稀硫酸是过量的,加入的铁不仅能与硫酸铁反应还能与硫酸反应,故硫酸的量减少,酸性减弱,pH增大。三、实验题(共25分)15.(9分)王老师在某工厂废水处理池中提取一瓶含有AgNO3、Cu(NO3)2和Al(NO3)3的工业废水样品带回实验室,静置,取上层清液,加入锌粉,充分反应后过滤,得到滤液甲和滤渣乙。请你和你的化学小组完成以下探究(不考虑杂质干扰)。【提出问题】滤渣乙是什么?【作出猜想】小明认为滤渣乙是银,小东认为滤渣乙是银和铜,小华认为滤渣乙是银、铜和铝,你认为滤渣乙还可能是____________。【交流讨论】大家经过讨论后,认为小华的猜想错误,理由是____________________________________。【实验探究】设计实验探究滤渣乙的成分,请填写下列空白:银、铜、锌锌不和硝酸铝溶液反应银(或银和铜)氢氧化钠银和铜【反思交流】通过交流,大家认为在滤液甲中加入稀盐酸,当观察到______________,也能得出实验1的结论。无明显现象16.(16分)某校化学研究性学习小组通过实验研究高炉炼铁的化学原理,设计了如下实验装置:(1)已知HCOOH(甲酸) CO↑+H2O,根据该反应制取CO,A处应选用的气体发生装置是____(填序号)。a(2)装置中仪器①的名称是_________。装置B内所盛放浓硫酸作用是干燥CO,D装置的作用为____________________________________(用化学方程式表示)。铁架台CO2+Ca(OH)2===CaCO3↓+H2O(3)①实验开始时应先点燃________(填“A”或“C”)的热源。②反应前后C装置玻璃管内物质的颜色变化是________________。③C装置玻璃管内发生反应的化学方程式为______________________________________________。④检验C中的产物是否为铁的方法是____________________________。⑤待C装置玻璃管内物质冷却后再停止通CO,目的是__________________________________________________。(4)该装置有一个明显的缺陷,改进的方法为_____________________。A由红棕色变黑3CO+Fe2O3 2Fe+3CO2是否能被磁铁吸引等防止生成的铁被氧化,同时防止石灰水倒吸增加尾气处理装置【解析】(1)反应物为液体,条件为加热,故A处应选用的气体发生装置是a。(2)装置中仪器①的名称是铁架台。D装置作用检验生成的二氧化碳CO2+Ca(OH)2 ===CaCO3↓+ H2O。(3)实验开始时应先点燃 A处的热源,产生一氧化碳,并不断通入C装置发生的反应为3CO+ Fe2O3 2Fe + 3CO2。④检验C中的产物是否为铁的方法是是否能被磁铁吸引等。待硬质粗玻璃管内物质冷却后再停止通CO的目的是为了防止生成的铁被氧化,同时防止澄清石灰水倒流入玻璃管内使较热的玻璃管炸裂。(4)实验中有一部分一氧化碳释放到了空气中,由于一氧化碳有毒,会污染空气,因此必须要对实验产生的尾气进行处理。处理方法将尾气进行点燃或收集起来都可。四、计算题(共10分)17.(8分)小英同学用某铁合金样品做了如下实验:称量11.4 g样品,放入质量为40 g的烧杯中,再往烧杯中加入200 g稀硫酸,恰好完全反应(杂质不与酸反应,也不溶于水)。反应完毕后称量,烧杯及烧杯内物质总质量为251 g。求:(1)反应产生的氢气质量为____g。【解析】由质量守恒可知,反应产生的氢气的质量是11.4 g+40 g+200 g-251 g=0.4 g。0.4(2)所用稀硫酸的溶质质量分数为多少?(写出计算过程)。解:设所用H2SO4的质量为 x。Fe+H2SO4===FeSO4+H2↑ 98 2 x 0.4 g x=19.6 g稀硫酸的溶质质量分数= ×100%=9.8%。答:所用稀硫酸的溶质质量分数为9.8%。






