





高中化学人教版 (2019)必修 第一册第二节 元素周期律课文课件ppt
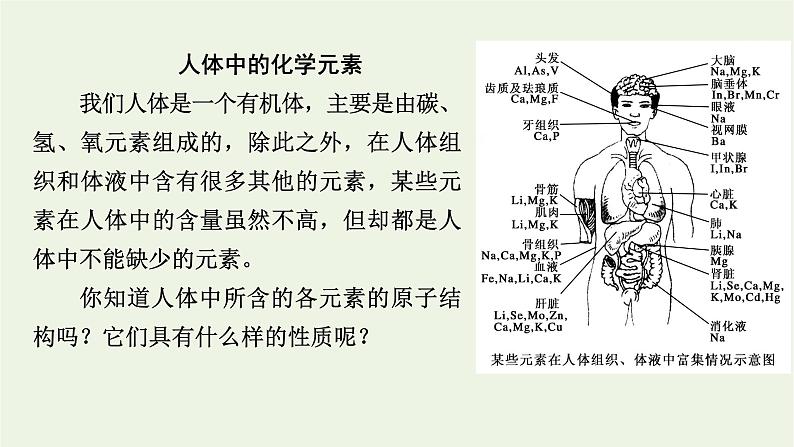
展开人体中的化学元素我们人体是一个有机体,主要是由碳、氢、氧元素组成的,除此之外,在人体组织和体液中含有很多其他的元素,某些元素在人体中的含量虽然不高,但却都是人体中不能缺少的元素。你知道人体中所含的各元素的原子结构吗?它们具有什么样的性质呢?
1.碱金属元素包括____________________(填写元素符号)等元素,它们都处于元素周期表中第______族;卤族元素包括_______________ (填写元素符号)等元素,它们都处于元素周期表中第______族。2.钠与水反应的离子方程式为_________________________________________。钠与氧气在常温和加热条件下反应得到的产物分别为_______、________。3.氯气与氢气反应的条件是_____________。
Li、Na、K、Rb、Cs
2Na+2H2O===2Na++2OH-+H2↑
一、元素的性质1.金属性金属元素的原子最外层电子一般少于____个,在化学反应中容易___________,具有_________。即元素的金属性是指元素的原子所具有的___________的能力。2.非金属性非金属元素的原子最外层电子一般多于____个,在化学反应中容易___________,具有___________。即元素的非金属性是指元素的原子所具有的___________的能力。
二、碱金属元素1.碱金属元素的原子结构
2.碱金属单质的化学性质(1)钠、钾与氧气反应比较
(2)钠、钾与水反应的比较
钾与水的反应有轻微爆炸声并着火燃烧
2Na+2H2O===2NaOH+H2↑
2K+2H2O===2KOH+H2↑
3.碱金属单质的物理性质
三、卤族元素1.卤素单质的物理性质
2.卤素的原子结构特点
3.卤素单质的化学性质(1)卤素单质与氢气反应
H2+F2===2HF
(2)卤素单质之间的置换反应
Cl2+2KBr===2KCl+Br2
Cl2+2KI===2KCl+I2
Br2+2KI===2KBr+I2
四、同主族元素的性质与原子结构的关系
1.下列关于碱金属元素和卤素的说法中错误的是( )A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子能力最强C.钾与水的反应比钠与水的反应更剧烈D.溴单质与水的反应比氯单质与水的反应更剧烈解析:同主族元素从上到下,原子半径逐渐增大,金属族失电子能力增强,与水反应越来越强,非金属族得电子能力减弱,与H2O反应越来越难,D项错误,A、B、C正确。
2.锂(Li)是一种银白色的金属元素,质软,是密度最小的金属。用于原子反应堆、制轻合金及电池等,锂电池或锂离子电池备受人们推崇。
锂(Li)不可能具有的性质是( )A.锂在空气中燃烧只会生成氧化锂B.锂很软,用小刀可以切割C.锂的熔点比金属铯高D.金属锂可以保存在煤油或液体石蜡中解析:锂较其他碱金属活泼性差,燃烧生成氧化锂,A正确;碱金属都很软,可用小刀切割,B正确;碱金属由Li到Cs熔点逐渐降低,C正确;金属锂的密度比煤油的小,所以不能保存在煤油中,D不正确。
3.最新报道,我国科学家通过与多个国家进行科技合作,成功研制出铯(Cs)原子喷泉钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒,标志着我国时间频率基准研究进入世界先进行列。
已知铯位于元素周期表中第六周期第ⅠA族,根据铯在元素周期表中的位置,推断下列内容:(1)铯的原子核外共有____层电子,最外层电子数为____,铯的原子序数为_____。(2)铯单质与水剧烈反应,放出_____色气体,同时使紫色石蕊试液显_____色,因为_____________________________(写出化学方程式)。(3)预测铯单质的还原性比钠单质的还原性_____(填“弱”或“强”)。
2Cs+2H2O===2CsOH+H2↑
解析:根据原子核外电子排布规律,结合铯在元素周期表中的位置知:铯原子核外电子分六层排布,分别是2、8、18、18、8、1,原子序数是55,最外层只有1个电子。铯与钠同主族,具有极强的金属性。与水反应生成氢气和氢氧化铯:2Cs+2H2O══2CsOH+H2↑,氢氧化铯是强碱,使紫色石蕊试液变蓝色。
碱金属元素单质化学性质的相似性和递变性
1.Li、Na、K在空气中燃烧分别生成Li2O、Na2O2、KO2(超氧化钾)说明什么问题?如何保存单质钾?2.请结合碱金属元素的原子结构的递变性探究其单质化学性质的递变性。探究提示:1.说明Li、Na、K活动性依次增强;保存钾时保存在煤油中,以避免与空气中的O2、H2O反应。2.碱金属元素原子的最外层电子数都相等,但从Li到Cs,随着核电荷数的增加,碱金属元素原子的电子层数逐渐增多,原子核对核外电子的吸引能力逐渐减弱;失电子能力逐渐增强,金属性逐渐增强。
知识归纳总结:1.相似性
2.递变性具体情况如下(按从Li→Cs的顺序):(1)与氧气、与水反应的剧烈程度逐渐增强。①与O2反应越来越剧烈,产物也更加复杂,Li只生成Li2O,Na能生成Na2O和Na2O2,K则能生成K2O、K2O2、KO2等。②与水反应越来越剧烈,K能发生轻微爆炸,Rb、Cs遇水则发生剧烈爆炸。
(2)最高价氧化物对应水化物的碱性逐渐增强,即碱性:LiOH
解析:Cs的最外层电子数是1,电子层数比K的多,故Cs的金属性比K强,CsOH的碱性比KOH强,A项正确;铯与Na性质相似,与水或酸反应更剧烈,都生成H2,B项正确;Cs的还原性比Na强,所以Na+的得电子能力比Cs+强,C项正确;因为Na2CO3、K2CO3均易溶于水,所以Cs2CO3也易溶于水,D项错误。
〔素养应用1〕铷元素广泛用于特种玻璃、医学、能源等领域。其中在高科技领域显示了广阔的应用前景。锂云母是提取铷的重要原料。我国的锂云母主要分布于江西宜春、湖南正冲、广西栗木等地。已知铷是37号元素。根据相关知识回答下列问题:(1)铷(Rb)位于元素周期表的第_____周期______族。
(2)关于铷的结构和性质判断正确的是_________(填序号)。①与水反应比钠剧烈②原子半径比钠小③氧化物暴露在空气中易吸收CO2④阳离子最外层电子数和镁原子相同⑤是还原剂解析:(1)由Rb的原子序数是37可推知Rb位于第五周期ⅠA族。(2)由Rb的原子结构示意图可知②④不正确;又因Na和Rb同主族,根据同主族元素性质的递变规律知,Rb的金属性比Na强,故①③⑤正确。
问题探究: 1.由F、Cl、Br、I的原子结构推测它们得失电子能力大小。2.根据卤族元素的性质分析,将F2通入NaCl溶液中得到什么气体?
卤族元素性质的相似性和递变性
探究提示:1.它们最外层都有7个电子,都易得一个电子达到稳定结构,但它们的原子半径依次增大,得电子能力逐渐减弱。2.F2的氧化性强于Cl2,但由于F2易与H2O反应:2F2+2H2O══4HF+O2,故F2通入NaCl溶液中得到O2而不是Cl2。
知识归纳总结:1.相似性:
2.递变性:具体情况如下:(1)与H2反应越来越难,对应氢化物的稳定性逐渐减弱,氢化物还原性逐渐增强,其水溶液的酸性逐渐增强,即:稳定性:HF>HCl>HBr>HI;还原性:HF<HCl<HBr<HI;酸性:HF<HCl<HBr<HI。(2)最高价氧化物的水化物的酸性逐渐减弱,即HClO4>HBrO4>HIO4。
点拨:卤素单质性质中的特殊情况(1)F2能与水反应,反应方程式为2F2+2H2O══4HF+O2。因此,F2不能从溶液中置换出其他卤素单质。(2)通常情况下,氟没有正价,所以氟没有含氧酸。(3)溶解性:通常情况下,除F2外,卤素单质在水中的溶解度都不大,但是均易溶于有机溶剂。(4)卤素单质都有毒,液溴易挥发,保存时常用水密封。(5)溴单质在常温下是唯一一种液态非金属单质。(6)碘为紫色固体,易升华,淀粉遇I2变蓝色。(7)氢氟酸为弱酸,而盐酸、氢溴酸、氢碘酸为强酸。
1826年,法国的一位青年波拉德把海藻烧成灰,用热水浸取,再往里通氯气,这时,就得到紫黑色的固体——碘晶体。他发现在提取后的母液底部,总沉着一层深褐色的液体,这液体具有刺鼻的臭味。详细地进行研究后证明,这深褐色的液体,是一种人们还未发现的新元素。科学家把这种新元素称为“溴”。德国著名的化学家李比希也做过和波拉德相似的实验,看到过这一奇怪的现象,所不同的是,李比希没有深入地钻研下去,只凭空地断定这深褐色的液体只不过是氯化碘(ICl)——通氯气时,氯和碘形成的化合物。因此,他只是往瓶子上贴了一张“氯化碘”的标签就完了,从而与溴元素失之交臂,没有发现这一新的元素。
(1)写出波拉德获得溴、碘单质的离子方程式。(2)比较Cl-、Br-、I-的还原性强弱,并从原子结构角度解释原因。
答案:(1)Cl2+2Br-══Br2+2Cl-,Cl2+2I-══I2+2Cl-(2)Cl-、Br-、I-的还原性:Cl-
解答同主族元素原子结构和性质递变规律类题的常见思路
〔即时训练〕可能存在的第119号未知元素,有人称为“类钫”。根据周期表结构及元素性质变化趋势,下列有关“类钫”的预测中错误的是( )A.单质有较高的熔点B.“类钫”在化合物中呈+1价C.“类钫”具有放射性D.“类钫”单质的密度大于1 g·cm-3解析:“类钫”在周期表中处于碱金属元素的最下方,碱金属元素从上到下,原子半径逐渐增大,单质的熔、沸点逐渐降低,A错误。
1.(2021·石家庄高一检测)下列关于卤素(F、Cl、Br、I)叙述正确的是( )A.其单质在常压下的沸点,随着卤素核电荷数的增多逐渐降低B.单质和水反应通式:X2+H2O══HX+HXO(用X表示卤素),剧烈程度随着核电荷数的增多而减弱C.单质和氢气反应的通式:X2+H2══2HX(条件不同),剧烈程度随着卤素核电荷数的增多而减弱D.随着卤素核电荷数的增多,单质的氧化性逐渐增强
解析:卤素单质在常压下的沸点,随着卤素核电荷数的增多逐渐升高,A项不正确;单质氟和水反应生成HF和氧气,B项不正确;同主族自上而下非金属性逐渐减弱,所以与H2反应的剧烈程度逐渐减弱,C项正确;随着卤素核电荷数的增多,单质的氧化性逐渐减弱,D项不正确。
2.下列说法正确的是( )A.氟、氯、溴原子的最外层电子数都是7,次外层电子数都是8B.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增规律C.酸性:HFO4>HClO2>HBrO4>HIO4D.砹属于卤族元素,位于第六周期,根据卤素性质的相似性,砹微溶于水,易溶于CCl4
解析:F的次外层电子数为2,Br的次外层电子数为18,A项错误;元素的非金属性强弱可以根据其最高价氧化物对应水化物的酸性强弱比较,不能根据氢化物的酸性强弱比较,B项错误;F无正化合价,不能形成HFO4,C错误;由碘微溶于水、易溶于四氯化碳可推知,砹微溶于水,易溶于CCl4,D正确。
3.(2021·实验中学高一)镭是元素周期表中第七周期ⅡA族元素,关于其叙述不正确的是( )A.镭的金属性比钙弱B.单质能与水反应生成H2C.在化合物中呈+2价D.碳酸镭难溶于水解析:同主族金属元素从上至下金属性增强,镭位于钙下面,镭的金属性比钙强,所以选A。
高中化学人教版 (2019)必修 第一册第二节 元素周期律备课ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律备课ppt课件,共55页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律作业课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律作业课件ppt,共24页。
化学必修 第一册第四章 物质结构 元素周期律第二节 元素周期律备课课件ppt: 这是一份化学必修 第一册第四章 物质结构 元素周期律第二节 元素周期律备课课件ppt,共60页。PPT课件主要包含了内容索引,课前篇素养初探,课堂篇素养提升,素养目标,2化学性质特点,单质的物理性质,2具体表现等内容,欢迎下载使用。













