




2020-2021学年第二节 元素周期律说课课件ppt
展开核外电子是处在一定的轨道上绕核运行的,正如太阳系的行星绕太阳运行一样;核外运行的电子分层排布,按能量高低而距核远近不同。这个模型被称为“玻尔原子模型”。现代物质结构理论在新的实验基础上保留了“玻尔原子模型”合理的部分,并赋予其新的内容。你想知道核外电子是如何排布的吗?请让我们一起走进教材学习元素性质的周期性变化规律。
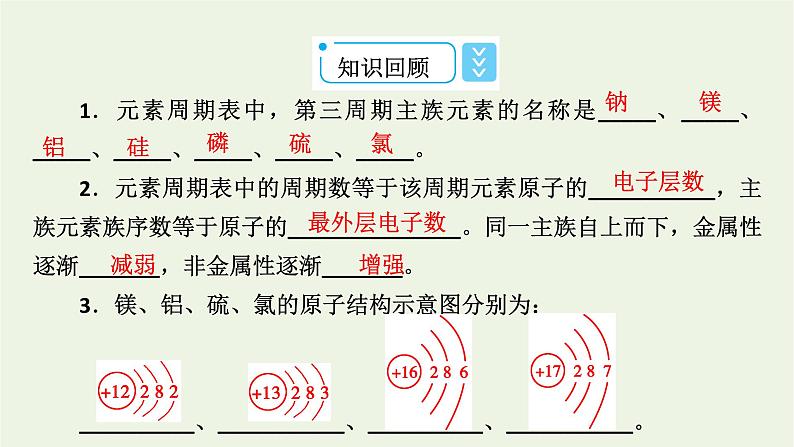
1.元素周期表中,第三周期主族元素的名称是_____、_____、_____、_____、_____、_____、_____。2.元素周期表中的周期数等于该周期元素原子的___________,主族元素族序数等于原子的_______________。同一主族自上而下,金属性逐渐_______,非金属性逐渐_______。3.镁、铝、硫、氯的原子结构示意图分别为:__________、___________、__________、___________。
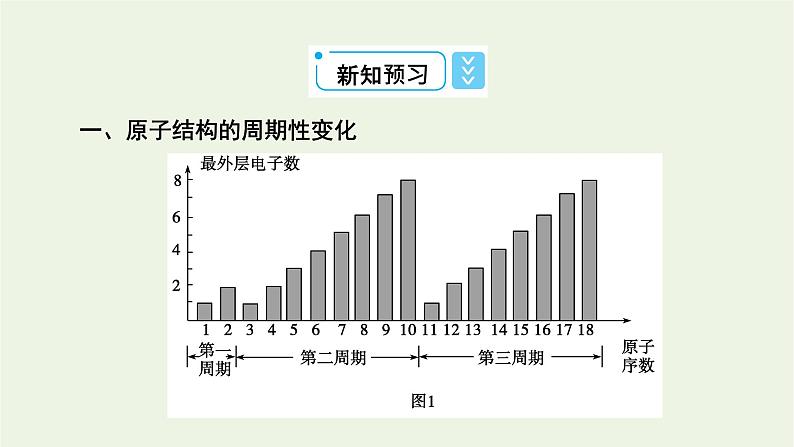
一、原子结构的周期性变化
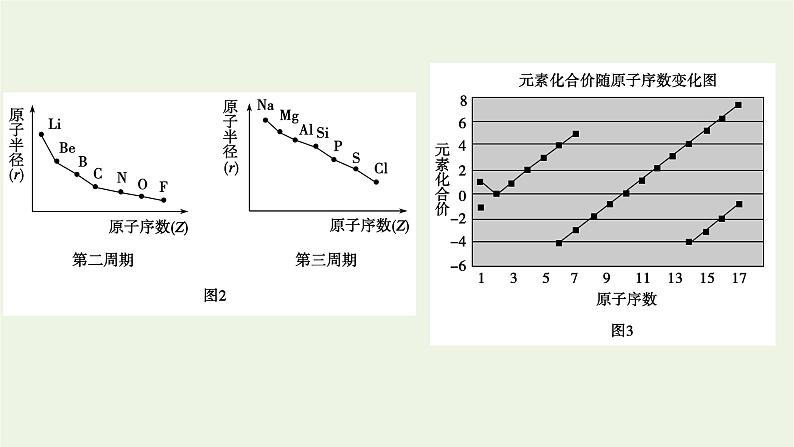
结合图1、图2、图3完成下表:
核外电子排布、原子半径、化合价都呈周期性变化
二、第三周期元素性质的递变1.钠、镁与水的反应
钠熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红
加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为粉红色
2Na+2H2O===2NaOH+H2↑
2.两性氢氧化物(1)概念:既能与强酸反应又能与强碱反应,且均生成盐和水的氢氧化物。(2)氢氧化铝的两性①向AlCl3溶液中加入过量氨水,现象:_______________,反应方程式:__________________________________________。②向AlCl3溶液中逐滴加入NaOH溶液至过量,现象:_________________________________,反应方程式:_____________________________________、__________________________________。
AlCl3+3NH3·H2O===3NH4Cl+Al(OH)3↓
先产生白色沉淀,后白色沉淀溶解
AlCl3+3NaOH===3NaCl+Al(OH)3↓
NaOH+Al(OH)3===NaAlO2+2H2O
③向Al(OH)3沉淀中加入盐酸,发生反应的离子方程式:_________________________________。3.钠、镁、铝的最高价氧化物对应水化物的碱性
Al(OH)3+3H+===Al3++3H2O
4.Si、P、S、Cl的非金属性的递变规律
HClO4>H2SO4>H3PO4>H2SiO3
Si、P、S、Cl的非金属性逐渐增强
1.下列各组元素中,按从左到右的顺序,原子序数递增、元素的最高正化合价也递增的是( )A.C、N、O、F B.Na、Be、B、CC.P、S、Cl、Ar D.Na、Mg、Al、Si解析:F无正化合价,A项错误;Na原子序数最大,B项错误;Ar为惰性气体,最高价一般为0,C项错误;Na、Mg、Al、Si位于同周期,原子序数依次增大,最高正化合价递增,D项正确。
2.元素的性质呈周期性变化的根本原因是( )A.相对原子质量递增,量变引起质变B.原子半径呈周期性变化C.原子核外电子排布呈周期性变化D.元素的最高正化合价呈周期性变化解析:结构决定性质,元素原子的核外电子排布的周期性变化导致元素性质的周期性变化,故选C。
3.原子序数从11依次增加到17,下列递变关系中错误的是( )A.电子层数逐渐增多B.原子半径逐渐减小C.最高正化合价数值逐渐增大D.从Si到Cl,最低负化合价从-4到-1解析:根据原子的核外电子排布可知,从11号到17号元素都为3个电子层,最外层电子数从1→7逐渐增多,最高正价依次升高,Na、Mg、Al没有负价,从Si到Cl最低负价从-4到-1,原子半径逐渐减小。
4.(2021·丽水高一检测)在“世界硒都”——恩施硒资源相对丰富和集中,属于高硒区,该地盛产富硒茶,含有人体所必需的硒元素,有一定的保健作用。
已知硒元素与氧元素同族,与钙元素同周期。下列关于硒的描述不正确的是( )A.原子序数为24B.最高价氧化物是SeO3,是酸性氧化物C.原子半径比钙小D.气态氢化物的化学式是H2Se,稳定性比HCl差解析:由题中信息知Se在周期表中的第四周期第ⅥA族,原子序数是34,故选A。
元素周期表中主族元素的周期性变化规律
探究提示:1.(1)非金属性:Cl>S>P,酸性:HClO4>H2SO4>H3PO4。(2)非金属性:Cl>S>P,还原性:P3->S2->Cl-。2.元素的非金属性越强,气态氢化物越稳定。同周期元素,随着原子序数的递增,非金属性逐渐增强,故非金属性:Si
元素周期表是元素周期律的具体表现形式,是学习化学的一种重要工具。过去,门捷列夫曾用元素周期律预言未知元素并得到了证实。下列关于元素周期律的叙述中不正确的是( )A.Na、Mg、Al最外层电子数依次增多,单核离子的氧化性依次增强B.P、S、Cl最高正化合价依次升高,对应气态氢化物的稳定性依次增强C.同周期元素的原子半径以第ⅦA族的为最大D.Na、Mg、Al的氢氧化物的碱性依次减弱解析:元素周期表中,同周期主族元素从左到右,原子半径逐渐减小,只有C不正确。
〔素养应用〕a,b,c,d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族,下列叙述正确的是( )A.原子半径:d>c>b>aB.4种元素中b的金属性最强C.c的氧化物的水化物是强碱D.d单质的氧化性比a单质的氧化性强
解析:由a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同,则a的原子序数应为2或8,原子序数为2时为He,故a原子序数为8,则a为O;c所在周期数与族数相同,则c只能为Al;由于d与a同族,d为S;则b为Na或Mg。由于b、c、d在第3周期,则原子半径为b>c>d,d与a同主族,则原子半径d>a,故A项错误;同周期从左到右,金属性逐渐减弱,则金属性b>c,a、d为非金属,金属性较弱,故B正确;c为Al,其氧化物的水化物为氢氧化铝,为两性氢氧化物,不是强碱,故C项错误;d与a属于第ⅥA族,分别为S和O,同一主族的元素非金属性从上到下逐渐减弱,因此a单质的氧化性比d单质的氧化性强,故D错误。
问题探究:1.根据元素周期表中各元素原子半径的变化规律,比较碳元素和氟元素、氧元素和硫元素的原子半径大小。2.如何比较电子层结构相同的微粒的半径大小?以O2-、F-、Na+、Mg2+、Al3+为例说明。
探究提示:1.C和F是同周期元素,同周期元素从左到右原子半径逐渐减小,故原子半径C大于F;O和S为同主族元素,同主族元素从上到下原子半径逐渐增大,所以原子半径S大于O。2.电子层结构相同时,核外电子数必定相等,其微粒半径随核电荷数的增加而减小,故离子半径:O2->F->Na+>Mg2+>Al3+。
知识归纳总结:粒子半径大小比较的“四同”
微观粒子尽管微乎其微,小到肉眼无法观察到,但与宇宙天体有很多相似之处,其中之一是都存在半径问题。(1)微粒半径与电子层数、核电荷数、电子数有什么关系?(2)同周期元素中,原子半径最小的是哪族元素?(3)同一周期的阴离子和阳离子比较,哪个的半径更大?(4)比较下列各组微粒半径,正确的是________。①Cl
〔素养应用2〕下列粒子半径大小的比较中,正确的是( )A.Na+
解析:Na+、Mg2+、Al3+、O2-的核外电子排布相同,核电荷数越大,微粒的半径就越小,应是Al3+
常见10电子和18电子微粒总结(1)10电子微粒:
1.(2021·宿迁高一检测)下列实验不能作为判断依据的是( )A.钠和铯分别与冷水反应的剧烈程度,判断钠和铯金属性强弱B.铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱C.硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱D.根据Br2和I2分别与H2反应的难易,判断溴与碘的非金属性强弱
2.四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )A.原子半径:Z
H2S+O2===S+H2O
解析:根据元素在周期表中的位置可知元素①~⑨分别是H、C、N、O、F、Na、Mg、S、Cl。(1)②为碳元素,在周期表中位于第2周期ⅣA族。(2)元素⑤为F、元素⑨为Cl,同一主族,从上到下,原子半径增大,因此原子半径从大到小的顺序是Cl>F。(3)元素⑤为F、元素⑨为Cl,非金属性F>Cl,故氢化物的稳定性HF>HCl。(4)元素④为O,元素⑧为S。可利用反应H2S+O2══S+H2O验证。
4.元素在元素周期表中的位置,反映了元素的原子结构和元素的性质,如氮族元素是位于元素周期表ⅤA族的元素,在生活中有广泛的应用,如N2作防腐气体,液氮还可用作制冷剂,P可用于制造农药等。如图是元素周期表的一部分。
(1)阴影部分元素N在元素周期表中的位置是什么?根据元素周期律,预测H3AsO4与H3PO4酸性强弱的大小关系是什么。(2)在一定条件下,S与H2反应有一定难度,请判断:在相同条件下Se与H2反应的难度比S与H2反应难度更大还是更小?(3)下列说法正确的是______A.C、N、O、F的原子半径随着原子序数的增大而减小B.氯气能置换出NaBr溶液中的溴C.HF、HCl、HBr、HI的热稳定性依次减弱
高中化学人教版 (2019)必修 第一册第二节 元素周期律优秀ppt课件: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161998_t3/?tag_id=26" target="_blank">第二节 元素周期律优秀ppt课件</a>,共25页。PPT课件主要包含了本节重点,本节难点,半径增大,金属性增强,思考1,思考2,“一看”电子层数,“二看”核电荷数,主族元素的主要化合价,原子半径逐渐减小等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律备课ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律备课ppt课件,共28页。PPT课件主要包含了第二节元素周期律,化合价都呈周期性变化,不溶解,不反应,Na>Mg>Al,SiPSCl,核外电子排布,随堂演练•知识落实,HCl>H2S,HClO4等内容,欢迎下载使用。
化学必修 第一册第二节 元素周期律教学演示课件ppt: 这是一份化学必修 第一册第二节 元素周期律教学演示课件ppt,共53页。PPT课件主要包含了目录索引等内容,欢迎下载使用。













