
2022届高三化学一轮复习化学反应原理08电离平衡常数相关计算含解析
展开电离平衡常数相关计算
填空题(共22题)
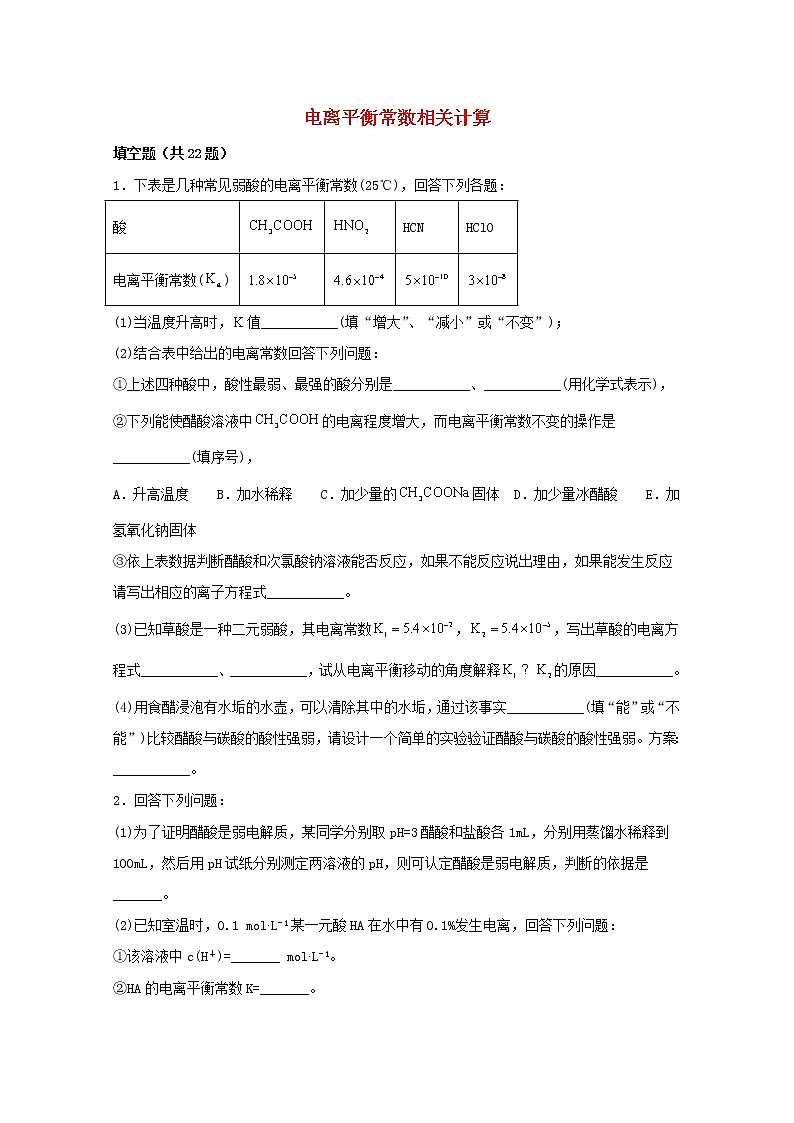
1.下表是几种常见弱酸的电离平衡常数(25℃),回答下列各题:
酸
HCN
HClO
电离平衡常数()
(1)当温度升高时,值___________(填“增大”、“减小”或“不变”);
(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,酸性最弱、最强的酸分别是___________、___________(用化学式表示),
②下列能使醋酸溶液中的电离程度增大,而电离平衡常数不变的操作是___________(填序号),
A.升高温度 B.加水稀释 C.加少量的固体 D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式___________。
(3)已知草酸是一种二元弱酸,其电离常数,,写出草酸的电离方程式___________、___________,试从电离平衡移动的角度解释的原因___________。
(4)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实___________(填“能”或“不能”)比较醋酸与碳酸的酸性强弱,请设计一个简单的实验验证醋酸与碳酸的酸性强弱。方案:___________。
2.回答下列问题:
(1)为了证明醋酸是弱电解质,某同学分别取pH=3醋酸和盐酸各1mL,分别用蒸馏水稀释到100mL,然后用pH试纸分别测定两溶液的pH,则可认定醋酸是弱电解质,判断的依据是_______。
(2)已知室温时,0.1 mol∙L−1某一元酸HA在水中有0.1%发生电离,回答下列问题:
①该溶液中c(H+)=_______ mol∙L−1。
②HA的电离平衡常数K=_______。
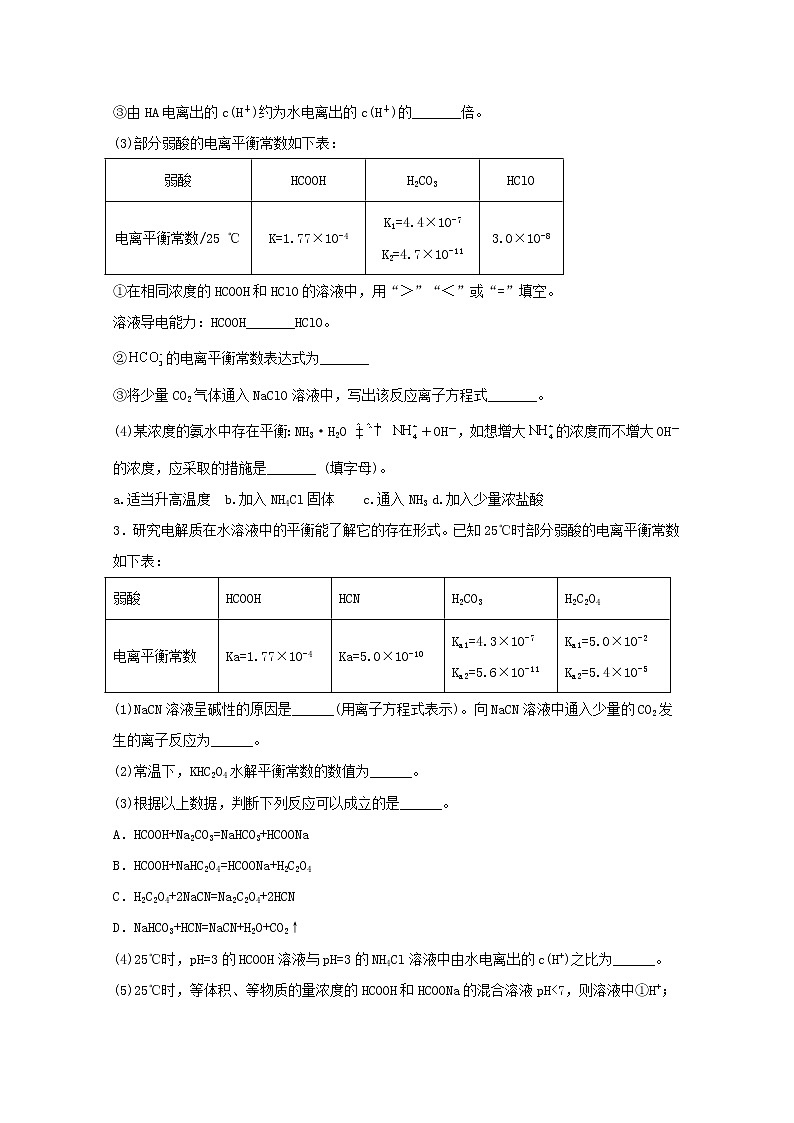
③由HA电离出的c(H+)约为水电离出的c(H+)的_______倍。
(3)部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
H2CO3
HClO
电离平衡常数/25 ℃
K=1.77×10-4
K1=4.4×10-7
K2=4.7×10-11
3.0×10-8
①在相同浓度的HCOOH和HClO的溶液中,用“>”“<”或“=”填空。
溶液导电能力:HCOOH_______HClO。
②的电离平衡常数表达式为_______
③将少量CO2气体通入NaClO溶液中,写出该反应离子方程式_______。
(4)某浓度的氨水中存在平衡:NH3·H2O +OH-,如想增大的浓度而不增大OH-的浓度,应采取的措施是_______ (填字母)。
a.适当升高温度 b.加入NH4Cl固体 c.通入NH3 d.加入少量浓盐酸
3.研究电解质在水溶液中的平衡能了解它的存在形式。已知25℃时部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
H2C2O4
电离平衡常数
Ka=1.77×10-4
Ka=5.0×10-10
Ka1=4.3×10-7
Ka2=5.6×10-11
Ka1=5.0×10-2
Ka2=5.4×10-5
(1)NaCN溶液呈碱性的原因是______(用离子方程式表示)。向NaCN溶液中通入少量的CO2发生的离子反应为______。
(2)常温下,KHC2O4水解平衡常数的数值为______。
(3)根据以上数据,判断下列反应可以成立的是______。
A.HCOOH+Na2CO3=NaHCO3+HCOONa
B.HCOOH+NaHC2O4=HCOONa+H2C2O4
C.H2C2O4+2NaCN=Na2C2O4+2HCN
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(4)25℃时,pH=3的HCOOH溶液与pH=3的NH4Cl溶液中由水电离出的c(H+)之比为______。
(5)25℃时,等体积、等物质的量浓度的HCOOH和HCOONa的混合溶液pH<7,则溶液中①H+;②Na+;③HCOO-;④OH-的物质的量浓度由大到小的顺序依次为______(填序号)。
4.已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
Ka=1.8×10-5
Ka1=4.3×10-7
Ka2=5.6×10-11
Ka=3.0×10-8
(1)同物质的量浓度的下列四种溶液:结合H+能力由大到小排列的顺序是___(用编号填写)。
a.CH3COONa b.NaHCO3 c.NaClO d.Na2CO3
(2)常温下,0.2mol·L-1CH3COOH溶液加等体积的0.1mol·L-1NaOH溶液充分反应后,c(CH3COOH)___c(CH3COO-)(填<、>或=)作出上述判断的依据是__(用文字解释)。
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___。
(4)25℃时,将amol·L-1的醋酸与bmol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为___。
(5)标准状况下,将2.24LCO2通入100mL2mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+___。
(6)若用标准NaOH溶液滴定某醋酸溶液,应选用___作指示剂。
5.回答下列问题:
(1)下列物质: ①Cu ②SO2 ③冰醋酸 ④NaHCO3 ⑤Cu(OH )2 ⑥H2SO4溶液 ⑦NaCl,其中属于电解质的是 ________________(填序号)。
(2)时,溶液的pH=________________。
(3)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离常数如下表:
醋酸
碳酸
亚硫酸
Ka=1.75×10-5
Ka1=4.30×10-7
Ka2=5.61×10-11
Ka1=1.54×10-2
Ka2=1.02×10-7
①由上表数据可知,Na2SO3溶液显_____性,其原因是________________________(用离子方程式表示)。
②时,等浓度的a.Na2CO3溶液、b.CH3COONa溶液、c.Na2SO3溶液,这3种溶液的pH由大到小的顺序为 _______________(用字母表示)。
③工业上可用氨水除去尾气SO2,将SO2通入氨水中,当c(OH-)降至1.0×10-8mol/L时,溶液中的= __________________________ (保留三位有效数字)。
6.按要求回答下列问题:
(1)已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO+H2O H2SO3+OH- ①
HSO H++SO ②
向0.1 mol·L-1的NaHSO3溶液中加入少量氢氧化钠固体,则___________(填“增大”“减小”或“不变”,下同),___________。
(2)氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。25 ℃时氯气——氯水体系中存在以下平衡关系:
Cl2(g) Cl2(aq) ①
Cl2(aq) + H2OHClO + H+ + Cl- ②
HClOH+ + ClO- ③
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
①写出上述体系中属于电离平衡的平衡常数表达式:K=___________,由图可知该常数值为___________。
②用氯处理饮用水时,夏季的杀菌效果比冬季___________(填“好”或“差”),请用勒夏特列原理解释:___________。
7.下列有关水溶液中的平衡相关的问题,请填空。
(1)泡沫灭火器是将Al2(SO4)3溶液和NaHCO3溶液混合,有白色沉淀产生同时释放出CO2,写出反应离子方程式___________。
(2)25℃时,三种弱酸的电离平衡常数如表所示:
分子式
CH3COOH
H2CO3
HClO
电离平衡常数
1.8×10−5
K1=4.3×10−7 K2=5.6×10−11
3.0×10−8
①少量CO2通入NaClO溶液中反应的离子方程式___________;
②下列离子CO、 HCO 、ClO-、CH3COO-结合质子能力由强到弱的顺序为___________。
(3)已知草酸为二元弱酸:H2C2O4HC2O+H+ Ka1
HC2OC2O+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
①如果所得溶液溶质为KHC2O4,则该溶液显___________(填“酸性”、“碱性”或“中性”);
②如果所得溶液溶质为K2C2O4,则该溶液中各离子浓度由大到小顺序为___________;
③当所得溶液pH=2.7时,溶液中=___________。
8.电解质水溶液中存在各种行为,如电离、水解、沉淀溶解等,据所学知识回答下列问题:
(1)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中,a点对应的酸为___________;(填名称),该醋酸溶液稀释过程中,下列各量一定变小的是___________。(填序号)
a.c(H+) b.c(OH-) c. d.
(2)在t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH= ___________。
(3)25℃时,将 a mol·L-1的醋酸和 b mol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则a___________b(填“>”、“<”或“=”),此时溶液中c(CH3COO-)+c(CH3COOH)=___________ mol·L-1(用字母表示)
(4)将AgCl分别放入:①5 mL水 ②10 mL 0.1 mol·L-1 MgCl2溶液 ③20 mL 0.5 mol·L-1 NaCl溶液 ④40 mL 0.3mol·L-1盐酸溶液中溶解至溶液饱和,各溶液中Ag+的浓度分别为a、b、 c、d,它们由大到小的排列顺序___________(用字母表示)。
9.已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为______,溶液中______(填“增大”“减小”“不变”或“不能确定”)。
②25℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=______。
(2)25℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中______(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)已知373 K时,可逆反应平衡常数为K=0.12,若某时刻时,测得c(N2)=1 mol·L-1,c(H2)=3 mol·L-1,c(NH3)=2 mol·L-1。此刻可逆反应______。
A.向正方向进行 B.向逆方向进行 C.处于平衡状态
10.氨水,碳酸氢钠,醋酸都是重要的化工原料,
CH3COOH
NH3.H2O
H2CO3
电离平衡常数(25℃)
Ka=1.75×10-5
Kb=1.75×10-5
Ka1=4.3×10-7 Ka2=5.6×10-11
(1)氨水中滴入酚酞显红色,其原因是___________(用离子方程式表示);碳酸氢钠溶液中滴入酚酞也显红色,其原因是___________ (用离子方程式表示)。
(2)现有0.1 mol·L-1醋酸,要证明它是弱电解质最简单的方法是:___________。
(3)0.1 mol·L-1氨水分别与等浓度的盐酸、醋酸等体积混合,所得溶液的pH值前者___________后者;水的电离程度前者___________后者;等浓度的NH4Cl和NaHCO3溶液中,c(NH)___________c(HCO)。(填“>”“<”或“=”)
(4)NaHCO3常用在灭火器中做原料剂,其参与反应的离子方程式为___________。
(5)常温下,浓度为a mol·L-1的NH4Cl溶液pH=b, 则NH3·H2O 的电离平衡常数Kb=___________。
11.(一)连二次硝酸(H2N2O2)是一种二元酸。可用于制NO气体。常温下,用0.01mol/L的NaOH溶液滴定10mL0.01mol/L的H2N2O2溶液。测得溶液pH与NaOH溶液体积的关系如图所示。
①写出H2N2O2在水溶液中的电离方程式:___________。
②b点时溶液中c(H2N2O2)___________c()(填>、 <或=,下同)
③a点时溶液中c(Na+)___________c()+c()。
④a、b、c三点,水的电离程度最大的是___________。
(二)(1)硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率, 但常常会产生浑浊,请说明原因___________(用离子方程式和必要文字解释) ,用热水配制出澄清的较浓的 CuSO4溶液时应再加入少量___________。
(2)已知25℃下,H2CO3( Ka1=4.30×10−7 Ka2=5.61×10−11) NH3.H2O (Kb=1.77×10−5)
①现有常温下0.1 mol·L−1的(NH4)2CO3溶液,该溶液呈___________性(填“酸”、“中”、“碱”)
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是___________。
A.c(NH)>c(CO)>c(HCO)>c(NH3.H2O)
B.c(NH)+c(H+) = c(HCO)+c(OH−)+c(CO)
C.c(CO)+c(HCO)+c(H2CO3)=0.1mol/L
D.c(NH)+c(NH3.H2O)=2c(CO)+2c(HCO)+2c(H2CO3)
(3)常温下,将a mol/L的CH3COONa溶液和b mol/L的盐酸等体积混合后,溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数Ka=___________。
(4)若0.1 mol/L的HB溶液在常温下的pH=3,则常温下NaB的Kh=___________。
12.已知在25℃时,部分弱酸的电离常数如表所示:
CH3COOH
Ka=1.75×10-5
H2CO3
Ka1=4.30×10-7、Ka2=5.61×10-11
H2SO3
Ka1=1.54×10-2、Ka2=1.02×10-7
(1)写出碳酸的第二级电离平衡常数表达式:Ka2=___。
(2)若保持温度不变,在醋酸溶液中加入少量醋酸钠固体,下列各量会变小的是___(填字母)。
A.c(CH3COO-) B.c(H+) C.醋酸的电离平衡常数 D.醋酸的电离度
(3)pH相等的CH3COONa溶液、NaHCO3溶液、Na2SO3溶液中,溶质的物质的量浓度最大的是___溶液。
(4)Na2CO3溶液中各离子浓度由大到小的顺序为___。
13.表中是几种常见弱酸的电离平衡常数(25℃),回答下列问题:
酸
电离方程式
电离平衡常数Ka
CH3COOH
CH3COOHCHCOO-+H+
Ka=1.7×10−5
H2CO3
H2CO3 HCO+H+
HCOCO+H+
Ka1=4.2×10−7
Ka2=5.6×10−11
HClO
HClOClO-+H+
Ka=4.7×10−8
H3PO4
H3PO4 H2PO+H+
H2PO+H+
PO+H+
Ka1=7.1×10−3
Ka2=6.2×10−8
Ka3=4.5×10−13
(1)Ka只与温度有关,当温度升高时,Ka值___________(填“增大”、“减小”、“不变”)。
(2)在温度相同时,各弱酸的Ka值不同,那么Ka值的大小与酸性的相对强弱有何关系___________。
(3)若把CH3COOH、H2CO3、HCO、HClO、H3PO4、H2PO、都看作是酸,其中酸性最强的是___________,最弱的是___________。
(4)电离平衡常数是用实验的方法测定出来的,现测得25℃时,c mol∙L−1的CH3COOH的电离度为a,试表示该温度下醋酸的电离平衡常数___________。
(5)根据上表中提供的H2CO3和HClO的电离平衡常数,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是(___________)
A.c(HCO)>c(ClO-)>c(OH-)
B.c(ClO-)>c(HCO)>c(H+)
C.c(HClO)+c(ClO-)=c(HCO)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO)+c(ClO-)+c(OH-)
(6)根据上表中H2CO3和HClO的电离平衡常数,试写出少量CO2通入到NaClO溶液中的化学反应方程式___________。
14.I.25℃时,部分物质的电离平衡常数如表所示:
弱酸或弱碱
电离常数
NH3·H2O
Kb=2×10−5
HClO
Ka=3×10−8
H2CO3
Ka1=4×10−7 Ka2=4×10−11
H2SO3
Ka1=1.3×10−2 Ka2=6.3×10−8
(1)0.1 mol·L−1 NH4ClO溶液中离子浓度由大到小的顺序是_____________________。
(2)等浓度的Na2SO3、NaClO、Na2CO3、NaHCO3溶液,pH由大到小的顺序是________。
(3)某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验,发现两种溶液混合后产生大量的白色胶状沉淀。出现上述现象的原因是____________________(请用反应的离子方程式表示)。
II.用沉淀滴定法快速测定NaI溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液。
i.准备标准溶液
a.准确称取AgNO3基准物4.2468 g(0.0250 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.1000 mol·L−1 NH4SCN标准溶液,备用。
ii.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.1000 mol·L−1 AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000 mol·L−1 NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号
1
2
3
消耗NH4SCN标准溶液体积/mL
10.24
10.02
9.98
f.数据处理。
回答下列问题:
(4)滴定应在pH<0.5的条件下进行,其原因是____________________________。
(5)若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,会导致c(I-)测定结果___________(填“偏高”、“偏低”或“不影响”)。
(6)测得c(I-) = _____________mol·L−1。
15.海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间。
(1)①已知不同pH条件下,水溶液中碳元素的存在形态如图所示。
下列说法不正确的是___________(填字母序号)。
时,溶液中含碳元素的微粒主要是
点,溶液中和浓度相同
当时,
②向上述的水溶液中加入NaOH溶液时发生反应的离子方程式是_______。
(2)海水pH稳定在之间,可用于烟道气中和的吸收剂。
①海水中含有的可以吸收烟道气中的,同时为海水脱钙,生产。写出此反应的离子方程式:___________。
②已知:时,电离平衡常数、,电离平衡常数、,海水中含有的可用于吸收,该过程产物中有和___________。
16.25℃时,有浓度均为0.10mol/L的下列4种溶液:
①NaCN溶液②NaOH溶液③CH3COOH溶液 ④NaHCO3溶液
HCN
H2CO3
CH3COOH
Ka=4.9×10-10mol/L
Ka1=4×10-7mol/L
Ka2=5.6×10-11mol/L
Ka=1.7×10-5mol/L
(1)这4种溶液pH由大到小的顺序是_____(填序号),其中②由水电离的H+浓度为_____。
(2)①中各离子浓度由大到小的顺序是______。向NaCN溶液中通入少量CO2,则发生反应的离子方程式为______.
(3)测得HCN和NaCN的混合溶液的PH=11,,则约为____(保留1位有效数字)。
(4)CH3COOH和CH3COONa混合溶液中,若溶液pH=6则溶液中c(CH3COO-) -c(Na+)=___mol/L(填精确值)。
17.25℃时,三种酸的电离平衡常数如下表所示。
化学式
CH3COOH
HClO
H3PO3
名称
醋酸
次氯酸
亚磷酸
电离平衡常数
1.8×10-5
3.0×10-8
K1=8.3×10-3 K2 =5.6×10-6
(1)浓度均为0.1mol•L-1的CH3COOH 、HClO 、H3PO3溶液中,c(H+)最小的是___。
(2)亚磷酸(H3PO3)为二元酸,H3PO3的电离方程式为_________。Na2HPO3是________(填“酸式盐”“碱式盐”或“正盐”)。
(3)体积均为10mL、c(H+)均为10-2mol • L-1的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中c(H+)的变化如图所示,则HX的电离平衡常数_______(填“大于”、“ 小于”或“等于”,下同)醋酸的电离平衡常数,若pH相等的两种酸消耗等物质的量的NaOH,则需HX和醋酸体积:HX_______________
醋酸
18.已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示:
酸
电离平衡常数
醋酸
碳酸
亚硫酸
(1)根据上表可知,酸性_____ ,在相同条件下,试比较Na2CO3、Na2SO3溶液的pH:Na2CO3_____Na2SO3。(填“>” “<”或 “=”,下同)
(2)向0.1 mol∙L−1的CH3COONa溶液中加入少量下列物质,其水解程度增大的是______。
A NaCl溶液 B Na2CO3固体 C NH4Cl溶液 D CH3COONa固体
(3)已知常温下NH3∙H2O的电离常数 ,则常温下CH3COONH4溶液的pH_______7。
(4)将pH=4的溶液稀释100倍后溶液的pH范围是_______,图中的纵坐标可以是______。
a.溶液的pH
b.醋酸的电离平衡常数
c.溶液的导电能力
d.醋酸的电离程度
(5)NaHSO3是中学化学常见的物质。在水溶液中存在如下两个平衡:
Ka2
Kh2 (水解平衡常数,表示水解程度)
已知25 ℃时,Ka2 > Kh2,则0.1 mol∙L−1 NaHSO3溶液:
①溶液呈__________(填“酸性”“碱性”或“中性”);
②溶液中c(Na+)______c()(填“>”“<”或“=”);
③写出该溶液中的守恒式:
电荷守恒:_____________,物料守恒:________________,质子守恒:_______________。
19.亚砷酸(H3AsO3)可用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示。
回答下列问题:
(1)人体血液的pH在7.35 ~7.45之间,用药后人体中含砷元素的主要微粒是________。
(2)将KOH溶液滴入亚砷酸溶液中,当pH调至9时发生反应的离子方程式为________。
(3)下列说法错误的是________。(填序号)
A.n(H3AsO3)∶n(H2AsO)=1∶1时,溶液显碱性
B.H3AsO3溶液中:c(H2AsO)+2c(HAsO)+3c(AsO)+c(OH-)=c(H+)
C.K3AsO3溶液中:c((AsO)>c(HAsO)>c(H2AsO)>c(H3AsO3)
D.H3AsO3的电离平衡常数Ka1∶Ka2 = 10b+a
(4)P和As位于同主族元素,存在亚磷酸(H3PO3),常温下,0.10 mol·L−1H3PO3溶液的pH =1.6,该酸与足量NaOH溶液反应生成Na2HPO3。
① Na2HPO3为________ (填“正盐”或“酸式盐”);常温下Na2HPO3溶液的pH________7(填“>”“<”或“=”)。
②亚磷酸可由PCl3完全水解制取,反应的化学方程式为________。
③亚磷酸具有强还原性,可使碘水褪色,反应的离子方程式为________。
20.碳酸及碳酸盐与自然界碳的循环有着密切的联系。
(1)已知常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3⇌HCO+ H+的平衡常数K1=____。(已知10-5.60=2.5×10-6)
(2)已知H2CO3的第二级电离常数Ka2=5.6×10-11,HClO的电离常数K=3.0×10-8,写出下列所发生反应的离子方程式:
a.少量Cl2通入过量的Na2CO3溶液中:____。
b.少量CO2通入过量的NaClO溶液中:____。
(3)人体血液里主要通过碳酸氢盐缓冲体系()维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,≈,1g2=0.3。由题给数据可算得正常人体血液的pH约为_____,当过量的酸进入血液中时,血液缓冲体系中的值将____(填“变大、变小、不变”)。
(4)NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO、CO三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为____之间
21.(1)已知常温时,a mol/L醋酸在水中有0.1 mol/L NaOH等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=___________________(用含a的代数式表示)。
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是______________。
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
Ka=1.8×10-5
Ka1=4.3×10-7 Ka2=5.6×10-11
Ka=3.0×10-8
①物质的量浓度均为0.1 mol/L的四种溶液:pH由小到大排列的顺序是____________(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:_____________________________。
22.弱酸HA的电离常数Ka=。25℃时,几种弱酸的电离常数如下:
弱酸化学式
HNO2
CH3COOH
HCN
H2CO3
电离常数
5.1×10-4
1.8×10-5
6.2×10-10
K1=4.4×10-7
K2=4.7×10-11
(1)根据上表数据填空:
①pH相同的四种酸,其物质的量浓度由小到大的顺序是___。
②分别向相同pH的HCl溶液和HNO2溶液中加入等量的Zn粉,反应刚开始时产生H2的速率:v(HCl)___>v(HNO2)(填“=”、“>”或“<”,下同)。反应完全后,若得到等量的氢气,则所消耗的酸的体积:V(HCl)___V(HNO2)。
③将过量的HCN溶液与Na2CO3溶液等体积混合,发生反应的化学方程式为__。
(2)体积均为10mL、pH均为2的CH3COOH与HNO2分别加水稀释至1000mL。稀释前,两溶液中的离子浓度c(CH3COO‒)_______c(NO)(填“>”“<"或“=”)。稀释后,两溶液中水的电离程度CH3COOH____HNO2(填“>”“<"或“=”)。
(3)常温下,向HCN溶液中加入NaCN固体,则c(OH-)将___(填“变大”变小”或“不变”),将_________(填“变大”“变小”或“不变”)。
参考答案
1.增大 HCN BD 由于一级电离产生氢离子,增大了溶液中氢离子浓度,使电离平衡向左移动 能 往石灰石中加入醋酸,观察是否有气体产生
【详解】
(1) 弱酸的电离吸热,当温度升高时,促进电离,则值增大;
(2)①K值越大、电离程度越大、酸性越强,上述四种酸中,酸性最弱、最强的酸分别是HCN、 (用化学式表示);
②A.弱酸的电离吸热,当温度升高时,促进电离,则值增大,A不满足;
B.越稀越电离。加水稀释,促进电离,温度不变值不变,B满足;
C.加少量的固体,醋酸根离子浓度增大、抑制电离,温度不变值不变,C不满足;
D.加少量冰醋酸,增大反应物浓度、促进电离,温度不变值不变,D满足;
E.加氢氧化钠固体,发生反应、大量放热,温度升高, 值增大,E不满足;
答案为BD。
③醋酸酸性大于次氯酸,醋酸和次氯酸钠溶液能发生复分解反应,生成次氯酸和醋酸根离子。离子方程式为。
(3)多元弱酸分步电离。已知草酸是一种二元弱酸,则草酸的一级电离方程式、二级电离方程式。由于一级电离产生氢离子,增大了溶液中氢离子浓度,使电离平衡向左移动,导致。
(4)用食醋浸泡有水垢的水壶,可以清除其中的水垢,则水垢中的碳酸钙和食醋发生了反应,故通过该事实能比较:醋酸酸性大于碳酸。实验中可依据强酸制备弱酸的原理来证明酸性强弱。则要通过实验验证醋酸与碳酸的酸性强弱,方案为往石灰石中加入醋酸,观察是否有气体产生,若有气体产生可证明醋酸的酸性大于碳酸。
2.盐酸稀释后的pH=5,而醋酸溶液稀释100倍后溶液的pH<5 1×10−4 1×10−7 106 > ClO-+ CO2 + H2O = + HClO bd
【详解】
(1)为了证明醋酸是弱电解质,某同学分别取pH=3醋酸和盐酸各1mL,分别用蒸馏水稀释到100mL,然后用pH试纸分别测定两溶液的pH,则可认定醋酸是弱电解质,根据强酸稀释10n倍,pH变化n个单位,弱酸变化不到n个单位,因此判断的依据是盐酸稀释后的pH=5,而醋酸溶液稀释100倍后溶液的pH<5;故答案为:盐酸稀释后的pH=5,而醋酸溶液稀释100倍后溶液的pH<5。
(2)已知室温时,0.1 mol∙L−1某一元酸HA在水中有0.1%发生电离,
①HA只有0.1%电离,则0.1%的HA电离出的氢离子浓度c(H+)= 0.1 mol∙L−1×0.1%=1×10−4 mol∙L−1;故答案为:1×10−4。
②HA的电离平衡常数;故答案为:1×10−7。
③由HA电离出的c(H+)= 1×10−4 mol∙L−1,c(OH-)= 1×10−10 mol∙L−1,则HA电离出的c(H+)约为水电离出的c(H+)的倍;故答案为:1×106。
(3)①根据电离平衡常数得到酸强弱顺序为HCOOH>H2CO3>HClO>,相同浓度酸越强其电离出的离子浓度越大,溶液导电性越强,因此溶液导电能力:HCOOH>HClO;故答案为:>。
②的电离方程式为 H++,其电离平衡常数表达式为;故答案为:。
③根据酸的强弱顺序,将少量CO2气体通入NaClO溶液中,该反应离子方程式ClO-+ CO2+ H2O = + HClO;故答案为:ClO-+ CO2+ H2O = + HClO。
(4)a.适当升高温度,平衡正向移动铵根浓度、氢氧根浓度增大,故a不符合题意;
b.加入NH4Cl固体,铵根离子浓度增大,平衡逆向移动,氢氧根浓度减小,故b符合题意;
c.通入NH3,氨水浓度增大,平衡正向移动,铵根离子浓度、氢氧根浓度增大,故c不符合题意;
d.加入少量浓盐酸,氢离子消耗氢氧根,平衡正向移动,铵根离子浓度增大,故d符合题意;
综上所述,答案为:bd。
3.CN-+H2O⇌HCN+OH- CN-+CO2+H2O=HCN+ HCO 2.010-13 AC ③②①④
【分析】
酸的电离平衡常数越大,酸性越强,根据电离常数可知,酸性由强到弱的顺序为:H2C2O4>HCOOH> HC2O>H2CO3>HCN> HCO,判断溶液中的反应能否进行可根据强酸制弱酸的原理;利用水解平衡常数的表达式计算。
【详解】
(1) NaCN为强碱弱酸盐,水解呈碱性,反应的离子方程式为:CN-+H2O⇌HCN+OH-;根据强酸制弱酸的原理,H2CO3>HCN> HCO
(3)根据强酸制弱酸的原理:
A.HCOOH> HCO,HCOOH+Na2CO3=NaHCO3+HCOONa可以发生,故A符合;
B.H2C2O4>HCOOH,HCOOH+NaHC2O4=HCOONa+H2C2O4不能发生,故B不符合;
C.H2C2O4> HCN,H2C2O4+2NaCN=Na2C2O4+2HCN可以发生,故C符合;
D.H2CO3>HCN>,NaHCO3+HCN=NaCN+H2O+CO2↑不能发生,故D不符合;
故答案为:AC;
(4) HCOOH会抑制水的电离,25℃时,pH=3的HCOOH溶液中由水电离出的c(H+)=;氯化铵溶液中氢离子就是水电离出的,则室温下pH=3的NH4Cl溶液中由水电离出的c(H+)=1.010-3mol•L-1,故两溶液中由水电离出的c(H+)之比为:1;故答案为:;
(5)混合溶液中电荷守恒的等式为:,pH<7说明,所以,该溶液中离子浓度大小顺序为:,即③②①④,故答案为:③②①④。
【点睛】
本题考查弱电解质的电离,明确酸的电离平衡常数与酸性强弱关系、与其对应酸根离子水解程度关系是解本题关键。
4.d>c>b>a < CH3COOH电离常数大于CH3COO-水解常数 ClO-+H2O+CO2=HCO+HClO c(HCO)+c(H+) 酚酞
【分析】
电离平衡常数衡量弱电解质电离程度,电离平衡常数越大,电离程度越大,电离出H+能力大小顺序是CH3COOH>H2CO3>HClO>HCO;
【详解】
(1)根据上述分析,利用盐类水解规律“越弱越水解”,结合H+能力由大到小的顺序是CO>ClO->HCO>CH3COO-;故答案为d>c>b>a;
(2)常温下,0.2mol·L-1CH3COOH溶液与等体积0.1mol·L-1NaOH溶液充分混合,反应后溶质为CH3COOH和CH3COONa,且两者物质的量浓度相等,CH3COO-的水解常数为Kh=<1.8×10-5,CH3COO-的水解程度小于CH3COOH的电离程度,溶液显酸性,即c(CH3COOH)<c(CH3COO-);故答案为<;CH3COOH电离常数大于CH3COO-水解常数;
(3)电离出H+能力大小顺序是CH3COOH>H2CO3>HClO>HCO,次氯酸钠溶液中通入少量的CO2的离子方程式为ClO-+CO2+H2O=HClO+HCO;故答案为ClO-+CO2+H2O=HClO+HCO;
(4)等体积混合后,溶液恰好显中性,即c(H+)=c(OH-)=10-7mol·L-1,根据电荷守恒,有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),得出c(Na+)=c(CH3COO-)=,根据物料守恒,c(CH3COOH)+c(CH3COO-)=,推出混合溶液中c(CH3COOH)=,醋酸的电离平衡常数Ka==;故答案为;
(5)CO2的物质的量为0.1mol,NaOH的物质的量为0.2mol,n(CO2):n(NaOH)=0.1:0.2=1:2,0.1molCO2通入0.2molNaOH溶液中,反应只生成Na2CO3,根据质子守恒,有c(OH-)=2c(H2CO3)+c(HCO)+c(H+);故答案为c(HCO)+c(H+);
(6)醋酸为弱酸,反应后溶质为CH3COONa,溶液显碱性,因此选择指示剂的变色范围与反应后溶液的酸碱性一致,即指示剂为酚酞;故答案为酚酞。
【点睛】
易错点是问题(4)的计算,电离平衡常数只受温度影响,注意因为是等体积混合,浓度应为原来的一半。
5.③④⑤⑦ 2 碱性 a>c>b 0.102
【分析】
【详解】
(1) ①Cu 是单质,既不是电解质又不是非电解质;
②SO2 自身不能电离,SO2属于非电解质;
③冰醋酸的水溶液能导电,冰醋酸是电解质;
④NaHCO3的水溶液能导电,NaHCO3是电解质;
⑤Cu(OH )2 是碱,Cu(OH )2是电解质;
⑥H2SO4溶液是混合物,既不是电解质又不是非电解质;
⑦NaCl的水溶液能导电,NaCl是电解质;其中属于电解质的是③④⑤⑦;
(2)时,溶液中c(H+)=0.01mol/L,pH=2;
(3)①由上表数据可知,亚硫酸是弱酸,Na2SO3是强碱弱酸盐,SO能发生水解反应,溶液呈碱性;
②醋酸的电离平衡常数Ka>亚硫酸的第二步电离平衡常数Ka2>碳酸的第二步电离平衡常数Ka2,所以水解程度CO> SO>CH3COO-,时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液的pH由大到小的顺序为:Na2CO3> Na2SO3>CH3COONa;
③当c(OH-)降至1.0×10-8mol/L时,c(H+)=1.0×10-6mol/L,=1.02×10-7, = =0.102。
6.增大 减小 10−7.5 差 温度升高,(溶解)平衡①逆向移动,Cl2(aq)浓度减小,使得(化学平衡)②逆向移动,c(HClO)减小,杀菌效果变差
【详解】
(1)向0.1 mol·L-1的NaHSO3溶液中加入少量氢氧化钠固体,氢氧根浓度增加,氢离子浓度减小,因此增大,没有加入NaOH固体时,由于亚硫酸氢根电离程度小,因此很大,加入NaOH固体,氢氧根不断消耗亚硫酸氢根生成亚硫酸根,假设恰好反应完生成亚硫酸钠,则比值等于2,因此减小;故答案为:增大;减小。
(2)①上述电离平衡的是HClOH+ + ClO-,其平衡常数表达式为K=
,根据图中pH=7.5时,次氯酸和次氯酸根的浓度相等,因此该常数值为K=;故答案为:;10−7.5。
②用氯处理饮用水时,由于夏季温度高,氯气在水中溶解度小,即(溶解)平衡①逆向移动,Cl2(aq)浓度减小,使得(化学平衡)②逆向移动,溶液中的次氯酸浓度小,因此夏季的杀菌效果比冬季差;故答案为:差;温度升高,(溶解)平衡①逆向移动,Cl2(aq)浓度减小,使得(化学平衡)②逆向移动,c(HClO)减小,杀菌效果变差。
7.Al3++3HCO=Al(OH)3↓+3CO2↑ ClO-+CO2+H2O=HClO+HCO CO>ClO->HCO>CH3COO- 酸性 c(K+)>c(C2O)>c(OH-)>c(HC2O)>c(H+) 103.0
【详解】
(1)泡沫灭火器是将Al2(SO4)3溶液和NaHCO3溶液混合,有白色沉淀产生同时释放出CO2,其反应离子方程式Al3++3HCO=Al(OH)3↓+3CO2↑;故答案为:Al3++3HCO=Al(OH)3↓+3CO2↑。
(2)①根据电离平衡常数得到酸性:CH3COOH>H2CO3>HClO>,因此少量CO2通入NaClO溶液中反应的离子方程式ClO-+CO2+H2O=HClO+HCO;故答案为:ClO-+CO2+H2O=HClO+HCO。
②根据电离平衡常数得到酸性:CH3COOH>H2CO3>HClO>,对应的酸越弱,结合氢离子能力越强,因此CO、HCO 、ClO-、CH3COO-结合质子能力由强到弱的顺序为CO>ClO->HCO>CH3COO-;故答案为:CO>ClO->HCO>CH3COO-。
(3)①根据草酸和草酸氢根的交叉点得到,根据草酸氢根和草酸根的交叉点得到,如果所得溶液溶质为KHC2O4,,即草酸根电离大于水解,则该溶液显酸性;故答案为:酸性。
②如果所得溶液溶质为K2C2O4,草酸根水解生成草酸氢根和氢氧根,水电离出氢离子和氢氧根,则该溶液中各离子浓度由大到小顺序为c(K+)>c(C2O)>c(OH-)>c(HC2O)>c(H+);故答案为:c(K+)>c(C2O)>c(OH-)>c(HC2O)>c(H+)。
③根据题意得到溶液中;故答案为:103.0。。
8.醋酸 ad 11 > a>b>d>c
【详解】
(1)醋酸是弱酸,盐酸是强酸,pH相等的醋酸和盐酸,加水稀释过程中,醋酸可以继续电离出氢离子导致稀释相同倍数时的pH:醋酸<盐酸,所以pH变化大的是盐酸、变化小的是醋酸,根据图知,上边曲线表示盐酸、下边曲线表示醋酸,所以a点对应的酸为醋酸;
加水稀释促进醋酸的电离,但醋酸电离增大的程度小于溶液体积增大的程度,所以溶液中c(H+)、c(CH3COOH)、c(CH3COO-)都减小,温度不变,水的离子积常数不变,则溶液中c(OH-)增大:
a.加水稀释促进醋酸的电离,但醋酸电离增大的程度小于溶液体积增大的程度,所以溶液中c(H+)变小,故a正确;
b.溶液中c(H+)减小,温度不变,水的离子积常数不变,则溶液中c(OH-)增大,故b错误;
c. ==,温度不变、水的离子积常数和醋酸的电离平衡常数不变,所以该比值不变,故c错误;
d.加水稀释促进醋酸的电离,则醋酸的物质的量减小、氢离子物质的量增大,所以变小,故d正确;答案选:ad;
(2)水的离子积常数Kw= c(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-12,100mL 0.1 mol·L-1的稀H2SO4中氢离子的物质的量为:0.1mol/L×2×0.1L=0.02mol,100mL0.4 mol·L-1的NaOH溶液中氢氧根离子的物质的量为:0.4mol/L×0.1L=0.04mol/L,两溶液混合时氢氧根离子过量,所得溶液中c(OH-)==0.1mol/L,溶液中c(H+)==10-11mol/L,则溶液的pH=11;
(3)若醋酸和氢氧化钠恰好完全反应,所得溶液中的溶质为醋酸钠,醋酸钠是强碱弱酸盐,醋酸根离子水解使溶液呈碱性,25℃时,将 a mol·L-1的醋酸和 b mol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,说明醋酸过量,则a>b;根据物料守恒可知,c(CH3COO-)+c(CH3COOH)== mol/L;
(4)AgCl在溶液中存在溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq),溶液中Ag+、Cl-都抑制AgCl溶解,且这两种离子浓度越大,其抑制AgCl溶解的程度越大,①中c(Cl-)=0、②中c(Cl-)=0.2mol/L、③中c(Cl-)=1mol/L、④中c(Cl-)=0.3mol/L,则抑制AgCl溶解程度的大小顺序是:③>④>②>①,所以Ag+的浓度由大到小的排列顺序是:a>b>d>c。
9. 不变 11 b B
【详解】
(1)①醋酸为弱酸,每稀释倍,pH变化小于n个单位,10 mL 0.1 mol·L-1醋酸溶液加水稀释至1 000 mL,pH值小于5,大于3,,稀释过程中K保持不变,故不变,故答案为:;不变;
②0.1 mol·L-1醋酸溶液测得其pH=3,,25 ℃时,CH3COOH和NH3·H2O的电离常数相等,则Kb(NH3·H2O)=10-5,由此可求c(OH-)=10-3mol·L-1,pH=11,故答案为:11;
(2)=, 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中氢氧根浓度减小,则比值增大,比值增大,故选b,
故答案为:b;
(3)若某时刻时,测得c(N2)=1 mol·L-1,c(H2)=3 mol·L-1,c(NH3)=2 mol·L-1,,则反应向逆向进行,故答案为:B;
10.NH3.H2O NH+OH- HCO+ H2OH2CO3+ OH- 测0.1 mol·L-1醋酸的pH值,若pH>1,则为弱酸 < < > Al3++3HCO= Al(OH)3↓+3CO2↑ (a-10 -b )×10 2b -14(写成准确值计算式也可得分)[(a-10-b+10b-14) 10b-14]/(10-b-10b-14)
【详解】
(1) 氨水中存在NH3.H2O NH+OH-,溶液呈碱性,所以氨水中滴入酚酞显红色;碳酸氢钠是强碱弱酸盐,碳酸氢根离子水解HCO+ H2OH2CO3+ OH-,碳酸氢钠溶液呈碱性,所以滴入酚酞也显红色;
(2)若醋酸是弱酸,醋酸部分电离,0.1 mol·L-1醋酸溶液中氢离子浓度小于0.1 mol·L-1,测0.1 mol·L-1醋酸的pH值,若pH>1,则为弱酸;
(3)0.1 mol·L-1氨水分别与等浓度的盐酸、醋酸等体积混合,恰好生成氯化铵、醋酸铵,氯化铵溶液呈酸性,醋酸铵溶液呈中性,所得溶液的pH值前者<后者;氯化铵溶液中铵根离子水解,醋酸铵溶液中铵根离子、醋酸根离子发生双水解反应,所以水的电离程度前者<后者;氨水的电离平衡常数大于碳酸的电离平衡常数Ka1,铵根离子水解程度小于碳酸氢根离子水解,等浓度的NH4Cl和NaHCO3溶液中,c(NH)>c(HCO);
(4) 泡沫灭火器中NaHCO3和硫酸铝发生双水解反应生成氢氧化铝沉淀和二氧化碳,反应的离子方程式为Al3++3HCO= Al(OH)3↓+3CO2↑;
(5)常温下,浓度为a mol·L-1的NH4Cl溶液pH=b, ,,,则NH3·H2O 的电离平衡常数Kb=(a-10 -b )×10 2b -14。
11.H2N2O2⇋+H+、HN2O2-⇋+H+ > > c Cu2+水解产生Cu(OH)2是吸热反应,加热促进水解,产生浑浊 H2SO4溶液 碱 B 10-9
【分析】
(一)0.01mol/L的H2N2O2溶液pH=4.3,说明该二元酸部分电离,为二元弱酸;
(二)(1)Cu2+水解产生Cu(OH)2是吸热反应,加热促进水解,产生浑浊;.
(2)碳酸根离子分步水解,第一步水解方程式为:+H2O⇌+OH-;比较第一步水解的平衡常数与NH4+水解的平衡常数可知溶液呈碱性;
【详解】
(一)①0.01mol/L的H2N2O2溶液pH=4.3,说明该二元酸部分电离,为二元弱酸,分两步电离,其电离方程式为H2N2O2⇋+H+、HN2O2-⇋+H+;
②b点溶液中溶质为NaHN2O2,溶液的pH>7,溶液呈碱性,说明HN2O2-水解程度大于电离程度,则c(H2N2O2)>c(),故答案为:>;
③a点pH=7,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(Na+)=c()+2c(),所以c(Na+)>c()+c(),故答案为:>;
④a点不影响水电离,b和c都促进水电离且水电离程度:b点<c点,则水电离成对最大的是c,故答案为:c;
(二)(1)硫酸铜属于强酸弱碱盐,在水中会发生水解,水解反应是吸热反应,升高温度将增大其水解程度而生成Cu(OH)2使溶液浑浊;因此需要加入酸抑制其水解,根据硫酸铜中阴离子种类可知,用热水配制出澄清的较浓的CuSO4溶液时应再加入少量H2SO4溶液,故答案为:Cu2+水解产生Cu(OH)2是吸热反应,加热促进水解,产生浑浊;H2SO4溶液;
(2)①-第一步水解的平衡常数大于水解的平衡常数大,可知溶液呈碱性;
②A.溶液中铵根离子浓度大于碳酸根离子浓度,碳酸根离子水解程度大于铵根离子水解程度,所以溶液中离子浓度大小为:c(NH4+)>c()>c()>c(NH3•H2O),故A正确;
B.溶液中存在电荷守恒为:c(NH4+)+c(H+)=c()+c(OH-)+2c(),故B错误;
C.依据溶液中物料守恒得到:c()+c()+c(H2CO3)=0.1mol•L-1 ,故C正确;
D.依据溶液中物料守恒,n(N):n(C)=2:1,结合溶液中离子种类和守恒关系得到:c()+c(NH3•H2O)=2c()+2c()+2c(H2CO3),故D正确;故选:B;答案为:碱;B;
(3)盐酸和醋酸钠之间反应生成氯化钠和醋酸,溶液显示中性,所以醋酸钠会剩余,c(H+)=c(OH-)=10-7mol/L,根据电荷守恒,c(Cl-)=0.5bmol/L,c(CH3COO-)+c(Cl-)=c(Na+)=0.5amol/L,所以c(CH3COO-)=(0.5a-0.5b)mol/L,醋酸的电离常数 ;
(4)0.1 mol/L的HB溶液在常温下的pH=3,HB在水中电离方程式:HBH++B-,pH=3,则c(H+)=10-3mol/L,不考虑水的电离,则,则,则,故答案为:10-9。
12. BD CH3COONa c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H+)
【详解】
(1)碳酸的第二步电离方程式是: ,则:Ka2=;
(2) ,加入醋酸钠固体,醋酸根离子浓度增大,平衡逆向移动,氢离子浓度减少,醋酸的电离程度减少,而醋酸的电离常数只与温度有关,即温度不变,电离常数不变,
故答案为:BC;
(3) CH3COONa、NaHCO3、Na2SO3均能水解,它们的溶液均显碱性,由表中数据可知,酸性:醋酸大于碳酸,碳酸大于亚硫酸根离子,故水解程度:亚硫酸根离子大于碳酸氢根离子,碳酸氢根离子大于醋酸根离子,因此物质的量浓度相等时,溶液的碱性:亚硫酸钠大于碳酸氢钠,碳酸氢钠大于醋酸钠,若溶液的pH相等,即碱性相同,则物质的量浓度最大的是CH3COONa;
(4) , , ,则Na2CO3溶液中各离子浓度由大到小的顺序为c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H+)。
13.增大 Ka值越大,酸性越强 A CO2+H2O+NaClO=NaHCO3+HClO
【详解】
(1)弱电解质的电离是吸热过程,当温度升高时,平衡正向移动,Ka值增大;故答案为:增大。
(2)在温度相同时,电离平衡常数越大,则酸越强;故答案为:Ka值越大,酸性越强。
(3)根据Ka值越大,酸越强,CH3COOH、H2CO3、HCO、HClO、H3PO4、H2PO、都看作是酸,因此酸性最强的是H3PO4,最弱的是;故答案为:H3PO4;。
(4) 25℃时,cmol∙L−1的CH3COOH的电离度为a,根据题意得出电离的醋酸浓度为camol∙L−1,c(H+) = c(CH3COO-) = camol∙L−1,c(CH3COOH) =c(1-a)mol∙L−1,该温度下醋酸的电离平衡常数Ka=;故答案为:。
(5)根据题意得出酸强弱顺序为H2CO3>HClO,根据对应的酸越弱,其水解程度越大,因此等浓度的NaClO、NaHCO3混合溶液中,ClO-水解程度大于HCO水解程度,因此离子浓度为c(HCO)>c(ClO-)>c(OH-);按照物料守恒得到c(HClO)+c(ClO-)=c(HCO)+c(H2CO3) +c(CO);按照电荷守恒得到c(Na+)+c(H+)=c(HCO)+c(ClO-)+c(OH-) +2c(CO);故答案为A。
(6) 根据题意得出酸强弱顺序为H2CO3>HClO>HCO,少量CO2通入到NaClO溶液中生成HCO和HClO,其化学反应方程式CO2+H2O+NaClO=NaHCO3+HClO;故答案为:CO2+H2O+NaClO=NaHCO3+HClO。
14.c(NH) > c(ClO-) > c(OH-) > c(H+) Na2CO3 > NaClO > Na2SO3 > NaHCO3 Al3+ + 3ClO- + 3H2O=Al(OH)3↓+3HClO 防止因Fe3+水解而影响滴定终点的判断 偏高 0.0600
【详解】
(1)根据电离平衡常数NH3·H2O的 Kb=2×10−5,HClO 的 Ka=3×10−8,次氯酸根水解显碱性,铵根水解显酸性,根据越弱越水解,次氯酸根水解程度大于铵根水解程度,溶液显碱性,因此0.1 mol·L−1 NH4ClO溶液中离子浓度由大到小的顺序是c(NH) > c(ClO-) > c(OH-) > c(H+);故答案为:c(NH) > c(ClO-) > c(OH-) > c(H+)。
(2)根据电离平衡常数得到酸强弱顺序:H2SO3>H2CO3>>HClO>,根据对应的酸越弱,其水解程度越大,碱性越强,因此等浓度的Na2SO3、NaClO、Na2CO3、NaHCO3溶液,pH由大到小的顺序是Na2CO3 > NaClO > Na2SO3 > NaHCO3;故答案为:Na2CO3 > NaClO > Na2SO3 > NaHCO3。
(3)根据题意说明Al3+和ClO-发生双水解生成氢氧化铝沉淀和次氯酸,其离子方程式为Al3+ + 3ClO- + 3H2O=Al(OH)3↓+3HClO;故答案为:Al3+ + 3ClO- + 3H2O=Al(OH)3↓+3HClO。
(4)由于铁离子发生水解而影响滴定终点的判断,因此滴定应在pH<0.5的条件下进行;故答案为:防止因Fe3+水解而影响滴定终点的判断。
(5)若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则配制出的硝酸银浓度偏低,取等量的硝酸银,物质的量减少,则消耗的NH4SCN溶液的体积偏低,得到碘离子的量增大,因此会导致c(I-)测定结果偏高;故答案为:偏高。
(6)根据三次数据得出第一次数据是错误的数据,因此消耗NH4SCN标准溶液平均体积为10.00 mL,根据Ag+~I-~AgI,则n(I-) = 0.1000 mol·L−1×0.025L-0.1000 mol·L−1×0.01L =0.0015mol,;故答案为:0.0600。
15.bc
【详解】
(1)①a.图象分析可知,pH=8时主要存在的微粒是碳酸氢根离子,溶液中含碳元素的微粒主要是,故a说法正确;
b.A点是碳酸氢根离子物质的量分数和二氧化碳的碳酸溶液中物质的量分数相同,溶液中和浓度不相同,故b说法错误;
c.图象分析可知当时,pH=10溶液显碱性,,故c说法错误;
故答案为:bc;
②pH=8.4的水溶液中主要是碳酸氢钠溶液,加入NaOH溶液时发生反应为碳酸氢钠和氢氧化钠溶液反应生成碳酸钠和水,反应的离子方程式为:;
故答案为:;
(2)①海水中钙离子在碱溶液中和二氧化碳反应生成碳酸钙沉淀和水,反应的离子方程式为:;
答案为:;
②25℃时,电离平衡常数,HSO3电离平衡常数,电离出H+能力的顺序,海水中含有的可用于吸收,反应生成生成二氧化碳和亚硫酸氢根离子,反应的离子方程式为:,该过程产物中有和;
故答案为。
16.②①④③ 10-13mol/L Na+>CN->OH->H+ CN-+CO2+H2O=HCN+ 0.02 9.9×10-7
【详解】
(1) ①NaCN溶液因水解呈碱性,②NaOH溶液因电离呈碱性,③CH3COOH溶液 呈酸性,④NaHCO3溶液因水解呈碱性,由电离平衡常数知,碳酸氢钠溶液水解程度小于NaCN溶液,故25℃时,浓度均为0.10mol/L的下列4种溶液pH由大到小的顺序是②①④③,其中②中氢氧化钠电离抑制了水的电离,由水电离的H+浓度即氢离子浓度为。
(2)①中NaCN溶液因水解呈碱性,各离子浓度由大到小的顺序是Na+>CN->OH->H+。HCN的电离平衡常数介于碳酸的Ka1和Ka2之间,故向NaCN溶液中通入少量CO2生成HCN和碳酸氢钠,则发生反应的离子方程式为CN-+CO2+H2O=HCN+。
(3)测得HCN和NaCN的混合溶液的PH=11,则。
(4)CH3COOH和CH3COONa混合溶液呈电中性,c(CH3COO-) +c(OH-)= c(H+)+c(Na+),若溶液pH=6,则溶液中c(CH3COO-) -c(Na+)= c(H+)-c(OH-)=10-6 mol/L -0-8mol/L=9.9×10-7 mol/L。
17.HClO , 正盐 大于 大于
【详解】
(1)HClO的电离平衡常数最小,其溶液中c(H+)也是最小的;
(2)亚磷酸为二元弱酸,其电离方程式为,;由此可知,不能再电离出H+,则Na2HPO3是正盐;
(3)稀释溶液后,HX的pH变化量较大,说明HX的酸性比醋酸强,故HX的电离平衡常数大于醋酸的电离平衡常数;pH相同的情况下,HX的浓度更小,消耗等物质的量的NaOH时,意味着参加反应的HX和醋酸的物质的量相同,故HX的体积大于醋酸的体积。
18.< > AC = 4<pH<6 c 酸性 > c(Na+)+ c(H+)=c()+2c()+c() c(Na+) = c()+c()+c() c(H+)+ c()= c()+c()
【详解】
(1)根据上表可知,碳酸的小于亚硫酸的,因此酸性<,根据对应的酸越弱,其水解程度越大,在相同条件下,Na2CO3、Na2SO3溶液的pH:Na2CO3>Na2SO3;故答案为:<;>。
(2)A.加入NaCl溶液实质是加水,加水稀释,平衡正向移动,水解程度程度增大,故A符合题意;B.加入Na2CO3固体,两者相互抑制的双水解,故B不符合题意;C.加入NH4Cl溶液,两者相互促进的双水解,水解程度增大,故C符合题意;D.加CH3COONa固体,平衡正向移动,但水解程度减小,故D不符合题意;综上所述,答案为:AC。
(3)常温下NH3∙H2O的电离常数,醋酸的电离常数,因此生成是弱酸弱碱盐,水解程度相当,溶液呈中性,则常温下CH3COONH4溶液的pH =7;故答案为:=。
(4)将pH=4的溶液稀释100倍,稀释时,醋酸又电离出氢离子,因此溶液pH变化不到2个单位,因此稀释后溶液的pH范围是4<pH<6,加水稀释,醋酸电离平衡正向移动,电离程度增大,溶液的pH增大,醋酸电离平衡常数不变,离子浓度减小,溶液导电性能力减弱,因此图中的纵坐标可以是c;故答案为:4<pH<6;c。
(5)①已知25 ℃时,Ka2 > Kh2,说明电离程度大于水解程度,因此0.1 mol∙L−1 NaHSO3溶液呈酸性;故答案为:酸性。
②溶液中亚硫酸根既要电离又要水解,因此溶液中c(Na+)>c();故答案为:>。
③电荷守恒:c(Na+)+ c(H+)=c()+2c()+c(),物料守恒:c(Na+) = c()+c()+c(),质子守恒:c(H+)+ c()= c()+c();故答案为:c(Na+)+ c(H+)=c()+2c()+c();c(Na+) = c()+c()+c();c(H+)+ c()= c()+c()。
19.H3AsO3 H3AsO3 + OH-= H2AsO+ H2O D 正盐 > PCl3+3H2O=H3PO3+3HCl H3PO3+I2+H2O= 2H++2I-+H3PO4
【详解】
(1)根据图像可知pH在7.35 ~7.45之间时,As元素主要存在形式为H3AsO3;
(2)根据题意可知亚砷酸溶液中pH减小时H3AsO3 首先转化为H2AsO,pH=9时主要以H3AsO3 和H2AsO的形式存在,所以发生的离子方程式为H3AsO3 + OH-= H2AsO+ H2O;
(3)A.据图可知n(H3AsO3):n(H2AsO)=1:1时,溶液的pH约为9,呈碱性,故A正确;
B.H3AsO3溶液中存在电荷守恒:c(H2AsO)+2c(HAsO)+3c(AsO)+c(OH-)=c(H+),故B正确;
C.K3AsO3溶液中As元素的主要存在形式为AsO,结合图像可知AsO占比最大时溶液中的离子浓度c((AsO)>c(HAsO)>c(H2AsO)>c(H3AsO3),故C正确;
D.Ka1=,据图可知当n(H3AsO3)=n(H2AsO3-)时溶液的pH为a,即c(H+)=10-amol/L,所以Ka1=10-a,同理Ka2=10-b,则Ka1∶Ka2 =10-a:10-b=10b-a,故D错误;
综上所述答案为D;
(4)①亚磷酸与足量NaOH溶液反应生成Na2HPO3,说明Na2HPO3不能电离出氢离子,所以Na2HPO3为正盐;0.10 mol·L−1H3PO3溶液的pH =1.6,说明亚磷酸为弱酸,所以Na2HPO3溶液中存在HPO的水解,溶液显碱性,pH>7;
②水解反应为非氧化还原反应,根据元素守恒可得化学方程式为PCl3+3H2O=H3PO3+3HCl;
③亚磷酸具有强还原性,可使碘水褪色,即碘单质可以氧化亚磷酸,根据电子守恒和元素守恒可得离子方程式为H3PO3+I2+H2O= 2H++2I-+H3PO4。
20.4.17×10-7 Cl2+2CO+H2O=2 HCO+Cl-+ClO- CO2+H2O+ClO-=HClO +HCO 7.4 变小 7~9
【详解】
(1)溶液的pH=5.60,则c(H+)=10-5.6mol/L=2.5×10-6mol/L,若忽略水的电离及H2CO3的第二级电离,该溶液中c(HCO)=c(H+)=2.5×10-6mol/L,c(H2CO3)为1.5×10-5 mol•L-1,则H2CO3⇌HCO3-+H+的平衡常数K1===4.17×10-7;
(2)根据电离平衡常数大小关系可知酸性H2CO3>HClO> HCO,HCl为强酸,所以:
a.少量Cl2通入到过量的Na2CO3溶液中,氯气和水反应生成少量的HCl、HClO,酸性越强结合氢离子的能力越弱,而氢离子少量,所以只有碳酸根结合氢离子生成碳酸氢根,最终的产物为氯化钠、次氯酸钠、碳酸氢钠,所以离子方程式为Cl2+2CO+H2O=2 HCO+Cl-+ClO-;
b.由于酸性H2CO3>HClO> HCO,根据强酸可以制弱酸可知:少量CO2通入过量的NaClO溶液中生成碳酸氢钠和次氯酸,离子方程式为CO2+H2O+ClO-=HClO +HCO;
(3) K1=,≈,所以c(H+)=,则pH=-lg=7.4;酸性增强,则c(H+)变大,而温度不变则K1不变,所以变小;
(4) 由图可知,溶液的pH为7~9之间时,溶液中的阴离子主要以HCO形式存在,溶液中的溶质主要为碳酸氢钠,所以若用CO2和NaOH反应制取NaHCO3,溶液的pH应该控制在7~9之间。
21.(a-0.1)×10-6 c>b>a a<d<c<b ClO-+H2O+CO2=+HClO
【详解】
(1)混合后的溶液,根据电荷守恒有:c(H+)+c(Na+)=c(OH-)+c(CH3COO-),溶液呈中性,故而有:c(Na+)=c(CH3COO-)。设混合前两溶液体积均为V,则混合后溶液中c(CH3COO-)=c(Na+)=mol/L,c(CH3COOH)==mol/L,Kh= ==(a-0.1)×10-6;
(2)溶液体积越大,醋酸电离程度越大,根据图知,溶液体积:a<b<c,则醋酸电离程度:c>b>a;
(3)①据电离平衡常数可知,酸性由强到弱的顺序为:CH3COOH>H2CO3>HClO>HCO3﹣,弱酸的酸性越弱其酸根离子的水解程度越大,溶液碱性越强,则pH由小到大排列顺序是a<d<c<b,故答案为:a<d<c<b;
②酸性:HClO>HCO3﹣,向次氯酸钠溶液中通入少量二氧化碳,反应生成碳酸氢根离子,该反应的离子方程式为:ClO﹣+H2O+CO2=HCO3﹣+HClO。
22.HNO2<CH3COOH<H2CO3<HCN = > HCN+Na2CO3=NaCN+NaHCO3 = < 变大 不变
【详解】
(1)①酸的电离常数越大,等物质的量浓度时pH越小,pH相同时,物质的量浓度由小到大的顺序为:HNO2<CH3COOH<H2CO3<HCN;答案为:HNO2<CH3COOH<H2CO3<HCN;
②pH相同,说明开始溶液中c(H+)相同且c(HCl)<c(HNO2),溶液中加入等量的Zn粉,反应刚开始时产生H2的速率相等;盐酸为强酸,完全电离,HNO2为弱酸,部分电离,若得到等量的氢气,消耗HCl中的H+与HNO2中的H+一样多,因为c(HCl)<c(HNO2),所以所消耗的酸的体积:V(HCl)>V(HNO2)。答案为:=;>;
③因为HCN的电离常数介于H2CO3的一级电离常数与二级电离常数之间,则过量的HCN溶液与Na2CO3溶液等体积混合,发生反应的化学方程式为HCN+Na2CO3=NaCN+NaHCO3。答案为:HCN+Na2CO3=NaCN+NaHCO3;
(2) pH相同时,两溶液中的离子浓度 c(H+)相等,则c(OH‒)也相等,根据电荷守恒原则,则稀释前两溶液中c(CH3COO‒)=c(NO);因为K(HNO2)>K(CH3COOH),二者稀释相同的倍数后,pH:HNO2>CH3COOH,酸性越强,对水的电离的抑制作用越强,故稀释后,两溶液中水的电离程度CH3COOH<HNO2。答案为:=;<;
(3) 常温下,向HCN溶液中加入NaCN固体,会抑制HCN的电离,使得HCN的电离平衡向左移动,c(H+)减小,因为Kw=,温度不变,Kw不变,故c(OH-)变大,因为,K(HCN)只与温度有关,温度不变,K(HCN)不变,故答案为:变大;不变。
高考化学一轮复习考点过关练习考点43 电离平衡常数及相关计算(含解析): 这是一份高考化学一轮复习考点过关练习考点43 电离平衡常数及相关计算(含解析),共14页。试卷主要包含了表达式,意义,特点,影响因素,电离常数的三大应用,电离平衡常数相关计算,25 ℃时,电离平衡常数,已知等内容,欢迎下载使用。
高考化学一轮复习考点过关练考点43电离平衡常数及相关计算(含解析): 这是一份高考化学一轮复习考点过关练考点43电离平衡常数及相关计算(含解析),共14页。试卷主要包含了表达式,意义,特点,影响因素,电离常数的三大应用,电离平衡常数相关计算,25 ℃时,电离平衡常数,已知等内容,欢迎下载使用。
2023届高考化学一轮复习 化学反应原理专练(7)平衡常数及相关计算: 这是一份2023届高考化学一轮复习 化学反应原理专练(7)平衡常数及相关计算,共26页。试卷主要包含了关于反应,下列说法正确的是,18,且该反应的,一定温度下,在3个容积均为1等内容,欢迎下载使用。












