
2022届高三化学一轮复习化学反应原理题型必练18与物质的百分含量有关图像的分析含解析
展开
这是一份2022届高三化学一轮复习化学反应原理题型必练18与物质的百分含量有关图像的分析含解析,共21页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
一、单选题(共18题)
1.己知可逆反应aA+bB⇌cC中,A与C物质在混合物中的质量分数随温度T的变化曲线如图所示。下列说法中,正确的是
A.该反应在T1温度时正、逆反应速率相等
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
2.一定温度下,在容积为2 L的刚性容器中充入1 ml A(g)和2 ml B(g),发生反应A(g)+2B(g) C(g) ∆H<0,反应过程中测得容器内压强的变化如下图所示。下列说法错误的是
A.0~20 min内,B的平均反应速率为0.025 ml/(L∙min)
B.达到平衡时,A的转化率为50%
C.该温度下,反应的压强平衡常数Kp=4.0 MPa-2
D.在20 min时,向该容器中充入1 mlC(g)达到新平衡,此时C的百分含量增大
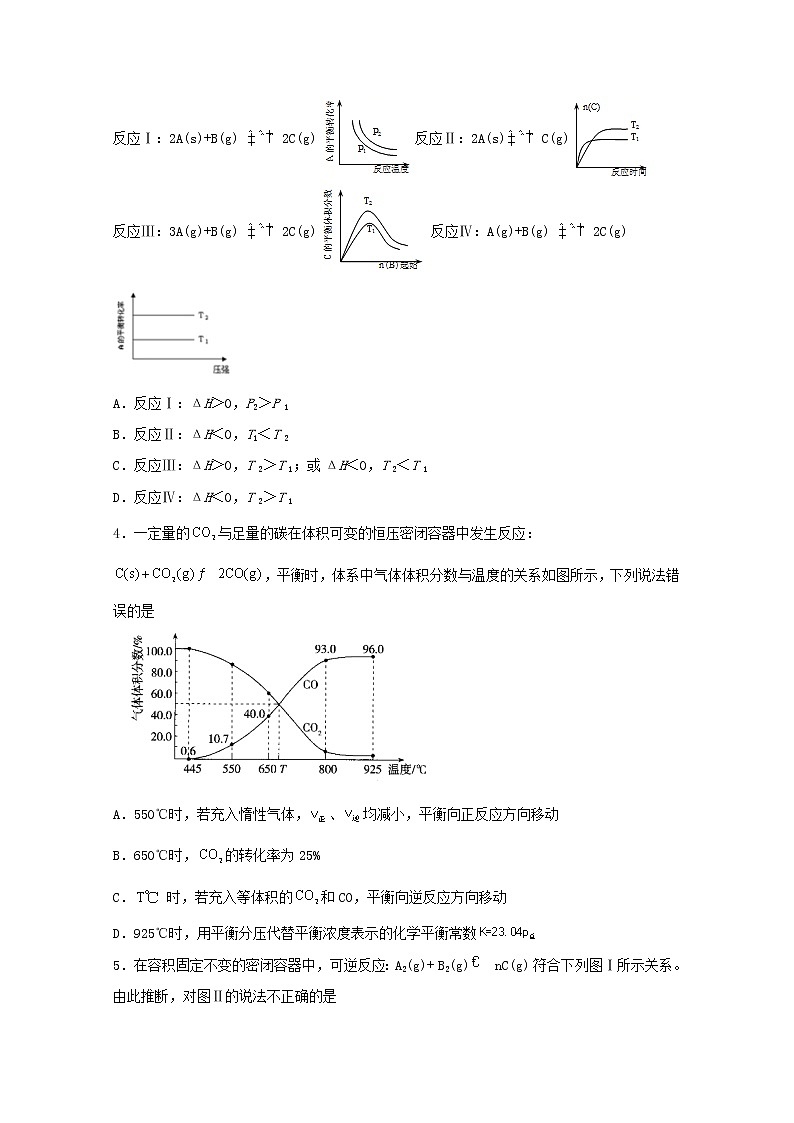
3.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(p表示压强,T表示温度,n表示物质的量):根据以上规律判断,下列结论正确的是
反应Ⅰ:2A(s)+B(g) 2C(g)反应Ⅱ:2A(s)C(g)
反应Ⅲ:3A(g)+B(g) 2C(g)反应Ⅳ:A(g)+B(g) 2C(g)
A.反应Ⅰ:ΔH>0,P2>P 1
B.反应Ⅱ:ΔH<0,T1<T 2
C.反应Ⅲ:ΔH>0,T 2>T 1;或ΔH<0,T 2<T 1
D.反应Ⅳ:ΔH<0,T 2>T 1
4.一定量的与足量的碳在体积可变的恒压密闭容器中发生反应:,平衡时,体系中气体体积分数与温度的关系如图所示,下列说法错误的是
A.550℃时,若充入惰性气体,、均减小,平衡向正反应方向移动
B.650℃时,的转化率为25%
C. 时,若充入等体积的和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数
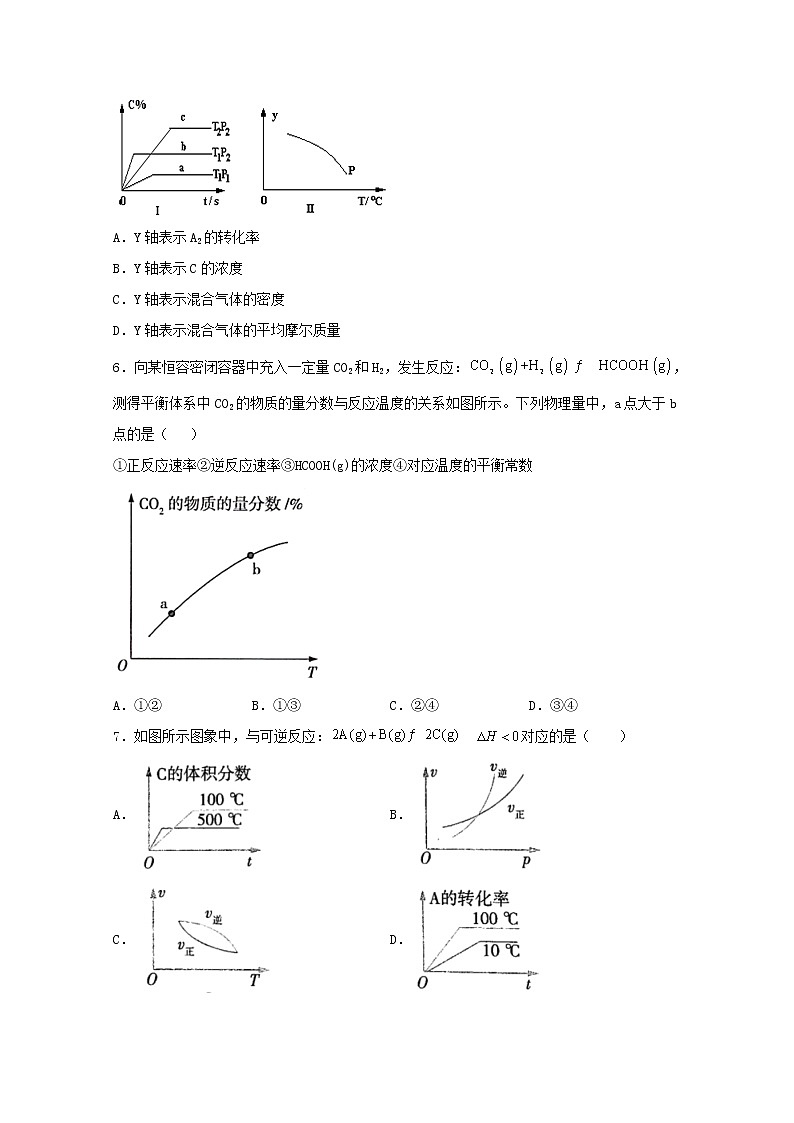
5.在容积固定不变的密闭容器中,可逆反应:A2(g)+ B2(g) nC(g) 符合下列图Ⅰ所示关系。由此推断,对图Ⅱ的说法不正确的是
A.Y轴表示A2的转化率
B.Y轴表示C的浓度
C.Y轴表示混合气体的密度
D.Y轴表示混合气体的平均摩尔质量
6.向某恒容密闭容器中充入一定量CO2和H2,发生反应:,测得平衡体系中CO2的物质的量分数与反应温度的关系如图所示。下列物理量中,a点大于b点的是( )
①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度的平衡常数
A.①②B.①③C.②④D.③④
7.如图所示图象中,与可逆反应: 对应的是( )
A.B.
C.D.
8.某化学科研小组研究在其他条件不变时,改变某一条件对反应的化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图象得出的结论正确的是( )
①正反应一定是放热反应
②达到平衡时的转化率大小为
③若,则正反应一定是吸热反应
④b点时,平衡体系中A、B原子数之比接近1:3
A.①②B.①③C.②④D.③④
9.如图表示外界条件(温度、压强)的变化对反应:的影响,则在图中Y表示( )
A.平衡混合气体中R的质量分数B.平衡混合气体中G的体积分数
C.G的平衡转化率D.L的平衡转化率
10.在某恒容的密闭容器中,可逆反应A(g)+B(g)⇌xC(g)有如图所示的关系曲线,下列说法正确的是
A.温度:T1>T2B.压强:p1>p2
C.正反应是吸热反应D.x的值是2
11.将Ce(SO4)2·4H2O(摩尔质量为404 g·ml-1)在空气中加热,样品的固体残留率(×100%)随温度的变化如下图所示。
当固体残留率为70.3%时,所得固体可能为
A.Ce(SO4)2B.Ce2(SO4)3C.CeOSO4D.无法计算
12.已知某可逆反应mA(g)+nB(g)pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
A.T1>T2 P1<P2 m+n<p 吸热反应
B.T1<T2 P1<P2 m+n>p 放热反应
C.T1<T2 P1>P2 m+n>p 放热反应
D.T1>T2 P1<P2 m+n>p 吸热反应
13.在铂—铑合金网上发生反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。该反应是一个自发的反应且铂—铑合金网未预热也会发热,下列像图不正确的是
A.B.
C.D.
14.可逆反应aA(g)+bB(g)cC(g)+dD(s)ΔH=QkJ·ml-1,反应过程中,当其他条件不变时,化学平衡常数(K)与温度,C的百分含量与时间的关系如图所示。据图分析,以下说法错误的是
A.Q>0
B.增大压强,B的转化率增大
C.当反应达平衡时,混合气体的密度不再变化
D.p1>p2,a+b<c
15.反应2NO(g) + 2CO(g) N2(g) + 2CO2(g) ΔHT2
B.a点达到平衡所需时间比c点短
C.c点NO的平衡转化率:50%
D.若在e点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中的c点
16.一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)。设起始=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示。下列说法正确的是
A.该反应的焓变ΔHT1,温度升高,P的体积分数减小,平衡逆向移动,正向为放热反应,温度升高,放热反应的平衡常数K减小,因此K1>K2,A项错误;
B. 温度为T1时,平衡时P的体积分数为40%,设起始到平衡转化P的浓度为xml/L,
M(s) + 2N(g) P(g) + Q(g)
始(ml/L) 1 0 0
转(ml/L) 2x x x
平(ml/L) 1-2x x x
则=40%,解得x=0.4,N的平衡转化率为×100%=80%,
平衡常数K===4.0,B项正确;
C. 该反应为气体分子数不变的反应,容器中压强不变时,不能说明反应达到平衡状态,C项错误;
D. 降低温度,平衡向着放热的方向移动,即平衡正向移动,有利于提高反应物的平衡转化率;该反应为气体分子数不变的反应,增大压强,平衡不移动,无法提高反应物的平衡转化率;减小生成物的浓度,平衡正向移动,有利于提高反应物的平衡转化率,D项错误;
答案选B。
19.d c 小于 或
【详解】
(1)由题中信息可知,两反应物的初始投料之比等于化学计量数之比,由图中曲线的起点坐标可知,c和a所表示的物质的物质的量分数之比为1:3,d和b表示的物质的物质的量分数之比为1:4,则结合化学计量数之比可以判断,表示乙烯变化的曲线是d,表示二氧化碳变化曲线的是c;由图中曲线的变化趋势可知,升高温度,乙烯的物质的量分数减小,则化学平衡向逆反应方向移动,则该反应为放热反应,∆H小于0;
(2)原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1Mpa建立平衡。由A点坐标可知,该温度下,氢气和水的物质的量分数均为0.39,则乙烯的物质的量分数为水的四分之一,即,二氧化碳的物质的量分数为氢气的三分之一,即,因此,该温度下反应的平衡常数K=或(MPa)−3。
20.25% 小 随着Y值的增大,c(CH3OH)减小,平衡CO(g)+2H2(g)⇌CH3OH(g)向逆反应方向进行,故Y为温度
【详解】
①设反应中消耗xmlCO,由题意建立如下三段式:
由M点CH3OH的体积分数为10%可得关系式:×100%=10%,解得x=0.25,则α(CO)=×100%=25%;
②由图可知,X轴上,从a到b点数值逐渐增大,则a点的数值比b点小;该反应为气态物质分子数减小的放热反应,增大压强,φ(CH3OH)增大,升高温度,φ(CH3OH)减小;随着Y值的增大,c(CH3OH)减小,平衡CO(g)+2H2(g)⇌CH3OH(g)向逆反应方向进行,故Y轴表示温度,X轴代表压强。
21.NO+NO2+(NH2)2CO==2N2+CO2+2H2O NO难溶于水,难以与尿素接触反应
【分析】
从图中可以看出,当NO 和 NO2 的体积比在0.5与1之间时,由于相同体积的混合气体消耗尿素的量不断减少,所以气体被还原的越来越充分,总氮还原率不断提高;当NO 和 NO2 的体积比在1与4之间时,虽然相同体积的混合气体消耗尿素的量不断减少,但由于混合气在尿素水溶液中的溶解量不断减少,反应进行的程度反而减小,所以总氮还原率不断降低。
【详解】
(1)用尿素[(NH2)2CO]水溶液吸收体积比为 1∶1 的 NO 和 NO2 混合气,N 元素转变为N2,同时生成CO2和水,该反应的化学方程式为NO+NO2+(NH2)2CO==2N2+CO2+2H2O。答案为:NO+NO2+(NH2)2CO==2N2+CO2+2H2O;
(2)随着 NO 和 NO2 配比的提高,NO的含量不断增大,在尿素水溶液中的溶解量不断减少,所以总氮还原率不断降低,从而得出其主要原因是NO难溶于水,难以与尿素接触反应。答案为:NO难溶于水,难以与尿素接触反应。
【点睛】
气体与溶液发生反应前,应与溶液充分接触,否则反应难以顺利进行。
22.>
【分析】
①根据温度影响平衡移动,得出答案。
②根据题意得到氨气、氮气、氢气体积分数,再得到它们的压强,再根据压强平衡常数进行计算。
【详解】
①该反应是放热反应,当升高温度时,平衡向逆向移动,氨气的体积分数减小,故可知T1>T2;
②由题意可知,a点总压为50MPa,平衡时氢气与氮气之比为3:1,氨气的体积分数为0.2,则氮气的体积分数为0.2,氢气的体积分数为0.6,氨气的体积分数为0.2,平衡时氮气分压为10MPa,氢气分压为30MPa,氨气分压为10MPa,T2时,故答案为。
23.变小 变小 > c 0.125
【解析】
【分析】
本题主要考查平衡移动以及化学反应图像。
Ⅰ.温度升高,化学平衡逆反应方向移动,CH3OCH3的产率变小;逆反应方向气体分子数增加,即气体的物质的量增加,气体质量不变,混合气体的平均相对分子质量将变小。
Ⅱ.(1)图像中T1→T2时N2O5%增加,平衡向放热的正反应方向移动,应为降温。
(2)O2越多,NO2的转化率越大。
(3)b点时N2O5的百分含量最大,则此点通入O2、NO2的物质的量之比与化学方程式的计量数相等,即通入4 ml NO2,列三段式计算平衡常数。
【详解】
I.该反应正向为放热反应,升高温度,平衡逆向移动,CH3OCH3的产率变小;逆反应方向气体分子数增加,即气体的物质的量增加,气体质量不变,混合气体的平均相对分子质量将变小。
II.(1)该反应正向为放热反应,T1→T2时N2O5%增加,平衡向放热的正反应方向移动,应为降温。
(2)增加氧气的物质的量,平衡将正向移动,反应物NO2的转化率将会上升,故c点时NO2转化率最大。
(3)b点时N2O5的百分含量最大,则此点通入O2、NO2的物质的量之比与化学方程式的计量数相等,即通入4 ml NO2;
由反应4NO2g+O2g⇌2N2O5g
起始(ml/L) 4 1 0
转化(ml/L) 4x x 2x
平衡(ml/L)4-4x 1-x 2x
由4x4=0.5解得x=0.5,故平衡常数K=1224•0.5=0.125。
【点睛】
当反应物投料比按照反应物计量数之比投料时,生成物的体积分数存在最大值,但生成物的物质的量不一定最大。
相关试卷
这是一份2022届高三化学一轮复习化学反应原理题型必练36平衡移动及图像分析含解析,共19页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
这是一份2022届高三化学一轮复习化学反应原理题型必练18与物质的百分含量有关图像的分析含解析,共21页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
这是一份2022届高三化学一轮复习化学反应原理题型必练17与转化率有关图像的分析含解析,共17页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。








