





人教版 (2019)必修 第一册第二节 金属材料多媒体教学ppt课件
展开1.联系生活中人们对金属及其合金的应用,认识合金的组成及特性,深入了解常见铁合金、铝合金、新型合金的组成及用途,培养科学态度与社会责任。2.结合生活中铝制品的使用,认识铝的氧化膜对铝制品的保护作用,通过实验探究认识金属铝及氧化铝与酸、碱溶液的反应,特别是对氧化铝两性的认识,完善按性质对氧化物进行分类,培养科学探究的能力与创新意识。
【知识铺垫】1.金属具有许多共同的物理性质,如不透明、有金属光泽、易导电、易导热、有延展性。2.生产、生活中应用较多的合金是生铁和钢,历史上应用最早的金属是铜。3.金属材料包括纯金属和合金两类。金属分为黑色金属和有色金属。
【必备知识】一、合金1.合金的定义和特性
2.改变合金性能的方法和导致合金硬度变大的原因
【微思考1】合金中只含有金属元素吗?提示 不是。合金可由金属与金属或金属与非金属制得,一定含有金属元素,可能含有非金属元素。
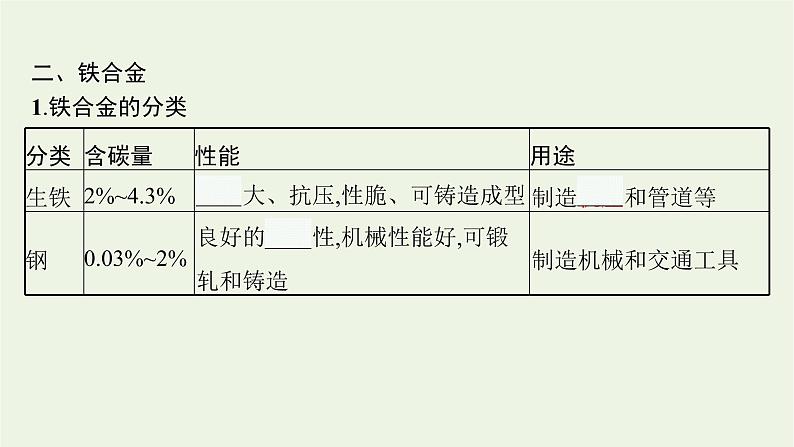
二、铁合金1.铁合金的分类
2.钢的分类(1)钢是用量最大、用途最广的合金,根据其化学成分,分为碳素钢和合金钢。(2)碳素钢
(3)合金钢①又叫特种钢,特殊性能:强度、硬度大,可塑性、韧性好,耐磨,耐腐蚀等。②不锈钢
三、铝和铝合金1.铝单质(1)与氧气反应:铝较活泼,常温下就能与空气中的氧气反应,表面生成一层致密的氧化铝薄膜。【微思考2】铝是一种活泼金属,为何铝制品可在空气中稳定存在?提示 铝制品表面覆盖着致密的氧化铝薄膜,这层膜起到保护内部金属的作用。【微思考3】家用铝合金门窗为什么不用纯铝制的?提示 铝合金相对于铝来说,具有硬度大(耐磨)、易加工(熔点低)的特点。
(2)铝与酸、碱的反应
①反应的化学方程式和离子方程式:与盐酸:2Al+6HCl === 2AlCl3+3H2↑,2Al+6H+ === 2Al3++3H2↑。②与NaOH溶液:2Al+2H2O+2NaOH === 2NaAlO2+3H2↑,2Al+2OH-+2H2O === 2 +3H2↑。
2.氧化铝(1)与酸(盐酸)反应:Al2O3+6HCl === 2AlCl3+3H2O。(2)与强碱(NaOH)溶液反应:Al2O3+2NaOH === 2NaAlO2+H2O。两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,如Al2O3。【微思考4】(1)日常生活中铝制餐具能否用来长期存放酸性或碱性食物?提示 不能,因Al和Al2O3均能与酸、碱反应。(2)金属氧化物与碱性氧化物、酸性氧化物、两性氧化物间有何关系?提示 多数金属氧化物属于碱性氧化物,如Na2O、CaO等;少数金属氧化物属于两性氧化物,如Al2O3、ZnO等;个别金属氧化物属于酸性氧化物,如Mn2O7。
3.铝合金(1)铝合金中的合金元素有Cu、Mg、Si、Mn、Zn及稀土元素等。(2)硬铝
【情境链接】为什么航空业上铝合金比铁合金用途更广泛?提示 ①铝合金比铁合金密度小,更适合于航空业;②铝合金表面易形成致密的氧化膜,此氧化膜耐高温、防腐蚀,而铁合金的氧化膜易脱落,起不到防腐蚀的作用。
【自我小测】1.判断正误:(1)合金是混合物,没有固定熔、沸点。( )(2)Al2O3可以与所有酸或碱发生反应。( )(3)制饭勺、饭盒、高压锅等的不锈钢是合金。( )(4)铝合金大量用于高铁建设。( )(5)氢氧化铝可用于中和过多胃酸。( )答案 (1)√ (2)× (3)√ (4)√ (5)√
2.下列所用材料不属于合金的是( )A.家用的铝窗B.温度计用的水银C.铸造用的黄铜D.建筑用的钢筋答案 B解析 家用的铝窗是铝合金,A不符合题意;温度计用的水银是金属汞单质,不是合金,B符合题意;铸造用的黄铜是铜的合金,C不符合题意;建筑用的钢筋是铁合金,D不符合题意。
【问题探究】2020年我国嫦娥五号探测器成功在月球软着陆并回收成功。
1.月球白天地面温度高达150度,而到了夜晚,温度又跌落到零下180度。嫦娥五号探测器使用了大量合金材料,这些合金材料应具有哪些性质?提示 密度小、强度大、既耐高温又耐低温等。
2.形状记忆合金是一种在加热升温后能完全消除其在较低的温度下发生的变形,恢复其变形前原始形状的合金材料。嫦娥五号探测器,使用了记忆合金制作天线,试分析其好处。提示 嫦娥五号探测器使用记忆合金制作,天线折叠起来装进探测器内,工作时只需升温,折叠的卫星天线因具有“记忆”功能而自然展开,恢复设计形状。3.已知铜的熔点为1 083 ℃,钠的沸点为883 ℃,试问铜与钠能否形成合金?提示 不能。当铜开始熔化时,钠已经是气体,所以二者不能形成合金。
4.镁铝合金为什么广泛应用于飞机?提示 因为其具有密度小、强度大的特性,且价格较低。5.合金通常比组成它的纯金属有哪些更优良的性质?提示 合金具有许多优良的物理、化学或机械性能,在许多方面不同于各成分金属。如合金的硬度一般比它的各成分金属的大,多数合金的熔点一般也比它的各成分金属的低等。
【深化拓展】1.合金的形成条件(1)金属与金属形成合金时:合金是金属在熔化状态时相互混合形成的,熔化时的温度需达到成分金属中熔点最高的金属的熔点,但又不能超出成分金属中沸点最低的金属的沸点。一种金属的熔点高于另一种金属的沸点时则不能形成合金。(2)金属与非金属形成合金时:部分不活泼非金属与金属可形成合金,活泼非金属与活泼金属一般不能形成合金。
2.金属材料选择的依据某种金属能不能成为一种应用广泛的材料主要取决于该金属的储量、冶炼成本、市场价格以及所具有的性能和是否易于加工等。(1)物理性质:密度、硬度、强度、导电性和导热性等,这些性质决定金属材料的加工难易程度。(2)化学性质:对水的作用、耐腐蚀性等,这些性质决定金属材料的日常维护和环境对其产生的影响。
【素能应用】典例1(2021河北,1)“灌钢法”是我国古代劳动人民对钢铁冶炼技术的重大贡献,陶弘景在其《本草经集注》中提到“钢铁是杂炼生钅柔作刀镰者”。“灌钢法”主要是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢。下列说法错误的是( )A.钢是以铁为主的含碳合金B.钢的含碳量越高,硬度和脆性越大C.生铁由于含碳量高,熔点比熟铁高D.冶炼铁的原料之一赤铁矿的主要成分为Fe2O3
答案 C解析 本题考查化学与传统文化及钢铁的基本知识。钢和生铁均属于铁碳合金,钢中的含碳量低、生铁中的含碳量高,铁合金的硬度和脆性随含碳量增大而增大,A、B项均正确。合金的熔点通常比各组分的熔点低,C项错误。赤铁矿的主要成分为氧化铁,D项正确。温馨提示 (1)合金是混合物而不是纯净物。(2)合金具有许多优良的物理和机械性能,在许多方面不同于各成分金属;但在化学性质上,一般认为合金体现的是各成分金属的化学性质。(3)并非任意两种金属都能形成合金,两种金属形成合金,其前提是两种金属在同一温度范围内都能熔化。
变式训练1中国第5架国产大飞机C919大型客机的机身部分采用第三代新型铝锂合金材料。下列关于铝锂合金的认识不正确的是( )A.铝锂合金密度较小,强度较大,硬度大于纯铝,熔点低于锂单质B.改变原料的配比,可以制得性能不同的铝锂合金C.铝锂合金具有金属光泽,可导电导热D.铝锂合金的性质与各成分金属的性质完全相同
答案 D解析 铝、锂密度较小,其合金密度也较小;合金是不同金属熔合而成的具有金属特性的物质,改变原料的配比,可以制得性能不同的铝锂合金;合金一般比其成分金属的颜色更鲜艳,可导电导热;合金的熔点比它的各成分金属的熔点低,硬度大于其成分金属,铝锂合金的性质与各成分金属的性质不完全相同。
【问题探究】蓝宝石、红宝石虽然色彩各异,但它们都是刚玉的一种,刚玉是天然的无色Al2O3晶体的俗称,硬度仅次于金刚石。但是佩戴时也要注意尽量少接触酸性或碱性溶液,因为氧化铝是两性氧化物,与酸、碱都能反应。
(1)铝也都能与盐酸和氢氧化钠溶液反应,那么能否称铝为两性元素?提示 不能。铝为金属,与氢氧化钠溶液反应的实质是与水反应。(2)如何除去镁粉中的铝粉?提示 将样品加入足量的NaOH溶液,然后过滤、洗涤、干燥。
(3)等量的铝分别与足量的稀盐酸、氢氧化钠溶液反应,生成氢气的量有什么关系?提示 相同。(4)等浓度、等体积的NaOH溶液和稀盐酸与足量铝反应,生成H2的质量有什么关系?提示 3∶1。(5)Al与等浓度的NaOH溶液、稀盐酸反应生成等质量的H2,所需NaOH溶液、稀盐酸的体积比为多少?提示 1∶3。
【深化拓展】铝与盐酸或氢氧化钠溶液反应中四种“量”的关系(1)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,消耗HCl和氢氧化钠的物质的量之比为3∶1。(2)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,产生H2的体积比为1∶1。(3)足量的铝分别与等物质的量浓度、等体积的盐酸和氢氧化钠溶液反应,产生H2的体积比为1∶3。(4)特殊情况分析:若产生的氢气的体积比为 ,则必定是铝与盐酸反应时,铝过量而盐酸不足;铝与氢氧化钠溶液反应时,铝不足而氢氧化钠过量。
【素能应用】典例2甲、乙两烧杯中各盛有100 mL 3 ml·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为1∶2,则加入的铝粉质量为( )A.5.4 gB.3.6 gC.2.7 gD.1.8 g
答案 A解析 由2Al+6HCl === 2AlCl3+3H2↑、2Al+2NaOH+2H2O === 2NaAlO2+3H2↑可知,若两份等质量的Al都完全反应时,生成H2的量相等,消耗HCl与NaOH的物质的量不相等。实际上HCl、NaOH同为0.3 ml,且已知生成H2的体积比为1∶2,所以发生反应时分别为HCl不足,Al过量;NaOH过量,Al不足。与0.3 ml HCl完全反应的Al的质量为2.7 g,则由生成H2的体积比为1∶2可知,反应的Al的质量之比也为1∶2,即与NaOH溶液反应的Al的质量为5.4 g。
变式训练2甲、乙两个烧杯中分别盛有100 mL 4.0 ml·L-1的盐酸和100 mL 4.0 ml·L-1的NaOH溶液,向两个烧杯中均加入5.4 g铝粉,在相同状况下产生气体的体积比为( )A.1∶1 B.2∶3 C.3∶2D.3∶1答案 B解析 甲、乙两烧杯中含HCl、NaOH的物质的量都为0.4 ml,根据化学方程式2Al+6HCl === 2AlCl3+3H2↑、2Al+2NaOH+2H2O === 2NaAlO2+3H2↑可知,5.4 g(即0.2 ml)Al分别与盐酸和NaOH溶液反应时,盐酸不足量而NaOH过量,故Al与盐酸反应生成H2 0.2 ml,与NaOH溶液反应生成H2 0.3 ml,在相同状况下其体积比为2∶3。
1.沈括根据变法需要,悉心总结了兵器制作技术。《梦溪笔谈·器用》中记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折。剑之钢者,刃多毁缺,巨阙是也,故不可纯用剂钢。”以所学合金的知识,分析古人铸剑时剑身的材料为( )A.钢B.生铁C.青铜D.白铜答案 A解析 生铁硬度大、抗压、性脆,钢有良好的延展性,机械性能好,可以锻轧和铸造,所以古人铸剑时剑身的材料为钢,与铜无关。
2.铝既能与硫酸溶液反应,又能与烧碱溶液反应,下列说法不正确的是( )A.两个反应都是氧化还原反应B.铝与硫酸反应时,硫酸是氧化剂C.铝与烧碱溶液反应时,氢氧化钠是氧化剂D.两个反应都有气体生成答案 C解析 铝与硫酸溶液反应生成硫酸铝和氢气,铝是还原剂,硫酸是氧化剂;铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,铝是还原剂,水是氧化剂。
3.下列关于金属铝的说法正确的是( )A.与Al反应产生H2的溶液一定呈酸性B.铝是比较活泼的金属,在化学反应中容易失去电子,表现出氧化性C.铝箔在空气中受热可以熔化,且发生剧烈燃烧D.铝箔在空气中受热可以熔化,但由于氧化膜的存在,熔化的铝并不滴落答案 D解析 与Al反应产生H2的溶液可能呈酸性,也可能呈碱性,A项错误;铝在化学反应中容易失去电子,表现出还原性,B项错误;铝箔在空气中受热可以熔化,但表面形成的氧化膜使得铝与氧气无法反应,因而不会燃烧,C项错误。
4.人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。(1)地壳中含量最高的金属元素是 。 (2)根据下图金属应用实例推断,金属具有的物理性质有 。
(3)日常使用的金属材料多数属于合金。下表列出了一些常见合金的主要成分和性能。
与组成合金的纯金属相比,合金的优点一般有 (填序号)。 ①强度更低 ②硬度更大 ③熔点更高 ④抗腐蚀性更好(4)人们每年要从金属矿物资源中提取数以吨计的金属。根据所学化学知识,按要求写出两个生成金属的化学方程式:① (置换反应)。② (分解反应)。
高中化学人教版 (2019)必修 第一册第二节 金属材料图片ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 金属材料图片ppt课件,共34页。PPT课件主要包含了知识铺垫,新知预习,自主测试,探究一,探究二,素养脉络,随堂检测,深化拓展1铜合金,合金钢,铝合金等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 金属材料课堂教学课件ppt: 这是一份人教版 (2019)必修 第一册第二节 金属材料课堂教学课件ppt,共50页。
人教版 (新课标)必修1第二节 几种重要的金属化合物图片ppt课件: 这是一份人教版 (新课标)必修1第二节 几种重要的金属化合物图片ppt课件,共41页。PPT课件主要包含了内容索引,课前篇素养初探,课堂篇素养提升,素养目标,新型合金等内容,欢迎下载使用。













