
2021学年第一单元 含硫化合物的性质课前预习课件ppt
展开课程目标1.知道工业生产硫酸的基本原理。2.了解浓硫酸的特性。3.了解硫酸的应用。
SO3+H2O===H2SO4
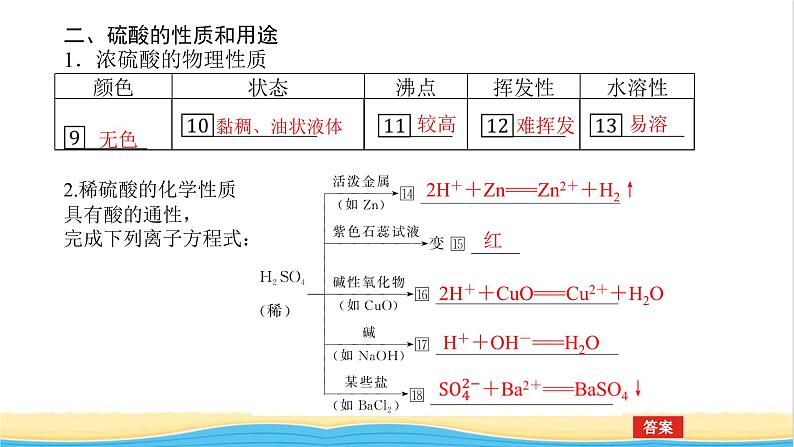
二、硫酸的性质和用途1.浓硫酸的物理性质
2.稀硫酸的化学性质具有酸的通性,完成下列离子方程式:
2H++Zn===Zn2++H2↑
2H++CuO===Cu2++H2O
H++OH-===H2O
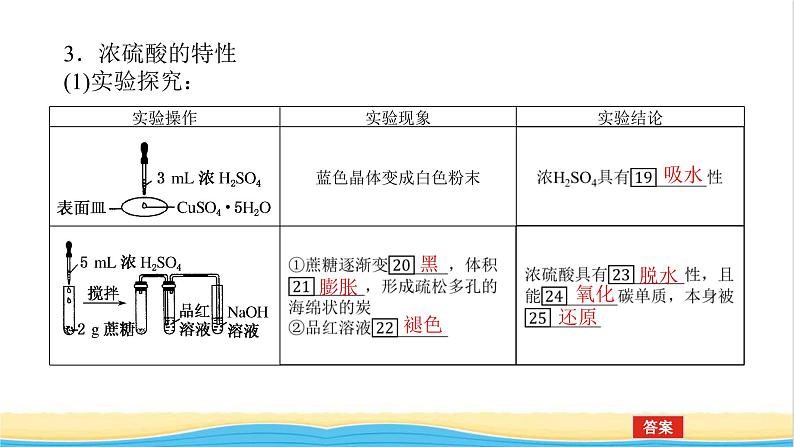
3.浓硫酸的特性(1)实验探究:
4.硫酸的用途(1)制造化肥、医药、农药。(2)金属矿石的处理、金属材料的表面清洗。(3)制取硫酸盐,制取难挥发性酸。(4)化学试剂。
[即时自测]1.判断正误,正确的打“√”,错误的打“×”(1)用硫铁矿制硫酸的三步反应均为氧化还原反应。( )(2)浓H2SO4常温下与铝、铁不反应。( )(3)一定量的浓硫酸与铜反应时,即使铜过量,浓硫酸也不会完全反应。( )(4)浓H2SO4有脱水性,所以常用作干燥剂。( )(5)浓H2SO4与木炭反应既表现氧化性又表现出酸性。( )
2.在硫酸工业生产中,SO3的吸收过程是在吸收塔(如右图)中进行的,吸收塔里还装入了大量瓷环。下列有关说法不正确的是( )A.从①处通入SO3,整个吸收操作采取逆流的形式B.从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积C.从③处导出的气体只含有少量SO2,可直接排入大气D.从④处流出的是可用水或稀硫酸稀释的硫酸
解析:首先明确该装置(设备)在吸收SO3过程中是采用逆流原理进行吸收的,即98.3%的硫酸是从吸收塔顶喷下,而SO3是从吸收塔底部通入的。这样有利于气、液的充分接触,吸收效果好。从吸收塔上部导出的气体是N2、没有起反应的O2和少量SO2,直接排入大气会污染环境,所以应用吸收剂吸收或循环使用。
3.观察如图,并回答下列问题:(1)该设备的名称叫________。(2)矿石粉碎成细小矿粒的目的是:①__________________________________________________,②________________________________________________。(3)该设备中发生反应的化学方程式是__________________________________________________。
增大矿石跟空气的接触面积,使之燃烧充分
浓硫酸与锌反应放出SO2气体,随着反应的进行,浓硫酸变为稀硫酸,锌与稀硫酸反应放出H2
解析:浓硫酸使蓝色硫酸铜晶体变白,是因为浓硫酸的吸水性而不是脱水性。
提升点1 硫酸制备中反应与条件的控制[例1] 某小组同学设计如下装置来检验SO2与O2反应后混合气体的成分。
已知:SO3遇水剧烈反应,放出大量热,产生酸雾;98.3%的浓H2SO4可以吸收SO3和酸雾。供选试剂:蒸馏水、0.5 ml·L-1 BaCl2溶液、98.3%的浓H2SO4、2.0 ml·L-1 NaOH溶液、酸性KMnO4溶液。(1)c中应选用的试剂是___________________,e中试剂的作用是___________,f中收集的气体是________。(2)某同学提出用饱和NaHSO3溶液代替98.3%的浓H2SO4,请你评价该方案是否可行,若可行不必说明理由;若不可行,简述其理由:______________________________________________________。
0.5 ml·L-1 BaCl2溶液
SO3与NaHSO3反应生成SO2,干扰对原混合气体中SO2的检验
【解析】 (1)该装置中a可干燥SO2、O2并使两者充分混合,控制气体流速;b为SO2与O2的反应装置;c可验证反应后混合气体中含有SO3,所以c中试剂是0.5 ml·L-1 BaCl2溶液;d的作用是吸收SO3和酸雾;e的作用是通过酸性高锰酸钾溶液吸收SO2而褪色(或变浅),检验和除去混合气体中的SO2;f中收集的气体是氧气。(2)用饱和NaHSO3溶液代替98.3%的浓硫酸,不可行,其理由是SO3与NaHSO3反应生成SO2,干扰对原混合气体中SO2的检验。
[提升1] 工业上制硫酸的设备分为三大部分:沸腾炉、接触室、吸收塔,下图中的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
若在反应过程中有有毒气体产生,一定要有尾气吸收装置;计算生成的硫酸可利用关系式:FeS2~2H2SO4。请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的化学方程式:______________________________。(2)图中的乙、丙分别相当于工业上制取硫酸装置中的____________、____________。(3)从乙装置中出来的气体有________________。(4)丙装置的作用为________,丁中的现象为__________。(5)本实验设计还存在的较明显缺陷是______________。(6)假设在煅烧黄铁矿(含FeS2矿石)时,有5%的硫损失,在SO2的催化氧化过程中,有92%的SO2转化为SO3,在吸收塔中损失SO3的质量分数为0.6%。现有含FeS295%的黄铁矿100 t,则可制得98%的浓硫酸________t。
关键能力1.接触法制硫酸的原理三原理:化学平衡原理、热交换原理、逆流原理。(1)化学平衡原理:增大反应物浓度、增大反应物间接触面积,能提高反应速率并使化学平衡向正反应方向移动,以充分提高原料利用率。(化学平衡移动内容将在《化学反应原理》中学习)(2)热交换原理:在接触室中生成的热量经过热交换器,传递给进入接触室的需要预热的混合气体,为二氧化硫的接触氧化和三氧化硫的吸收创造了有利条件。(3)逆流原理:液体由上向下流,气体由下向上升,两者在逆流过程中充分反应。
(2)多步反应计算①关系式法:先写出多步反应的化学方程式,然后找出反应物和生成物之间物质的量(或质量)之比,列出关系式,即可一步计算。②元素守恒法:找出主要原料和最终产物之间物质的量的对应关系。找出此关系的简便方法,就是分析原料与产物之间所含关键元素原子个数的关系,如FeS2~2H2SO4、S~H2SO4。
特别提醒 对于接触法制硫酸要熟记四个“三”,即“三阶段,三设备,三反应,三原理”。
提升点2 浓硫酸和稀H2SO4对比[例2] 某学习小组在鉴别浓硫酸和稀硫酸时,设计了如下方案:
(1)其中可行的是__________(填序号)。(2)其中稍作改进就能成为可行方案的是______,改进方法是______。(3)完全错误的是________,因为______________________________。
硫酸是高沸点酸,不挥发
【解析】 (1)甲、丙、戊分别利用浓硫酸的脱水性、溶解时放出大量的热、吸水性设计,方案可行。(2)乙中常温下铝遇浓硫酸使铝钝化,加热即可反应。而常温下铝片可与稀硫酸反应产生H2。(3)丁错误,挥发性酸遇浓氨水才能产生白烟,浓硫酸不属于挥发性酸。
状元随笔 浓硫酸吸水性和脱水性的区别:吸水性:浓硫酸吸取物质中本身存在的水或结晶水的性质。脱水性:浓硫酸将组成有机物的H、O元素按原子个数比2∶1以“H2O”的形式脱去的性质由此看出:二者的根本区别在于物质本身是否存在水分子。
[提升2] 下列关于浓硫酸的说法中,正确的是( )A.浓硫酸与铜共热的反应中,浓硫酸既表现出强氧化性,又表现出酸性B.浓硫酸有强氧化性,一定量的浓硫酸与足量的锌反应,不会有氢气产生C.浓H2SO4具有吸水性,可以干燥任何气体D.浓H2SO4是一种难挥发性酸,而HCl、HI、H2S是挥发性酸,可以用浓H2SO4分别与NaCl、KI、FeS等反应制取HCl、HI、H2S等气体
状元随笔 浓硫酸与锌反应,随着反应的进行,浓硫酸的浓度逐渐减小,稀硫酸的性质与浓硫酸的性质不同。
关键能力浓硫酸强氧化性的表现1.与金属的反应(1)Fe、Al的钝化常温下,当Fe、Al遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象。(2)与氢之前的活泼金属反应Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O规律:①浓硫酸既表现氧化性,又表现酸性;②浓硫酸一旦变稀,就发生:Zn+H2SO4===ZnSO4+H2↑。
状元随笔 浓H2SO4与稀H2SO4氧化性的区别:
学考评价——夯实·测控·演练1.在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室,按图所示密闭体系中气流的流向,则A处流出的气体为( )A.SO2 B.SO3、O2C.SO2、O2 D.SO2、SO3
解析:进入热交换器预热的是SO2和O2的混合物,据此可排除A、B、D。在预热过程中,混合气体虽具备了合成SO3的温度,但无催化剂,因此A处流出的气体中应无SO3。
2.浓硫酸和2 ml·L-1的稀硫酸,在实验室中敞口放置。它们的质量和放置天数的关系如图。分析a、b曲线变化的原因是( )
A.a升华、b冷凝 B.a挥发、b吸水C.a蒸发、b潮解 D.a冷凝、b吸水
解析:本题考查学生对浓、稀硫酸在吸水与其中水分挥发的差异。浓H2SO4敞口放置时,易吸收空气中的H2O而增重,稀H2SO4敞口放置水分挥发,质量减小。两种溶液都存在吸水与水分的挥发两个过程,只不过浓H2SO4以吸收水分为主,溶液质量增加;而2 ml·L-1的稀H2SO4以水分挥发为主,质量减小。
3.(双选)下列对浓硫酸的叙述正确的是( )A.常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸B.浓硫酸具有脱水性,能使蔗糖炭化C.浓硫酸和铜片加热既表现出酸性,又表现出氧化性D.浓硫酸与亚硫酸钠反应制取SO2时,浓硫酸表现出强氧化性
解析:A项常温下浓硫酸能使铁、铝钝化,故可用铁质、铝质容器盛放浓H2SO4。B项浓硫酸使蔗糖炭化,体现了浓硫酸的脱水性。C项铜与浓硫酸在加热条件下发生反应,部分H2SO4被还原生成SO2,起氧化剂的作用,还有一部分H2SO4生成CuSO4,起酸的作用。D项实验室中用浓硫酸与固体亚硫酸钠反应来制取二氧化硫,在两种反应物中硫元素处于相邻价态,根据氧化还原反应规律知,它们之间是不可能发生氧化还原反应的,应为复分解反应,其原理是用难挥发性酸制易挥发性酸,强酸制弱酸。因而在此反应中浓硫酸表现的是难挥发性和酸性。
4.把1 g含脉石(SiO2)的黄铁矿样品在氧气流中灼烧,反应完全后得0.78 g残渣,则此黄铁矿的纯度是( )A.33% B.66%C.78% D.88%
解析:A项浓硫酸具有吸水性,但由于其具有强氧化性和酸性,故不能用来干燥具有还原性的气体和碱性气体(NH3);B项金属与浓硫酸反应时,生成相应的盐、SO2和H2O,此时浓硫酸显酸性和强氧化性,而与S、C等非金属单质作用时,由于没有盐生成,故只显强氧化性;C项Cu与浓硫酸反应时,浓硫酸浓度逐渐降低,当反应到一定程度变为稀硫酸时,反应自行停止,故产生的SO2不足22.4 L;浓硫酸遇水放出大量热,所以浓硫酸与水及含水的液体混合时,应将浓硫酸缓缓注入水或含水液体中,D正确。
6.某小组同学为探究铜跟浓硫酸的反应情况,并收集一瓶反应产生的气体,设计了如图所示装置。实验中他们取6.4 g铜片与12 mL 18 ml/L浓硫酸放在圆底烧瓶中加热,直到反应完毕仍发现烧瓶中有铜剩余。(1)为防止空气污染,请补画如图虚框中的实验装置,并注明所需要的试剂名称。
(2)写出铜跟浓硫酸反应的化学方程式:_________________________。(3)该小组认为铜片未完全溶解,则瓶中可能还有一定量的硫酸剩余,其原因是:_________________________________________________________________________________________________________。(4)为证明反应结束后的烧瓶中确有余酸,可选用下列药品中的________(填写字母序号)。A.铁粉 B.BaCl2溶液 C.银粉
反应过程中H2SO4被不断消耗,且生成的水逐渐增多使浓硫酸浓度变稀,至一定浓度时就不再与铜片反应
高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质评课ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质评课ppt课件,共45页。PPT课件主要包含了课堂小结等内容,欢迎下载使用。
高中化学第一单元 含硫化合物的性质图片课件ppt: 这是一份高中化学第一单元 含硫化合物的性质图片课件ppt,共48页。
苏教版 (2019)必修 第一册第一单元 含硫化合物的性质课文内容课件ppt: 这是一份苏教版 (2019)必修 第一册第一单元 含硫化合物的性质课文内容课件ppt,共46页。PPT课件主要包含了含硫矿石,FeS2,3%的浓硫酸,沸腾炉,接触室,吸收塔,水蒸气,变为蓝色,变黑有气泡逸出,逐渐变为无色等内容,欢迎下载使用。