

2022年贵州省贵阳市2022届高三适应性考试一(一模)化学试题含答案
展开
这是一份2022年贵州省贵阳市2022届高三适应性考试一(一模)化学试题含答案,共10页。试卷主要包含了请保持答题卡平整,不能折叠,每年10月23日上午6,1NA,下列实验设计能达到实验目的的是,[化学-选修3等内容,欢迎下载使用。
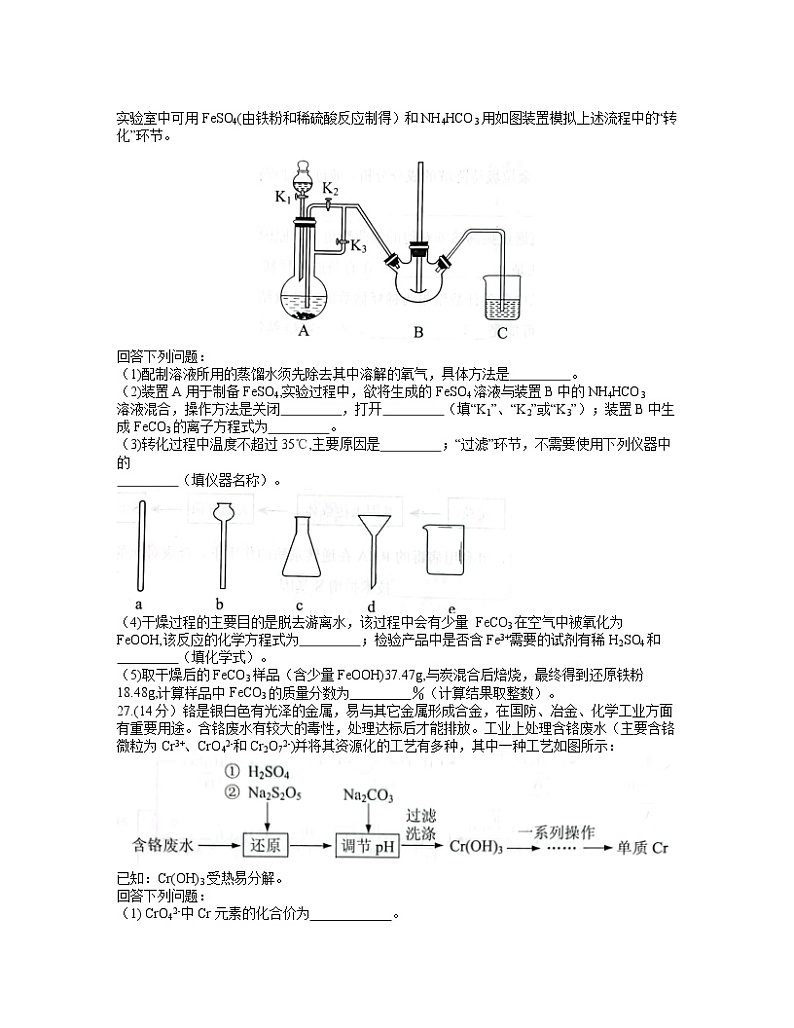
贵阳市2022年高三适应性考试(一)理科综合化学2022年2月本试卷分第I卷(选择题)和第II卷(非选择题)两部分。满分300分。考试用时150分钟。注意事项:1.答题前,考生务必将自己的姓名、报名号、座位号填写在答题卡上。2.第I卷每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。第II卷用黑色墨水签字笔在答题卡上书写作答,在试题卷上作答,答案无效。3.答非选择题时,如需作图,先用铅笔作图,然后用黑色签字笔描边。4.请保持答题卡平整,不能折叠。考试结束,监考员将试题卷、答题卡一并收回。可能用到的相对原子质量:H1 B11 C12 N14 O16 Ti48 Fe 56第I卷 选择题一、选择题(本题包括13小题,每小题6分,共78分.每小题只有一个选项符合题意)7.我国科学家首次实现了从二氧化碳到直链淀粉()的全合成,相关成果由学术期刊《科学》在线发表。下列说法错误的是A.淀粉和纤维素互为同分异构体B.淀粉是人体所需能量的主要来源C.由CO2等物质合成淀粉的过程涉及碳碳键的形成D.该研究成果能帮助人类应对全球气候变化、粮食安全等重大挑战8.每年10月23日上午6:02到晚上6:02被誉为“摩尔日”。设NA为阿伏加德罗常数的值,下列说法正确的是A.1molO2-核外电子数为8NAB.常温时,22gT2O中所含的中子数为12NAC.标准状况下,22.4LHF中含有HF分子数为NAD.1L0.1mol·L-1AlCl3溶液中含有A13+的数目为0.1NA9.下列实验设计能达到实验目的的是10.下列关于有机物的说法正确的是A.苯、乙醇和乙烯都能发生加成反应B.苯乙烯()易溶于水及甲苯C. 的一氯代物有四种D.CH2=CH-CH=CH2中所有原子不可能共平面11.短周期主族元素X、Y、Z、W的原子序数依次增大。X、W位于同一主族;Y、Z、W位于第三周期,Z的简单离子是该周期元素中简单离子半径最小的,Z和Y的原子序数之和是X的原子序数的3倍。下列说法错误的是A.X为地壳中含量最多的非金属元素 B.W的氧化物对应的水化物均为强酸C.Y的氢化物是离子化合物,有强还原性 D.工业上用电解熔融Z2X3的方法制备单质Z12.一种基于酸性燃料电池原理设计的酒精检测仪结构简图如下图所示。下列说法正确的是A.呼出气体的流速越快检测结果越准确B.内电路中电流方向:Pt2→质子交换膜→Pt1C.电路中流过2mol电子时,有11.2LO2被氧化D.负极的电极反应为:CH3CH2OH-4e-+H2O=CH3COOH+4H+13.T℃时,CdCO3和Cd(OH)2的沉淀溶解平衡曲线如图所示。已知pCd2+为Cd2+浓度的负对数,pN为阴离子浓度的负对数。下列说法正确的是A.曲线I是CdCO3的沉淀溶解平衡曲线B.加热可使溶液由X点变到Z点C.Y点对应的Cd(OH)2溶液是过饱和溶液D.T℃,在CdCO3(s)+2OH-(aq) Cd(OH)2(s)+CO32-(aq)平衡体系中,平衡常数K=1026.(15分)铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如图: 实验室中可用FeSO4(由铁粉和稀硫酸反应制得)和NH4HCO3用如图装置模拟上述流程中的“转化”环节。回答下列问题:(1)配制溶液所用的蒸馏水须先除去其中溶解的氧气,具体方法是 。(2)装置A用于制备FeSO4,实验过程中,欲将生成的FeSO4溶液与装置B中的NH4HCO3溶液混合,操作方法是关闭 ,打开 (填“K1”、“K2”或“K3”);装置B中生成FeCO3的离子方程式为 。(3)转化过程中温度不超过35℃,主要原因是 ;“过滤”环节,不需要使用下列仪器中的 (填仪器名称)。(4)干燥过程的主要目的是脱去游离水,该过程中会有少量 FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为 ;检验产品中是否含Fe3+需要的试剂有稀H2SO4和 (填化学式)。(5)取干燥后的FeCO3样品(含少量FeOOH)37.47g,与炭混合后焙烧,最终得到还原铁粉18.48g,计算样品中FeCO3的质量分数为 %(计算结果取整数)。27.(14分)铬是银白色有光泽的金属,易与其它金属形成合金,在国防、冶金、化学工业方面有重要用途。含铬废水有较大的毒性,处理达标后才能排放。工业上处理含铬废水(主要含铬微粒为Cr3+、CrO42-和Cr2O72-)并将其资源化的工艺有多种,其中一种工艺如图所示:已知:Cr(OH)3受热易分解。回答下列问题:(1) CrO42-中Cr元素的化合价为 。(2)加入 H2SO4酸化的目的是将CrO42--转变为Cr2O72-,不选用稀HC1酸化的原因可能 ,加入Na2S2O5固体,发生反应的离子方程式为 。(3)焦亚硫酸钠(Na2S2O5)的投加量对Cr(VI)含量的影响如图所示。焦亚硫酸钠的最佳投加量为 (mg·L-1)(4)“一系列操作”包含 和铝热反应。(5)工业上也常用电解法处理酸性含铬废水。用铁板作电极,在耐酸电解槽中盛放酸性含Cr2O72-的废水,原理如图所示。则与B相连的铁板为电解池的 极,阳极区溶液中所发生反应的离子方程式为 。为了使Cr3+和Fe3+转化为Fe(OH)3和Cr(OH)3沉淀,向反应后的溶液中加入一定量的烧碱,若溶液中c(Fe3+)=1.0×10-12mol·L-1,则溶液中c(Cr3+)= mol·L-1.{已如Ksp[Fe(OH)3]=2.8×10-39,Ksp[Cr(OH)3]=5.6×10-31} 28.(14分)研究CO2的综合利用、实现CO2资源化,是能源领域的重要发展方向,也是力争2030年前实现碳达峰、2060年前实现碳中和的方向之一。已知:反应I CO2(g)+H2(g)→CO(g)+H2O(g) ΔH1=+41.2 kJ/mol反应II 2CO(g)+4H2(g)→C2H4(g)+2H2O(g) ΔH2=-332 kJ/mol反应III 2CO2(g)+6H2(g) →C2H4(g)+4H2O(g) ΔH3(1)反应III中,ΔH3= kJ/mol.(2)在体积为2L的刚性密闭容器中,充入1molCO和2molH2,发生反应II,能判断反应达到平衡状态的是 (填字母序号)。a.2v(H2)=v(H2O) b.容器内压强保持不变c. 保持不变 d.C2H4的质量分数保持不变(3)在体积为2L的恒压密闭容器中,起始充入1molCO2(g)和3molH2(g),发生反应III,该反应在不同温度下达到平衡时,各组分的体积分数随温度的变化如图所示。①表示H2和C2H4的体积分数随温度变化的曲线分别是 (填字母序号)。②A、B、C三点对应的化学平衡常数KA、KB、KC从大到小的顺序为 。③240℃时,反应达到平衡后,容器中气体的总物质的量为 mol,H2(g)的平衡转化率为 。若平衡时总压为P,该反应的平衡常数Kp= (列出计算式。用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)。35.[化学-选修3:物质结构与性质](15分)钛(Ti)被称为“未来金属”,其化合物广泛用于国防、电讯器材、医疗器械和化工设备等领域。回答下列问题:(1)基态钛原子的价电子排布式为 ,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有 种。(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其它三种卤化物,自TiCl4至TiI4熔点依次升高,原因是 。(3)Ti(IV)的某配合物可用于催化环烯烃聚合,其结构如图所示:①配合物中H、C、O三种元素的电负性由大到小的排列顺序为 。②请在图中标出配位键 (用“→”表示);③配合物中非金属元素的含氧酸根的中心原子杂化轨道类型是sp2的是的是 。(4)用B掺杂TiN后(晶胞结构中只是B原子部分代替钛原子),其晶胞结构如图所示,距离Ti最近的B有 个,Ti与B的最近距离为 nm;掺杂B后的晶体密度是TiN晶体的 倍。(已知掺杂B后的晶体密度为ρg/cm3,阿伏加德罗常数的值为NA)36.[化学-选修5:有机化学基础](15分)他米巴罗汀是可用作急性髓性白血病、脊髓发育不良、小儿实体瘤等多种疾病治疗的药物,其合成路线如图所示:已知: 回答下列问题:(1)A的化学名称是 。A→B的反应条件为 。(2)C→D的反应为可逆反应,推测N(C2H5)3(一种有机碱)所起的作用为 。(3)E中所含官能团的名称为 。E→F的反应类型为 。(4)F→G的反应方程式为 。(5)H的结构简式为 。(6)满足下列条件的B的同分异构体有 种,其中核磁共振氢谱有五组峰,峰面积之比为3:2:2:2:1的结构简式为 。①苯环上有两个取代基;②1 mol 该同分异构体与1molNa2CO3反应生成1 mol CO2.
相关试卷
这是一份贵州省贵阳市2024届高三下学期适应性测试(一)化学试题,共12页。试卷主要包含了考试结束后,将答题卡交回,丙烯不溶于,能与、HCl反应,“类比”是化学学习的重要方法,化学反应在社会发展中运用广泛等内容,欢迎下载使用。
这是一份贵州省贵阳市2024届高三下学期2月适应性测试(一)化学试题(含答案),共15页。试卷主要包含了考试结束后,将答题卡交回,丙烯不溶于,能与、HCl反应,“类比”是化学学习的重要方法,化学反应在社会发展中运用广泛等内容,欢迎下载使用。
这是一份2024届贵州省贵阳市第一中学高三上学期9月适应性考试化学试题,共8页。








