

所属成套资源:2022届高考化学一轮复习常考题型练习含解析
2022届高考化学一轮复习常考题型60沉淀的转化综合题含解析
展开
这是一份2022届高考化学一轮复习常考题型60沉淀的转化综合题含解析,共17页。试卷主要包含了请将答案正确填写在答题卡上,下列离子方程式书写正确的是,下列操作能达到实验目的的是等内容,欢迎下载使用。
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
一、单选题(共14题)
1.在3 mL 0.1 ml·L-1NaCl溶液中加入2滴AgNO3溶液,出现白色沉淀,再加1滴KI溶液,沉淀变为黄色,再加入1滴Na2S溶液,沉淀又变为黑色。欲除去Ag2S中混有的AgCl杂质,应采用的方法是
A.加入NaCl溶液振荡后过滤B.加入Na2S溶液振荡后过滤
C.加入KI溶液振荡后过滤D.加入盐酸振荡后过滤
2.下列应用或现象主要体现的是沉淀溶解平衡原理的是
①可用FeS除去废水中的Cu2+
②溶洞的形成
③误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用后,常用0.5%的Na2SO4溶液解毒
④碳酸钡不能作“钡餐”而硫酸钡能
⑤泡沫灭火器灭火
A.①③④B.②③⑤C.③④⑤D.①②③④
3.常温下,几种铜盐的溶度积常数如下表所示。下列说法正确的是
A.常温下,溶解度:CuCl<CuBr
B.向含同浓度的CuCl2和FeCl2的溶液中滴加稀NaOH溶液,Cu2+先沉淀
C.向Cu(OH)2悬浊液中加入Na2S溶液,无明显现象
D.反应2CuCl+S2-Cu2S+2Cl-的平衡常数很小,反应几乎不进行
4.常温下,将氨水滴加至盛有固体的试管中至恰好完全溶解,发生反应,下列叙述中不正确的是
A.中元素的化合价为价
B.上述过程中的电离常数不变
C.所得溶液中:
D.上述实验说明:与之间有很强的结合力
5.下列离子方程式书写正确的是
A.向溶液中通入过量:
B.向粉末中加入过量稀硝酸:
C.向溶液滴加少量溶液:
D.向悬浊液中滴加过量的溶液:
6.下列事实中,不能用勒夏特列原理解释的是
A.在FeSO4溶液中加入少量铁粉以防止被氧化
B.为了除去水垢中的CaSO4,可先用溶液处理,使其转化为疏松、易溶于酸的
C.开启啤酒瓶后,瓶中立刻泛起大量泡沫
D.对于反应,往往需要在高压条件下进行,以提高SO3的产率
7.下列事实不能用勒夏特列原理解释的是
A.用溶液将锅炉水垢中的转化为
B.恒温下,由、、组成的平衡体系加压后颜色变深
C.配制溶液:将固体先溶解于浓盐酸,再稀释到所需浓度
D.石蕊()可发生电离:,可用作酸碱指示剂
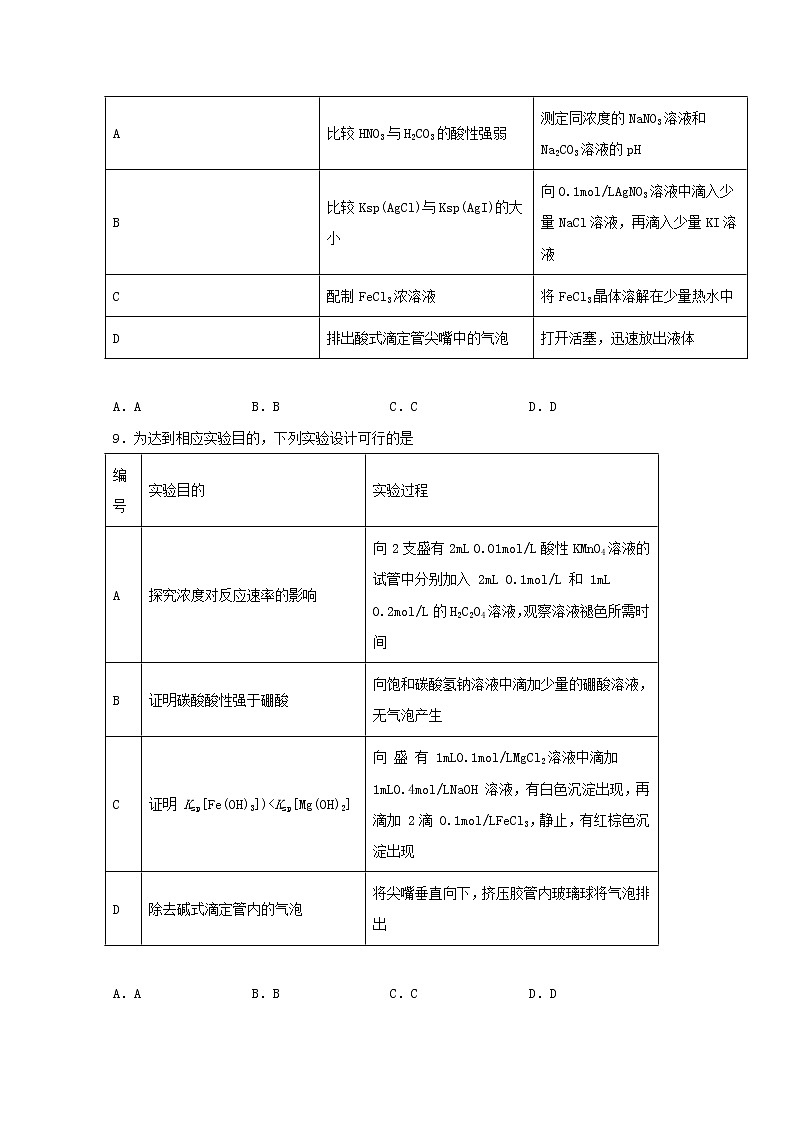
8.下列操作能达到实验目的的是
A.AB.BC.CD.D
9.为达到相应实验目的,下列实验设计可行的是
A.AB.BC.CD.D
10.已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12。下列有关说法正确的是(溶解度以ml/L表示)
A.25℃时,在c(Cl-)=c()=0.001ml/L的溶液中逐滴加入AgNO3溶液,首先生成Ag2CrO4(黄色)沉淀
B.25°C时,AgCl的溶解度小于Ag2CrO4的溶解度
C.在AgCl中加入稀K2CrO4溶液,搅拌,转化为黄色Ag2CrO4沉淀
D.25℃时,与水中相比,AgCl在AgNO3溶液中的溶解度、Ksp均要小
11.常温下,、分别在溶液中达到沉淀溶解平衡后,改变溶液,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
A.常温下,
B.加适量固体可使溶液由a点变到b点
C.c、d两点代表的溶液中与乘积相等
D.、分别在b、c两点代表的溶液中达到饱和
12.实验小组进行如下实验:已知:Cr2(SO4)3稀溶液为蓝紫色;Cr(OH)3为灰绿色固体,难溶于水。
下列关于该实验的结论或叙述不正确的是
A.操作II中仅发生反应:Cr3++3OH-═Cr(OH)3↓
B.①中生成蓝紫色溶液说明K2Cr2O7在反应中被还原
C.若继续向③中加入稀硫酸,溶液有可能重新变成蓝紫色
D.将①与③溶液等体积混合会产生灰绿色浑浊,该现象与Cr3+的水解平衡移动有关
13.常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如右图所示。下列有关说法正确的是
A.常温下,PbI2的Ksp为2×10-6
B.常温下,Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq)PbS(s)+2I-(aq)的化学平衡常数为5×1018
C.温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大
D.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小
14.已知常温下,几种难溶电解质的溶度积(Ksp):
下列说法不正确的是( )
A.在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B.在Mg(OH)2 的悬浊液中加入NaF 溶液后,Mg(OH)2 不可能转化为MgF2
C.CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质
D.向浓度均为1×10-3ml/L 的KCl 和K2CrO4混合液中滴加1×10-3m/LAgNO3溶液,Cl-先形成沉淀
二、填空题(共5题)
15.某研究小组进行的沉淀溶解平衡的实验探究。
[查阅资料]25℃时,,。
[制备试剂]向2支均盛有溶液的试管中分别加入2滴溶液,制得等量沉淀。
(1)分别向两支试管中加入不同试剂,请填写下表中的实验现象。
(2)同学们猜想产生试管1中现象的主要原因有以下两种。
猜想1:结合电离出的,使的沉淀溶解平衡正向移动。
猜想2:_______。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入和氨水混合液(pH=8),两支试管中氢氧化镁均溶解。该实验证明(2)中_______(填“猜想1”或“猜想2”)正确。
16.(1)对于Ag2S(s)⇌2Ag+(aq)+S2-(aq),其Ksp的表达式为_______
(2)下列说法不正确的是_______(填序号)。
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少
②一般来说,物质的溶解度随温度的升高而增加,故物质的溶解过程大多是吸热过程
③对于Al(OH)3(s)⇌Al3+(aq)+3OH-(aq)和Al(OH)3⇌Al3++3OH-,前者为溶解平衡,后者为电离平衡
④除去溶液中的Mg2+,用OH-沉淀比用CO好,说明Mg(OH)2的溶解度比MgCO3大
⑤沉淀反应中常加入过量的沉淀剂,其目的是使沉淀更完全
(3)如何除去Mg(OH)2中混有的Ca(OH)2_______
(4)已知在25 ℃时Ksp[Mg(OH)2]=3.2×10-11,向0.02 ml·L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为_______ml·L-1。
17.已知常温下,Ksp(PbSO4)=1.1×10-8,Ksp(PbCO3)=3.3×10-14,Ksp(PbS)=3.4×10-28。
(1)写出PbSO4溶解平衡的离子方程式______。
(2)常温下,溶解度:PbSO4_____(填“>”“Ksp(Ag2S),向悬浊液中滴加过量的溶液,AgCl转化为更难溶的Ag2S,反应的离子方程式为,D正确;
答案选D。
6.A
【分析】
勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应且存在平衡过程,否则勒夏特列原理不适用,据此解答。
【详解】
A.在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化,利用是铁粉的还原性,不涉及化学平衡移动知识,不能用勒夏特列原理解释,故A选;
B.为了除去水垢中的CaSO4,可先用溶液处理,使其转化为疏松、易溶于酸的,属于沉淀的转化,能用勒夏特列原理解释,故B不选;
C.因溶液中存在二氧化碳的溶解平衡,开启啤酒瓶后,压强减小,二氧化碳逸出,能用勒夏特列原理解释,故C不选;
D.为体积减小的可逆反应,增大压强平衡正向进行,能提高SO3的产率,所以能用勒夏特列原理解释,故D不选;
故选A。
7.B
【详解】
A.的溶解度小于的溶解度,所以用溶液将锅炉水垢中的转化为,然后用盐酸将转化为可溶性的盐,故A不符合题意;
B.由反应可知,该反应为恒压反应,所以在恒温下,改变体系压强,体系颜色会加深,但平衡不发生移动,故B符合题意;
C.配制溶液:将固体先溶于浓盐酸,防止铁离子水解,然后用蒸馏水稀释到所需的浓度,故C不符合题意;
D.石蕊()可发生电离:,在酸性环境条件下平衡逆向移动,在碱性条件下平衡正向移动,故D不符合题意。
答案选B。
8.D
【详解】
A.比较HNO3与H2CO3的酸性强弱,可测定同浓度的NaNO3溶液和NaHCO3溶液的pH,A与题意不符;
B.实验中Ag+过量,不能确定是否存在AgCl转化为 AgI,B与题意不符;
C.配制FeCl3浓溶液应将FeCl3晶体溶解在浓盐酸中,再适当稀释,以抑制 Fe3+水解,C与题意不符;
D.排出酸式滴定管尖嘴中的气泡的方法是打开活塞,迅速放出液体以冲出气泡,使尖嘴部分充满溶液,D符合题意。
答案选D。
9.B
【详解】
A.高锰酸钾不足,但是溶液总体积不同,不能探究浓度对反应速率的影响,A项不可行;
B.向饱和碳酸氢钠溶液中滴加少量的硼酸溶液,无气泡产生,可以证明碳酸酸性强于硼酸,B项可行;
C.向 盛 有 1mL0.1ml/LMgCl2溶液中滴加1mL0.4ml/LNaOH 溶液,有白色沉淀出现,再滴加 2滴 0.1ml/LFeCl3,静止,有红棕色沉淀出现,由于与氯化镁反应后氢氧化钠过量,过量的氢氧化钠与氯化铁形成氢氧化铁沉淀,不能证明发生了沉淀的转化,故不能证明Ksp[Fe(OH)3]) 将固体浸泡于饱和Na2CO3溶液,过滤,再用硝酸溶解PbCO3 C
【详解】
(1) PbSO4是强电解质,其电离方程式是,PbSO4溶解平衡的离子方程式;
(2) 由Ksp(PbSO4)=1.1×10-8、Ksp(PbCO3)=3.3×10-14,可知溶解度PbSO4>PbCO3;
(3) 将固体浸泡于饱和Na2CO3溶液生成溶解度更小的PbCO3,过滤,再用硝酸溶解PbCO3得到Pb(NO3)2;
(4) PbS比、PbCO3更难溶,所以处理废水中的Pb2+宜选择的试剂是Na2S;
(5)向浓度相等的Na2SO4和Na2CO3溶液中滴加Pb(NO3)2溶液,同时产生两种沉淀时,。
18.Zn2++S2-=ZnS↓ 在 ZnS 中存在平衡,ZnS(s) Zn2+(aq)+S2-(aq),当加入CuSO4溶液时,Cu2+会与S2-结合,生成溶解度更小的CuS黑色沉淀,使平衡正向移动, ZnS 转化为 CuS 由ZnS的Ksp=1.6×10-24可知,Ksp=c(Zn2+)×c(S2-),则c(S2-)===1.26×10-12ml·L-1,c(Fe2+)=0.1ml·L-1,Qc= c(Fe2+)× c(S2-)=0.1×1.26×10-12=1.26×10-13,因为KSP(FeS)=6.3×10-18,所以Qc>KSP,因此产生FeS沉淀
【分析】
根据题中信息可知,试管I发生ZnSO4+Na2S=ZnS↓+Na2SO4,试管II发生沉淀的转化,生成溶解度更小的CuS,即ZnS+CuSO4=CuS+ZnSO4;根据Qc与Ksp的关系,判断是否产生沉淀;据此解答。
【详解】
(1)由题中信息可知,试管IZnSO4溶液中滴加Na2S溶液,二者发生化学反应,生成白色ZnS沉淀,即Zn2++S2-=ZnS↓;答案为Zn2++S2-=ZnS↓。
(2)由试管 II 中观察到白色沉淀转化为黑色沉淀可知,在 ZnS 中存在平衡,ZnS(s) Zn2+(aq)+S2-(aq),当加入CuSO4溶液时,Cu2+会与S2-结合,生成溶解度更小的CuS黑色沉淀,使平衡正向移动, ZnS 转化为 CuS;答案为在 ZnS 中存在平衡,ZnS(s) Zn2+(aq)+S2-(aq),当加入CuSO4溶液时,Cu2+会与S2-结合,生成溶解度更小的CuS黑色沉淀,使平衡正向移动, ZnS 转化为 CuS。
(3)因为ZnS(s) Zn2+(aq)+S2-(aq),由ZnS的Ksp=1.6×10-24可知,Ksp=c(Zn2+)×c(S2-),则c(S2-)===1.26×10-12ml·L-1,c(Fe2+)=0.1ml·L-1,Qc= c(Fe2+)× c(S2-)=0.1×1.26×10-12=1.26×10-13,因为KSP(FeS)=6.3×10-18,所以Qc>KSP,因此产生FeS沉淀;答案为由ZnS的Ksp=1.6×10-24可知,Ksp=c(Zn2+)×c(S2-),则c(S2-)===1.26×10-12ml·L-1,c(Fe2+)=0.1ml·L-1,Qc= c(Fe2+)× c(S2-)=0.1×1.26×10-12=1.26×10-13,因为KSP(FeS)=6.3×10-18,所以Qc>KSP,因此产生FeS沉淀。
19.出现白色沉淀 溶液中存在平衡:AgSCN(s)⇌Ag+(aq) + SCN-(aq),因为溶解度:AgSCN > AgI(或Ksp(AgI)<Ksp (AgSCN)加入KI后,Ag+与I-反应生成更难溶的AgI,使上述平衡正向移动 4.0×10‾10
【详解】
(1)加入硝酸银,银离子和硫氰酸根离子发生反应:Ag++SCN−⇌AgSCN,得到AgSCN白色沉淀,故答案为出现白色沉淀;
(2)溶液中存在溶解平衡:AgSCN(s)⇌Ag+(aq)+SCN−(aq),加入KI后,因为溶解度:AgI AgI(或Ksp(AgI)<Ksp (AgSCN)加入KI后,Ag+与I-反应生成更难溶的AgI,使上述平衡正向移动;
(3)向50mL0.005ml/L的AgNO3溶液中加入150mL0.005ml/L的KSCN溶液,KSCN过量,溶液中剩余c(SCN−)=0.005ml/L×(0.15−0.05)L÷(0.15+0.05)L=0.0025ml/L,则c(Ag+)=Ksp(AgSCN)÷c(SCN−)=10−12/0.0025=4×10-10ml/L,故答案为4.0×10‾10。化合物
CuCl
CuBr
Cu2S
Cu(OH)2
Fe(OH)2
CuS
Ksp
8×10-16
目的
操作
A
比较HNO3与H2CO3的酸性强弱
测定同浓度的NaNO3溶液和Na2CO3溶液的pH
B
比较Ksp(AgCl)与Ksp(AgI)的大小
向0.1ml/LAgNO3溶液中滴入少量NaCl溶液,再滴入少量KI溶液
C
配制FeCl3浓溶液
将FeCl3晶体溶解在少量热水中
D
排出酸式滴定管尖嘴中的气泡
打开活塞,迅速放出液体
编号
实验目的
实验过程
A
探究浓度对反应速率的影响
向 2 支盛有 2mL 0.01ml/L 酸性 KMnO4溶液的试管中分别加入 2mL 0.1ml/L 和 1mL 0.2ml/L的 H2C2O4 溶液,观察溶液褪色所需时间
B
证明碳酸酸性强于硼酸
向饱和碳酸氢钠溶液中滴加少量的硼酸溶液,无气泡产生
C
证明 Ksp[Fe(OH)3])
相关试卷
这是一份2022届高考化学一轮复习常考题型61沉淀的转化含解析,共14页。试卷主要包含了请将答案正确填写在答题卡上,表示下列反应的方程式错误的是,下列离子方程式书写错误的是等内容,欢迎下载使用。
这是一份2022届高考化学一轮复习常考题型59沉淀的溶解与生成综合题含解析,共18页。试卷主要包含了请将答案正确填写在答题卡上,下表是五种银盐的溶度积常数,已知等内容,欢迎下载使用。
这是一份2022届高考化学一轮复习常考题型57沉淀溶解平衡的应用综合题含解析,共18页。试卷主要包含了请将答案正确填写在答题卡上,25℃时,,,下列说法正确的是等内容,欢迎下载使用。









