
所属成套资源:江苏省启东、通州-2022学年高三上学期期末试卷及答案
江苏省启东、通州2021-2022学年高三上学期期末考试化学含答案
展开
这是一份江苏省启东、通州2021-2022学年高三上学期期末考试化学含答案,共9页。
(满分:100分 考试时间:75分钟)
2022.1
可能用到的相对原子质量:H—1 C—12 O—16 Na—23
一、 单项选择题:共14题,每题3分,共42分。每题只有一个选项最符合题意。
1. 化学与生产、生活密切相关。下列说法不正确的是( )
A. 高铁车厢材料铝合金具有强度大、质量轻、耐腐蚀等优点
B. 华为5G手机使用的麒麟芯片,其主要成分为SiC
C. 医用口罩中无纺布的主要成分为聚丙烯,其原料来源于石油化工产品
D. 核酸检测是确认病毒类型的有效手段,核酸是含磷的生物高分子化合物
2. 反应2NH3+NaClO===N2H4+NaCl+H2O可用于制备N2H4,下列说法正确的是( )
A. NH3是非极性分子 B. NaCl的电子式为
C. NaClO既含离子键又含共价键 D. N2H4中N原子采取sp2杂化
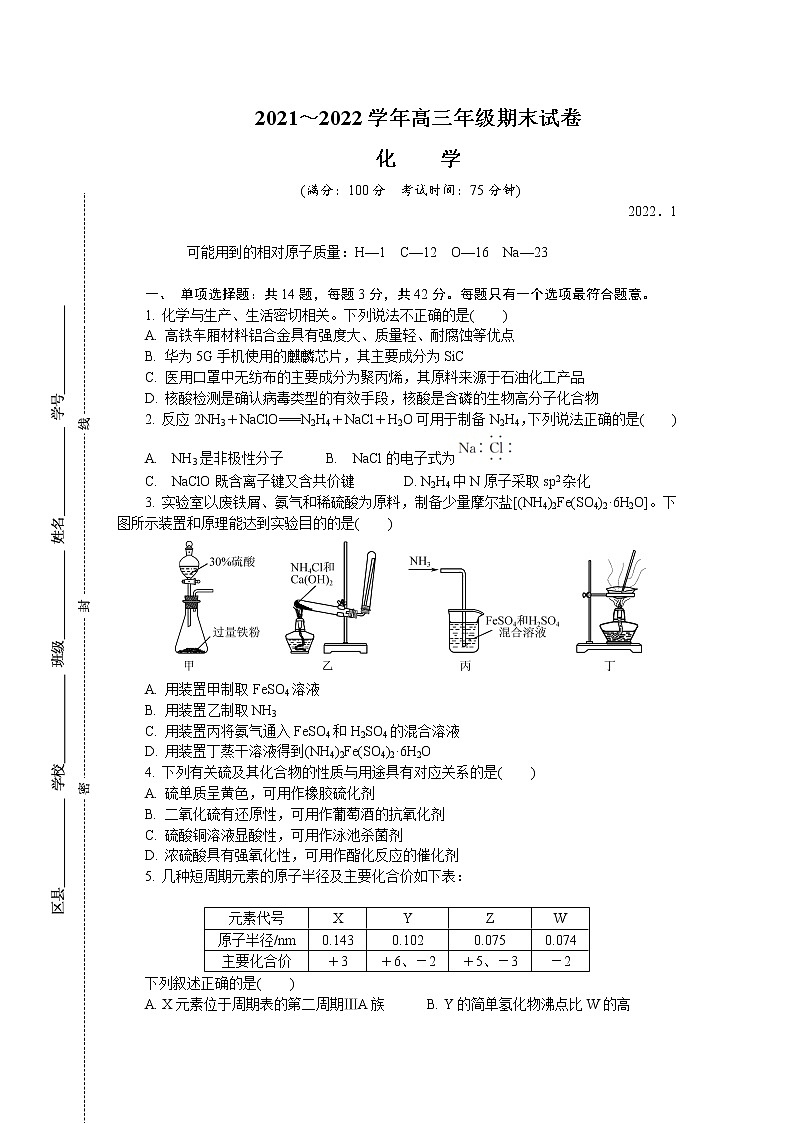
3. 实验室以废铁屑、氨气和稀硫酸为原料,制备少量摩尔盐[(NH4)2Fe(SO4)2·6H2O]。下图所示装置和原理能达到实验目的的是( )
A. 用装置甲制取FeSO4溶液
B. 用装置乙制取NH3
C. 用装置丙将氨气通入FeSO4和H2SO4的混合溶液
D. 用装置丁蒸干溶液得到(NH4)2Fe(SO4)2·6H2O
4. 下列有关硫及其化合物的性质与用途具有对应关系的是( )
A. 硫单质呈黄色,可用作橡胶硫化剂
B. 二氧化硫有还原性,可用作葡萄酒的抗氧化剂
C. 硫酸铜溶液显酸性,可用作泳池杀菌剂
D. 浓硫酸具有强氧化性,可用作酯化反应的催化剂
5. 几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
A. X元素位于周期表的第二周期ⅢA族 B. Y的简单氢化物沸点比W的高
C. 第一电离能:I1(Z)>I1(W)>I1(Y) D. Z的含氧酸酸性一定比Y的强
阅读下列资料,完成6~8题。
NH3是重要的化工原料,可用于某些配合物的制备,如NiSO4溶于氨水形成[Ni(NH3)6]SO4。工业上常采用氨氧化法制硝酸,其流程是将氨和空气混合后通入灼热的铂铑合金网,反应生成NO(g),生成的一氧化氮与残余的氧气继续反应生成二氧化氮:2NO(g)+O2(g)===2NO2(g);ΔH=-116.4 kJ·ml-1。随后将二氧化氮通入水中制取硝酸。
工业上一般用石灰乳吸收硝酸工业尾气(NO和NO2),由于NO不能被碱吸收,一般控制NO和NO2约为1∶1通入石灰乳,净化尾气的同时又可制得混凝土添加剂Ca(NO2)2。
6. 下列有关[Ni(NH3)6]SO4的说法正确的是( )
A. 配体为NH3,其空间构型为平面三角形
B. 1 ml [Ni(NH3)6]2+中σ键的数目为18 ml
C. [Ni(NH3)6]2+中H—N—H的键角大于NH3中的键角
D. 由于[Ni(NH3)6]SO4是配合物,故向其中滴加BaCl2溶液不会生成沉淀
7. 对于反应2NO(g)+O2(g)⇌2NO2(g),下列说法正确的是( )
A. 该反应能够自发的原因是ΔS>0
B. 工业上使用合适的催化剂可提高NO2的生产效率
C. 升高温度,该反应v(逆)增大,v(正)减小,平衡向逆反应方向移动
D. 2 ml NO(g)和1 ml O2(g)中所含化学键能总和比2 ml NO2(g)中大116.4 kJ·ml-1
8. 在指定条件下,下列选项所示的物质间转化能实现的是( )
A. NO(g) eq \(――→,\s\up7(NaOH)) NaNO2(aq) B. 稀HNO3(aq) eq \(――→,\s\up7(Cu)) NO2(g)
C. NO2(g) eq \(――→,\s\up7(H2O)) NO(g) D. NH3·H2O(g) eq \(――→,\s\up7(SO2)) (NH4)2SO4(aq)
9. 某小组用硫铜矿煅烧废渣(主要含Fe2O3、CuO、FeO)为原料制取Cu2O,流程如下:
下列说法不正确的是( )
A. “调节pH”主要目的是为了除去Fe3+
B. “还原”过程中主要发生的反应为4CuSO4+N2H4+8KOH eq \(=====,\s\up7(90 ℃)) 2Cu2O+N2↑+4K2SO4+6H2O
C. 用N2H4还原制取Cu2O的优点是产生N2氛围,可防止产品被氧化
D. Cu2O的晶胞结构如右图所示,其中X代表的是Cu+
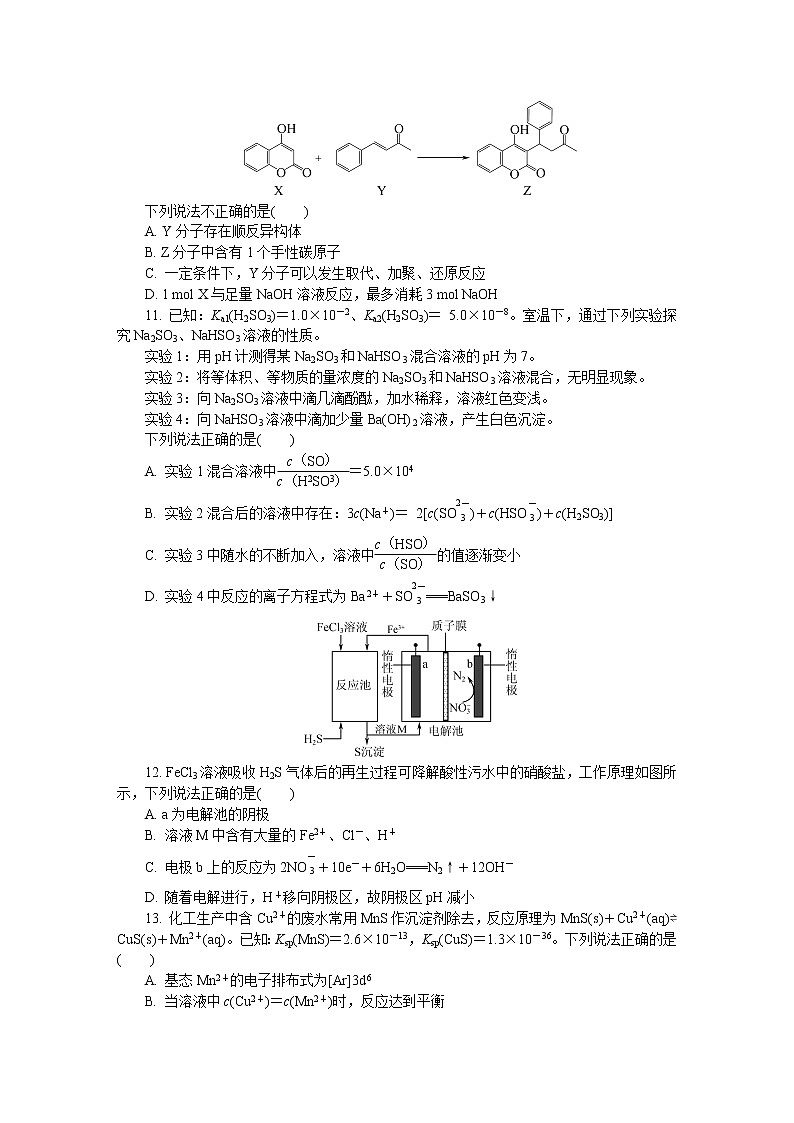
10. 化合物Z(华法林)是一种香豆素类抗凝剂,可由下列反应制得:
下列说法不正确的是( )
A. Y分子存在顺反异构体
B. Z分子中含有1个手性碳原子
C. 一定条件下,Y分子可以发生取代、加聚、还原反应
D. 1 ml X与足量NaOH溶液反应,最多消耗3 ml NaOH
11. 已知:Ka1(H2SO3)=1.0×10-2、Ka2(H2SO3)= 5.0×10-8。室温下,通过下列实验探究Na2SO3、NaHSO3溶液的性质。
实验1:用pH计测得某Na2SO3和NaHSO3混合溶液的pH为7。
实验2:将等体积、等物质的量浓度的Na2SO3和NaHSO3溶液混合,无明显现象。
实验3:向Na2SO3溶液中滴几滴酚酞,加水稀释,溶液红色变浅。
实验4:向NaHSO3溶液中滴加少量Ba(OH)2溶液,产生白色沉淀。
下列说法正确的是( )
A. 实验1混合溶液中 eq \f(c(SO eq \\al(\s\up1(2-),\s\d1(3)) ),c(H2SO3)) =5.0×104
B. 实验2混合后的溶液中存在:3c(Na+)= 2[c(SO eq \\al(\s\up1(2-),\s\d1(3)) )+c(HSO eq \\al(\s\up1(-),\s\d1(3)) )+c(H2SO3)]
C. 实验3中随水的不断加入,溶液中 eq \f(c(HSO eq \\al(\s\up1(-),\s\d1(3)) ),c(SO eq \\al(\s\up1(2-),\s\d1(3)) )) 的值逐渐变小
D. 实验4中反应的离子方程式为Ba2++SO eq \\al(\s\up1(2-),\s\d1(3)) ===BaSO3↓
12. FeCl3溶液吸收H2S气体后的再生过程可降解酸性污水中的硝酸盐,工作原理如图所示,下列说法正确的是( )
A. a为电解池的阴极
B. 溶液M中含有大量的Fe2+、Cl-、H+
C. 电极b上的反应为2NO eq \\al(\s\up1(-),\s\d1(3)) +10e-+6H2O===N2↑+12OH-
D. 随着电解进行,H+移向阴极区,故阴极区pH减小
13. 化工生产中含Cu2+的废水常用MnS作沉淀剂除去,反应原理为MnS(s)+Cu2+(aq)⇌CuS(s)+Mn2+(aq)。已知:Ksp(MnS)=2.6×10-13,Ksp(CuS)=1.3×10-36。下列说法正确的是( )
A. 基态Mn2+的电子排布式为[Ar]3d6
B. 当溶液中c(Cu2+)=c(Mn2+)时,反应达到平衡
C. MnS(s)+Cu2+(aq)⇌CuS(s)+Mn2+(aq),该反应的平衡常数K=2.0×1023
D.反应后上层清液中一定存在:c(S2-)> eq \f(Ksp(MnS),c(Mn2+))
14. 甲醇水蒸气重整制氢(SRM)是获取理想氢源的有效方法。重整过程发生的反应如下:
反应Ⅰ:CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g);ΔH1=+49.4 kJ·ml-1
反应Ⅱ:CH3OH(g)⇌CO(g)+2H2(g);ΔH2=+92 kJ·ml-1
在常压、催化剂下,向密闭容器中充入1 ml CH3OH和1.2 ml H2O混合气体,t时刻测得CH3OH转化率及CO、CO2的选择性随温度变化情况如下图所示。下列说法正确的是( )
A. 选择300 ℃作为反应温度比较适宜
B. 工业生产中一般选用负压(低于大气压)条件下制氢
C. 选用CO2选择性较高的催化剂有利于提高CH3OH的平衡转化率
D. 270 ℃时,容器中的H2(g)约为2.744 ml
二、 非选择题:共4题,共58分。
15. (12分)电解金属锰阳极渣(主要成分MnO2,杂质为Pb、Fe、Cu元素的化合物)和黄铁矿(FeS2)为原料可制备Mn3O4,其流程如图所示:
已知:Ksp(MnF2)= 5.0×10-3、Ksp(CaF2)= 3.5×10-11,回答下列问题:
(1) “酸浸”时,所用的稀酸X是________。
图1
(2) “酸浸”过程中,Fe2+、Fe3+的质量浓度、Mn浸出率与时间的关系如图1所示。
① 20~80 min内,浸出Mn元素的主要离子方程式为________。
② 80~100 min时,Fe2+浓度上升的原因可能是______________________________________________________。
(3) 若“净化”过程中Mn2+的浓度为2 ml·L-1,则此时Ca2+的浓度为________ml·L-1。
(4) MnSO4制取Mn3O4的一种流程如图2。在搅拌下向50 mL 1 ml·L-1 MnSO4溶液中缓慢滴加1 ml·L-1 NH4HCO3,则加入NH4HCO3溶液的体积至少为________mL。
16. (14分)化合物F是合成一种镇痛药物的重要中间体,其合成路线如图:
注:Ts—为
(1) A分子中采取sp3杂化的碳原子数目是________________。
(2) 设计“B→C”步骤的目的是________________。
(3) 可用于鉴别B和C的常用化学试剂为________________。
(4) F的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
① 分子中含有苯环;② 能发生银镜反应;③ 核磁共振氢谱中有3个吸收峰。
(5) 已知:
请设计以为原料制备的合成路线(无机试剂和有机溶剂任用,合成路线示例见本题题干)。
17. (16分)铬(Cr)属于分布较广的元素之一,其单质与化合物在颜料、纺织、电镀、制革等方面都有着重要作用。
(1) 氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,可通过甲醇还原铬酸钠(Na2CrO4)制备。其实验装置和步骤如下:
Ⅰ.将一定量铬酸钠、甲醇与水的混合物加入三颈瓶;
Ⅱ.缓慢滴加足量盐酸,保持温度在100 ℃反应3 h;
Ⅲ.冷却后加入NaOH,得到Cr(OH)3沉淀;
Ⅳ. 洗净沉淀,加入理论用量1.1倍的盐酸溶解后,通过结晶法得到CrCl3·6H2O晶体。
回答下列问题:
① 装置b的主要作用除导气外,还有________________。
② 步骤Ⅱ中的反应会有CO2生成,请写出反应的化学方程式:________________。
③ 步骤Ⅳ中,盐酸过量的原因是________________。
(2) 已知:碱性条件下,H2O2能把Cr(Ⅲ)氧化为CrO eq \\al(\s\up1(2-),\s\d1(4)) ;酸性条件下,H2O2能把Cr2O eq \\al(\s\up1(2-),\s\d1(7)) 还原为Cr3+;Pb2+形成Pb(OH)2开始沉淀pH为5,完全沉淀pH为8。
以CrCl3·6H2O和Pb(NO3)2为原料可制备铬酸铅(PbCrO4难溶于水),具体步骤如下:边搅拌边向CrCl3·6H2O晶体中加入2 ml·L-1的NaOH溶液至产生的沉淀完全溶解,得到NaCrO2溶液,________。过滤,冷水洗涤,烘干,得到铬酸铅产品[实验中须使用的试剂:H2O2溶液、6 ml·L-1的醋酸溶液、0.5 ml·L-1的Pb(NO3)2溶液]。
(3) 由含铬污水(主要含CrO eq \\al(\s\up1(2-),\s\d1(4)) )制备具有磁性的铁铬氧体(CrxFeyOz)的流程如下:
FeSO4的作用是将CrO eq \\al(\s\up1(2-),\s\d1(4)) 还原为Cr3+,通入的空气主要是将部分Fe2+氧化。若处理含1 ml CrO eq \\al(\s\up1(2-),\s\d1(4)) 的污水时,投入的FeSO4的物质的量为14 ml,且沉淀时消耗O2的物质的量为1.5 ml(清液中不含铬元素和铁元素)。则形成的铁铬氧体的化学式为________。(写出计算过程)
18. (16分)有效去除大气中的NOx和水体中的氮是环境保护的重要课题。
(1) 已知:① 2CO(g)+O2(g)===2CO2(g);ΔH1=-566.0 kJ·ml-1
② N2(g)+2O2(g)===2NO2(g);ΔH2=+64 kJ·ml-1
反应2NO2(g)+4CO(g)===N2(g)+4CO2(g);ΔH3=________。
图1
(2) 磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(NH eq \\al(\s\up1(+),\s\d1(4)) 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含NH eq \\al(\s\up1(+),\s\d1(4)) ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。
① 生成磷酸铵镁沉淀的离子反应方程式为____________________________________________________。
② 测得反应pH对氨氮去除率的影响如图1所示,当pH从7.5增至9.0的过程中,水中氨氮的去除率明显增加,原因是________。
③ 当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是________。
(3) 纳米零价铁(NZVI)/BC与(CuPd)/BC联合作用可去除水体中的硝态氮。
在NZVI/BC和(CuPd)/BC复合材料联合作用的体系中,生物炭(BC)作为NZVI、Cu、Pb的载体且减少了纳米零价铁的团聚,纳米零价铁作为主要还原剂,Cu和Pd作为催化剂且参与吸附活性H。
① NZVI/BC和(CuPd)/BC复合材料还原硝酸盐的反应机理如图2所示,NO eq \\al(\s\up1(-),\s\d1(3)) 转化为N2或NH eq \\al(\s\up1(+),\s\d1(4)) 的过程可描述为________。
② 实验测得体系初始pH对NO eq \\al(\s\up1(-),\s\d1(3)) 去除率的影响如图3,前200 min内,pH=9.88时的去除率远低于pH=4.05时,其可能的原因是________。
2021~2022学年高三年级期末试卷(启东、通州)
化学参考答案及评分标准
1. B 2. C 3. A 4. B 5. C 6. C 7. B 8. C 9. D 10. D 11. A 12. B 13. C 14. D
15. (12分)
(1) 稀硫酸(写化学式H2SO4也得分)(2分)
(2) ① 3MnO2+2FeS2+12H+===3Mn2++4S+2Fe3++6H2O(3分)
(反应物、产物均正确2分,配平正确1分)
② 80~100 min时,MnO2浸出率很高,剩余MnO2较少,FeS2浸出的Fe2+与MnO2接触机会减少,所以Fe2+浓度上升 (3分)
(“MnO2浸出率已很高,剩余MnO2较少”得1分,“Fe2+与MnO2接触机会减少”得2分)
(3) 1.4×10-8(2分)
(4) 100(2分)
16. (14分)
(1)4 (2分)
(2)保护酚羟基(2分)
(3)FeCl3溶液(2分)
(每步骤1分,前面步骤产物和条件错误,则后续步骤不再得分,5分)
17. (16分)
(1) ① 冷凝回流(2分)
(如回答“冷凝”或“回流”得1分)
② 2Na2CrO4+CH3OH+10HCl eq \(=====,\s\up7(100 ℃)) 2CrCl3+CO2↑+4NaCl+7H2O(3分)
(反应物、产物正确2分,配平、条件、气体符号共1分)
③ 抑制Cr3+的水解(2分)
(2) 先向溶液中加过量H2O2溶液,煮沸,再向溶液中加6 ml·L-1的醋酸调节pH约为5,再滴加0.5 ml·L-1的Pb(NO3)2溶液至不再产生沉淀(5分)
[“加过量H2O2溶液”1分,“煮沸”1分,“6 ml·L-1的醋酸”1分,“调节pH约为5或略小于5”1分,“0.5 ml·L-1的Pb(NO3)2溶液至不再产生沉淀”1分]
(3) 铁铬氧体中n(Cr3+)=n(CrO eq \\al(\s\up1(2-),\s\d1(4)) )=1 ml
根据电子守恒:n(Fe3+)=3n(CrOeq \\al(\s\up1(2-),\s\d1(4)))+4n(O2)=9 ml(1分)
根据铁元素守恒:n(Fe2+)=14 ml-9 ml=5 ml(1分)
根据电荷守恒:n(O2-)= eq \f(2×5 ml+3×9 ml+3×1 ml,2) =20 ml(1分)
铁铬氧体中n(Cr)∶n(Fe)∶n(O)=1∶14∶20(1分)
铁铬氧体的化学式为CrFe14O20
18. (16分)
(1) -1 196 kJ·ml-1(2分)
(2) ① Mg2++OH-+NH eq \\al(\s\up1(+),\s\d1(4)) +HPO eq \\al(\s\up1(2-),\s\d1(4)) ===MgNH4PO4↓+H2O (2分)
(反应物、产物正确1分,配平、符号共1分)
② 随着pH的增大,HPO eq \\al(\s\up1(2-),\s\d1(4)) 转化为PO eq \\al(\s\up1(3-),\s\d1(4)) ,c(PO eq \\al(\s\up1(3-),\s\d1(4)) )浓度增大,使得生成沉淀的反应速率加快,氨氮去除率增加(3分)
[答“HPO eq \\al(\s\up1(2-),\s\d1(4)) 转化为PO eq \\al(\s\up1(3-),\s\d1(4)) ,c(PO eq \\al(\s\up1(3-),\s\d1(4)) )浓度增大”得2分,“使得生成沉淀的反应速率加快”1分]
③ OH-浓度增大,使得Mg2+生成Mg(OH)2,MgNH4PO4沉淀会转化为Mg(OH)2沉淀,释放NH eq \\al(\s\up1(+),\s\d1(4)) ,促使溶液中氨氮的去除率下降(3分)
(“MgNH4PO4沉淀会转化为Mg(OH)2沉淀”2分,“释放NH eq \\al(\s\up1(+),\s\d1(4)) ”1分)
(3) ① NO eq \\al(\s\up1(-),\s\d1(3)) 在铁表面得到电子被还原为NO eq \\al(\s\up1(-),\s\d1(2)) ,NO eq \\al(\s\up1(-),\s\d1(2)) 被吸附在Cu和Pd表面的活性H继续还原为N2或NH eq \\al(\s\up1(+),\s\d1(4)) (3分)
(答到1点得1分,答全2点得3分)
② 酸性越强,Fe越易失去电子,NO eq \\al(\s\up1(-),\s\d1(3)) 越易得到电子被还原;酸性越强,H+浓度大,可以减少表面氢氧化物的形成,从而可以暴露更多的反应活性位点,促进反应的进行(3分)
(“酸性越强,Fe越易失去电子,NO eq \\al(\s\up1(-),\s\d1(3)) 越易得到电子被还原”1分;“减少表面氢氧化物的形成,从而可以暴露更多的反应活性位点,促进反应的进行”2分)
元素代号
X
Y
Z
W
原子半径/nm
0.143
0.102
0.075
0.074
主要化合价
+3
+6、-2
+5、-3
-2
相关试卷
这是一份2023南通通州区高三上学期期末考试化学含答案,共15页。试卷主要包含了 单项选择题, 非选择题等内容,欢迎下载使用。
这是一份2023北京通州区高三上学期期末考试化学PDF版含答案,文件包含2023北京通州高三期末化学试题pdf、2023北京通州高三期末化学试题答案pdf等2份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。
这是一份2021江苏省启东中学高三上学期期初考试化学PDF版含答案









