



浙江专用高考化学总复习专题认识物质世界学科核心素养提升2“用量改变型”和“信息给予型”离子方程式书写课件
展开
这是一份浙江专用高考化学总复习专题认识物质世界学科核心素养提升2“用量改变型”和“信息给予型”离子方程式书写课件,共22页。
学科核心素养提升2 “用量改变型”和“信息给予型”离子方程式书写
1.反应生成的离子因又能跟剩余(过量)的反应物继续反应而使产物跟用量有关。(1)可溶性多元弱酸(或其酸酐)与碱溶液反应。如CO2通入NaOH溶液中:碱过量:CO2+2OH- C +H2O;碱不足:CO2+OH- HC 。(2)多元弱酸盐与强酸反应。如Na2CO3溶液与稀盐酸:盐酸不足:C +H+ HC ;盐酸过量:C +2H+ CO2↑+H2O。
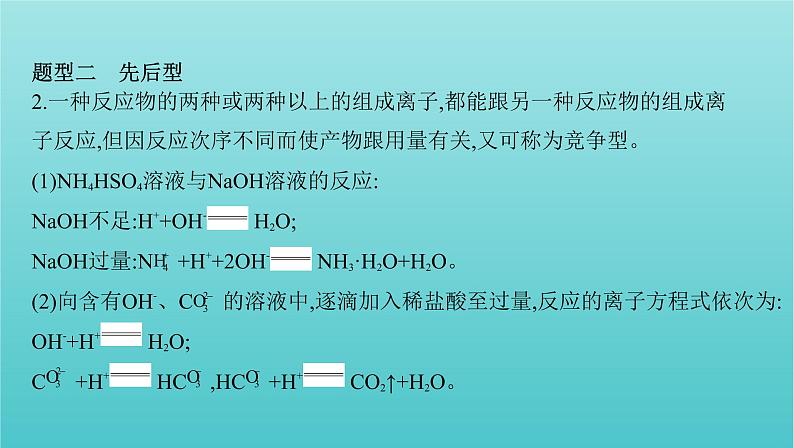
2.一种反应物的两种或两种以上的组成离子,都能跟另一种反应物的组成离
子反应,但因反应次序不同而使产物跟用量有关,又可称为竞争型。(1)NH4HSO4溶液与NaOH溶液的反应:NaOH不足:H++OH- H2O;NaOH过量:N +H++2OH- NH3·H2O+H2O。(2)向含有OH-、C 的溶液中,逐滴加入稀盐酸至过量,反应的离子方程式依次为:OH-+H+ H2O;C +H+ HC ,HC +H+ CO2↑+H2O。
3.当一种反应物中有两种或两种以上的组成离子参与反应时,因其组成比例
不协调(一般为复盐或酸式盐),当一种组成离子恰好完全反应时,另一种组成
离子不能恰好完全反应(有剩余或不足),因而使产物与用量有关。(1)Ca(HCO3)2溶液与NaOH溶液反应:NaOH不足:Ca2++HC +OH- CaCO3↓+H2O;NaOH过量:Ca2++2HC +2OH- CaCO3↓+2H2O+C 。(2)NaHCO3溶液与Ca(OH)2溶液反应:NaHCO3不足:HC +OH-+Ca2+ CaCO3↓+H2O;NaHCO3过量:Ca2++2OH-+2HC CaCO3↓+C +2H2O。
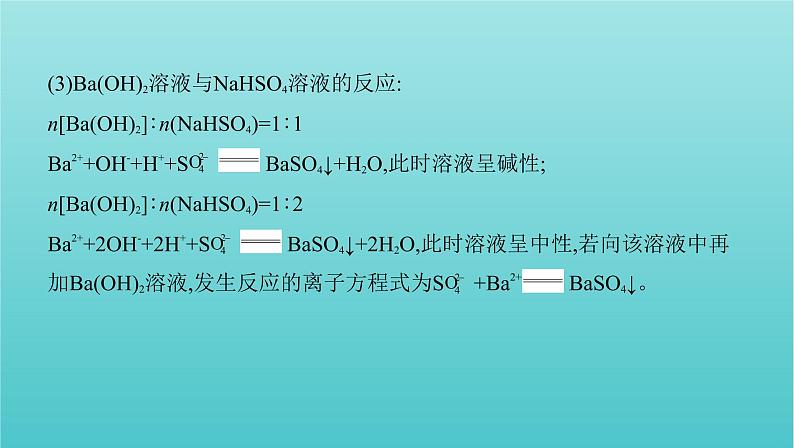
(3)Ba(OH)2溶液与NaHSO4溶液的反应:n[Ba(OH)2]∶n(NaHSO4)=1∶1Ba2++OH-+H++S BaSO4↓+H2O,此时溶液呈碱性;n[Ba(OH)2]∶n(NaHSO4)=1∶2Ba2++2OH-+2H++S BaSO4↓+2H2O,此时溶液呈中性,若向该溶液中再加Ba(OH)2溶液,发生反应的离子方程式为S +Ba2+ BaSO4↓。
名师点拨“定一法”书写酸式盐与碱反应的离子方程式(1)根据相对量将少量物质定为“1 ml”,若少量物质有两种或两种以上的
离子参加反应,则参加反应离子的物质的量之比与物质组成之比相符。(2)依据少量物质中离子的物质的量,确定过量物质中实际参加反应的离子的
物质的量。(3)依据“先中和后沉淀”的思路正确书写离子方程式。
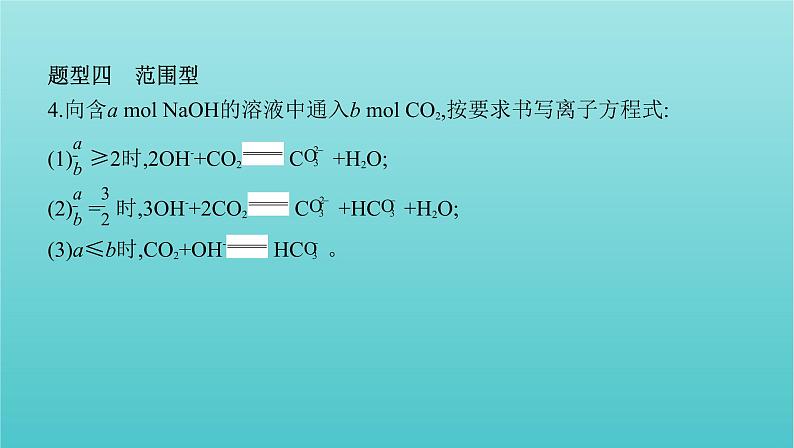
4.向含a ml NaOH的溶液中通入b ml CO2,按要求书写离子方程式:(1) ≥2时,2OH-+CO2 C +H2O;(2) = 时,3OH-+2CO2 C +HC +H2O;(3)a≤b时,CO2+OH- HC 。
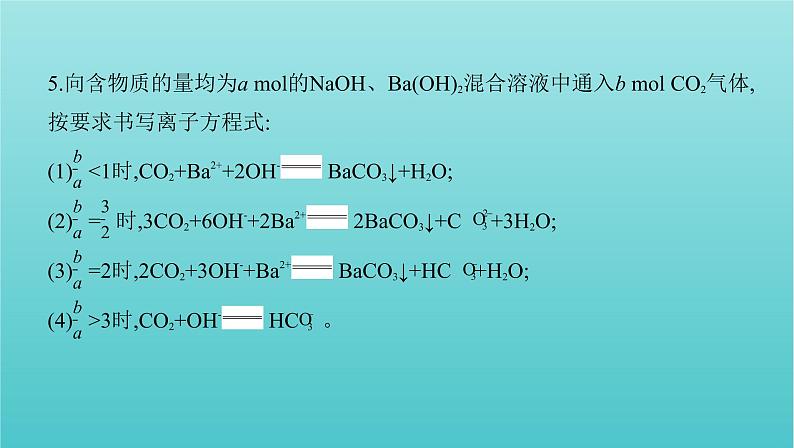
5.向含物质的量均为a ml的NaOH、Ba(OH)2混合溶液中通入b ml CO2气体,
按要求书写离子方程式:(1) 3时,CO2+OH- HC 。
6.向含有a ml NH4HSO4的溶液中加入b ml NaOH,按要求书写离子方程式:(1) ≥1时,H++OH- H2O;(2) = 时,4H++N +5OH- 4H2O+NH3·H2O;(3)1≤ ≤ 时,(b-a)N +aH++bOH- (b-a)NH3·H2O+aH2O。
题型五 信息型书写陌生的离子方程式时,要有效地理解、整合题目信息,推断并写出反应物
和生成物,然后再运用质量守恒定律、得失电子守恒规律(氧化还原反应)、
电荷守恒规律,遵循“先电子、再电荷、后原子”的顺序配平。
1.下列离子方程式的书写及评价均合理的是 ( )
2.向含1 ml NaHCO3的溶液中逐滴加入含b ml Ca(OH)2的溶液,充分反应。
下列说法不正确的是 ( )A.滴加Ca(OH)2溶液立即有沉淀生成B.当b=0.5时,发生反应:HC +OH-+Ca2+ CaCO3↓+H2OC.当b=1时,反应后的溶液中几乎不存在Ca2+D.当b=1.5时,向溶液中再通入少量CO2,还会有沉淀生成
解析 向含1 ml NaHCO3的溶液中滴加Ca(OH)2溶液,随Ca(OH)2物质的
量的增多,反应的化学方程式依次为①2NaHCO3+Ca(OH)2 CaCO3↓+2H2O+Na2CO3和②NaHCO3+Ca(OH)2 CaCO3↓+H2O+NaOH。滴加Ca(OH)2溶液立即有白色沉淀生成,故A正确;当n(NaHCO3)∶n[Ca(OH)2]=2∶1时,发生
反应①,故B不正确;当b=1时,发生反应②,所以溶液中几乎没有Ca2+,故C正确;
当b=1.5时,Ca(OH)2过量,则通入少量CO2会生成CaCO3沉淀,故D正确。
3.向含a ml Ba(OH)2的溶液中逐滴加入含b ml NaHCO3的溶液,充分反应(不
考虑盐类的水解及沉淀溶解)。下列说法不正确的是 ( )A.a=2b时,生成沉淀98.5a gB.a≤b≤2a时,溶液中含n(NaOH)∶n(Na2CO3)=(2a-b)∶(b-a)C.0I2,在水溶液中I2可被Cl2氧化为I 。向含a ml FeI2的溶液中通入b ml Cl2,充分反应(不考虑单质与水的反应)。下列说法不正确的
是 ( )A.当a=2b时,反应后的离子浓度之比:c(Fe2+)∶c(I-) ∶c(Cl-)=1∶1∶1B.当3a=2b时,发生离子反应:2Fe2++4I-+3Cl2 2Fe3++2I2+6Cl-C.当13a=2b时,发生离子反应:2Fe2++4I-+13Cl2+12H2O 4I +26Cl-+2Fe3++24H+D.若反应后溶液中I2与I 的物质的量之比为1∶1,则反应中转移电子3.5b ml
解析 A项,当a=2b时,有 的I-被氧化,而Fe2+还未被氧化,c(Fe2+)∶c(I-)∶c(Cl-)=1∶1∶1;B项,当3a=2b时,FeI2恰好被氧化为Fe3+、I2;C项,当13a=2b时,生
成的I2恰好全部被氧化成I ;D项,转移电子数目可由Cl2计算得到,即2b ml。
5.(2020浙江诸暨选考诊断性考试)室温时,HCl和H2SO4的混合溶液20 mL,向
混合物中逐滴加入0.05 ml/L Ba(OH)2溶液,生成的BaSO4和pH的变化如图所
示(不考虑溶液混合时体积的变化)。下列说法不正确的是 ( )
A.原混合液中HCl物质的量浓度为0.2 ml/LB.逐滴加入Ba(OH)2溶液,当体积为40 mL时发生反应的离子方程式:OH-+H+
H2OC.m=2.33D.现将上述20 mL混合溶液与60 mL Ba(OH)2溶液直接混合,发生反应的离子
方程式:Ba2++6OH-+S +6H+ BaSO4↓+6H2O
解析 当加入20 mL Ba(OH)2时沉淀质量达到最大值,此时硫酸根离子恰
好沉淀完全,由H2SO4~Ba(OH)2得n(H2SO4)=c[Ba(OH)2]·V[Ba(OH)2]=0.05 ml·L-1×0.02 L=10-3 ml;当加入60 mL Ba(OH)2时溶液的pH=7,溶液呈中性,由2HCl~
Ba(OH)2得n(HCl)=2c[Ba(OH)2]·V[Ba(OH)2]=2×0.05 ml·L-1×(0.06-0.02)L=4×10-3 ml。原混合液中HCl物质的量浓度为 =0.2 ml·L-1,故A正确;逐滴加入Ba(OH)2溶液,当体积为40 mL时,已沉淀完全,此时发生反应的离子方
程式:OH-+H+ H2O,故B正确;生成沉淀的最大的物质的量为10-3 ml,则生成沉淀的最大质量m g=0.233 g,故C错误;将题述20 mL混合溶液与60 mL Ba(OH)2溶液直接混合,发生反应的离子方程式:Ba2++6OH-+S +6H+ BaSO4↓+6H2O,故D正确。
相关课件
这是一份2024届高考化学一轮总复习第一章物质及其变化微专题一“用量改变型”和“信息给予型”离子方程式的书写课件,共19页。
这是一份2024年高考化学一轮复习第一章微专题一“用量改变型”和“信息给予型”离子方程式的书写课件,共19页。
这是一份2023高考化学总复习微专题大素养离子方程式书写中的“条件与信息”限制03课件,共13页。








