

所属成套资源:福建专用_新教材高中化学课件PPT+单元+学案练鲁科版必修1
- 福建专用2021_2022学年新教材高中化学第3章物质的性质与转化单元练习含解析鲁科版必修1 试卷 1 次下载
- 福建专用2021_2022学年新教材高中化学第3章物质的性质与转化第2节第2课时二氧化硫的性质课件鲁科版必修1 课件 1 次下载
- 福建专用2021_2022学年新教材高中化学第3章物质的性质与转化微项目论证重污染天气“汽车限行”的合理性__探讨社会性科学议题课件鲁科版必修1 课件 1 次下载
- 福建专用2021_2022学年新教材高中化学第3章物质的性质与转化实验活动:不同价态硫元素之间的转化课件鲁科版必修1 课件 1 次下载
- 福建专用2021_2022学年新教材高中化学第3章物质的性质与转化第3节第3课时硝酸的性质人类活动对氮循环和环境的影响课件鲁科版必修1 课件 1 次下载
高中化学鲁科版 (2019)必修 第一册第3节 氮的循环第3课时学案设计
展开
这是一份高中化学鲁科版 (2019)必修 第一册第3节 氮的循环第3课时学案设计,共11页。学案主要包含了硝酸的性质,人类活动对氮循环和环境的影响等内容,欢迎下载使用。
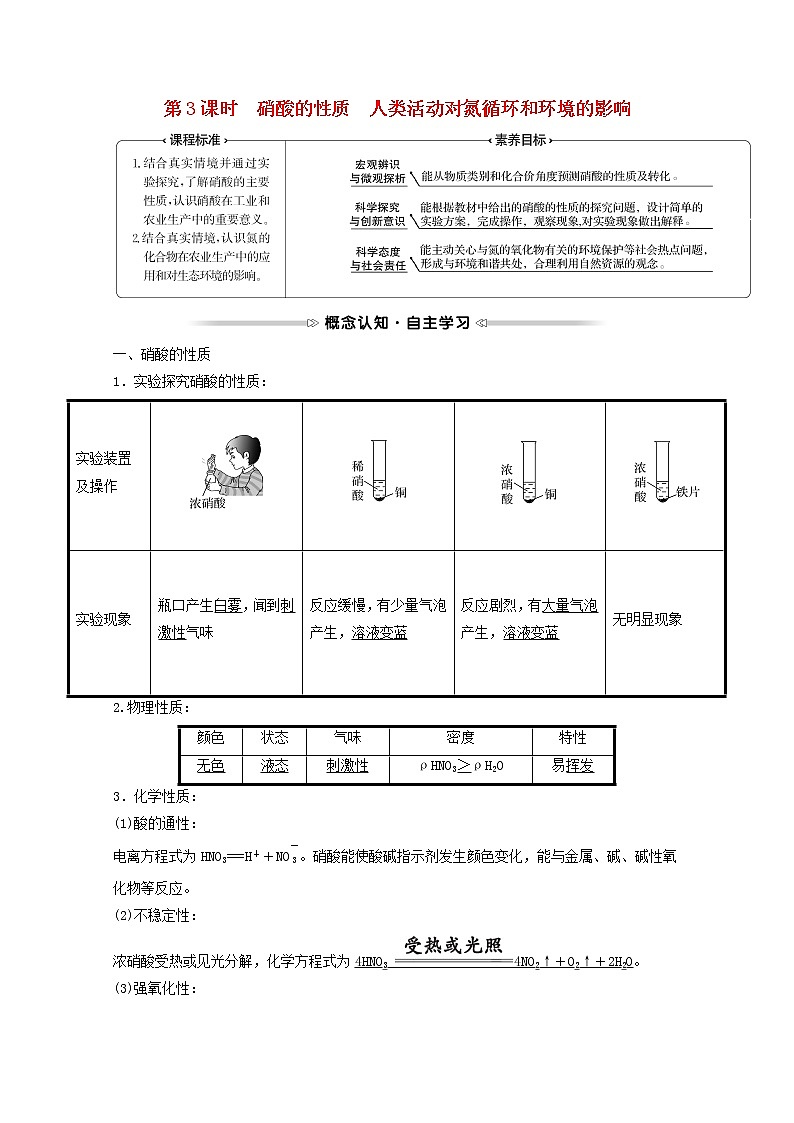
一、硝酸的性质
1.实验探究硝酸的性质:
2.物理性质:
3.化学性质:
(1)酸的通性:
电离方程式为HNO3===H++NO eq \\al(\s\up1(-),\s\d1(3)) 。硝酸能使酸碱指示剂发生颜色变化,能与金属、碱、碱性氧化物等反应。
(2)不稳定性:
浓硝酸受热或见光分解,化学方程式为4HNO3 4NO2↑+O2↑+2H2O。
(3)强氧化性:
4.用途:
硝酸是一种重要的化工原料,可用于制造炸药、染料等,也是实验室里重要的化学试剂。
二、人类活动对氮循环和环境的影响
1.判断下列说法是否正确:
(1)常温下铁与浓硝酸反应,产生大量红棕色气体。( )
提示:×。常温下铁在浓硝酸中钝化。
(2)碳与硝酸在常温下即可反应。( )
提示:×。碳与硝酸在加热时方可反应。
(3)氮氧化合物也可以形成酸雨。( )
提示:√。氮氧化合物和硫氧化合物都可以形成酸雨。
2.教材P115“常温下,浓硝酸可使铁、铝等金属表面形成致密的氧化膜而钝化,保护内部的金属不再与酸反应,所以可以用铁质或铝质容器盛放冷的浓硝酸。”那么在加热条件下浓硝酸与铁或者铝反应吗?
提示:反应。在加热条件下,浓硝酸与铁或者铝均反应,生成硝酸盐及二氧化氮气体。
3.光化学烟雾是汽车、工厂等污染源排入大气的碳氢化合物(HC)和氮氧化物(NOx)等一次污染物在阳光(紫外光)作用下发生光化学反应生成二次污染物所形成的烟雾污染现象,是氮氧化物与碳氢化合物在紫外线作用下生成的有害浅蓝色烟雾。
光化学烟雾有什么危害?
提示:人和动物受到的主要伤害是眼睛的黏膜受刺激,头疼、呼吸障碍、慢性呼吸道疾病恶化、儿童肺功能异常等。
硝酸的氧化性
浓硝酸是强氧化剂,遇有机物、木屑等能引起燃烧。含有痕量氧化物的浓硝酸几乎能与除铝和含铬特殊钢之外的所有金属发生反应,而铝和含铬特殊钢遇浓硝酸钝化,与乙醇、松节油、焦炭,有机碎渣的反应非常剧烈。
浓盐酸和浓硝酸按体积比3∶1混合可以制成具有强腐蚀性的王水。硝酸的酸酐是五氧化二氮(N2O5)。
硝酸的性质预测
(1)打开实验室中保存已久的浓HNO3,除闻到有刺激性酸味外,还发现溶液呈黄色,为什么?
提示:闻到刺激性酸味说明HNO3具有挥发性;保存已久的浓HNO3呈黄色的原因是HNO3能分解生成H2O、O2和NO2,NO2溶解在硝酸中使浓HNO3呈黄色。4HNO3 4NO2↑+O2↑+2H2O。
(2)依据HNO3中氮的化合价和浓硝酸分解的产物NO2、O2,预测一下硝酸的性质。
提示:HNO3中氮元素处于最高价态,其能分解生成强氧化性物质O2和NO2,因此HNO3具有强氧化性。
硝酸性质探究
通过以下实验分析硝酸的氧化性,并完成相关问题。
(1)金属活动性顺序表中排在氢元素前的金属与酸反应一定产生氢气吗?金属活动性顺序表中排在氢元素后的金属与酸不反应吗?
提示:均不一定。如Fe与HNO3反应不产生氢气,Cu与浓、稀硝酸均可以反应。
(2)Fe、Al在常温下不能溶于浓硝酸中,是因为Fe、Al不能与浓硝酸发生反应吗?
提示:不是。Fe、Al等金属跟浓硝酸在常温下发生钝化现象,因而不能溶解,但是钝化不代表不反应,而是在浓硝酸的作用下Fe、Al表面形成了一层致密的氧化膜,阻止了反应的进一步发生;但在加热条件下可以剧烈反应。
(3)Fe与稀硝酸反应时的产物与二者的用量有何关系?
提示:硝酸过量:Fe+4H++NO eq \\al(\s\up1(-),\s\d1(3)) ===Fe3++NO↑+2H2O;
铁过量:3Fe+8H++2NO eq \\al(\s\up1(-),\s\d1(3)) ===3Fe2++2NO↑+4H2O。
(4)金属与硝酸的反应中,硝酸起什么作用?分别是如何体现的?
提示:①强氧化性:HNO3中+5价的氮元素有很强的得电子能力。例如将Fe氧化为高价态的Fe3+。
②酸性:生成了盐类物质。例如Fe(NO3)3、Al(NO3)3。
1.硝酸与金属的反应:
(1)硝酸能与除Au、Pt、Ti外的绝大多数金属反应:
如:2HNO3(浓)+Ag===AgNO3+NO2↑+H2O;
4HNO3(稀)+3Ag===3AgNO3+NO↑+2H2O。
(2)浓硝酸与Fe、Al的反应:
(3)稀HNO3与Fe的反应:
①Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O。
②3Fe(过量)+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O。
2.硝酸与金属反应的有关计算:
(1)原子守恒:n(HNO3)=n(NO eq \\al(\s\up1(-),\s\d1(3)) )+n(还原产物中氮原子)。
(2)电子守恒:硝酸与金属反应属于氧化还原反应,氮原子得到的电子数等于金属原子失去的电子数。
(3)电荷守恒:Mn+和H+所带正电荷总数等于NO eq \\al(\s\up1(-),\s\d1(3)) 所带负电荷总数。
【典例】(2021·济南高一检测)浓硝酸正常情况下为无色透明液体。有窒息性刺激气味。浓硝酸含量为68%左右,对于稀硝酸, 一般我们认为浓稀之间的界线是6 ml·L-1,市售普通试剂级硝酸浓度约为68%左右。在盛有一定量浓硝酸的试管中加入6.4 g铜片,发生反应。请回答下列问题:
(1)开始阶段,观察到的现象为________,反应的化学方程式是______。
(2)反应结束后,铜片有剩余,再加入少量20%的稀硫酸,这时铜片上又有气泡产生,反应的离子方程式是__________________________。
(3)若6.4 g铜片消耗完时,共产生气体2.8 L(标准状况)。则整个反应过程中所消耗的HNO3的物质的量为________。
【解析】(1)因为浓硝酸的氧化性很强,可以将铜氧化,同时它本身被还原为红棕色的NO2气体,所以现象是铜片逐渐溶解,溶液由无色变为蓝色,产生红棕色的气体。
(2)反应后的溶液中有NO eq \\al(\s\up1(-),\s\d1(3)) ,加入稀硫酸后,NO eq \\al(\s\up1(-),\s\d1(3)) 会继续氧化铜单质。
(3)起酸性作用的HNO3的物质的量n(HNO3)=2n(Cu)=0.2 ml;被还原的HNO3的物质的量n(HNO3)= eq \f(2.8 L,22.4 L·ml-1) =0.125 ml。故整个反应过程中所消耗的HNO3的物质的量为0.2 ml+0.125 ml=0.325 ml。
答案:(1)铜片逐渐溶解,溶液由无色变为蓝色,产生红棕色的气体
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
(2)3Cu+8H++2NO eq \\al(\s\up1(-),\s\d1(3)) ===3Cu2++2NO↑+4H2O
(3)0.325 ml
(1)如何除去浓硝酸中的“黄色”? (关键能力——理解与辨析)
提示:在浓硝酸中通入足量的氧气,发生反应4NO2+O2+2H2O===4HNO3,使NO2转化为硝酸,即可除去浓硝酸中的“黄色”。
(2)足量的铜与浓硝酸反应,浓硝酸能否完全被还原?其还原产物可能是什么?(关键能力——创新与探究)
提示:浓硝酸不可能完全被还原,因生成的硝酸铜溶液中仍有NO eq \\al(\s\up1(-),\s\d1(3)) ;在反应过程中,硝酸的浓度逐渐减小,还原产物可能是NO2和NO的混合物。
(3)将铁粉溶于稀硝酸,铁元素的存在形式可能为①________、②________、③________。(关键能力——归纳与整理)
提示:反应关系:
① eq \f(n(HNO3),n(Fe)) ≥4,Fe(NO3)3;
② eq \f(n(HNO3),n(Fe)) ≤ eq \f(8,3) ,Fe(NO3)2;
③ eq \f(8,3) < eq \f(n(HNO3),n(Fe))
相关学案
这是一份鲁科版 (2019)必修 第一册第3章 物质的性质与转化第3节 氮的循环第3课时学案及答案,共16页。
这是一份化学必修 第一册第3节 氮的循环学案及答案,共11页。学案主要包含了硝酸的性质,人类活动对氮循环和环境的影响等内容,欢迎下载使用。
这是一份化学必修 第一册第3章 物质的性质与转化第3节 氮的循环第3课时学案,共11页。









