






高中化学鲁科版必修1第3章 自然界中的元素第1节 碳的多样性教案配套课件ppt
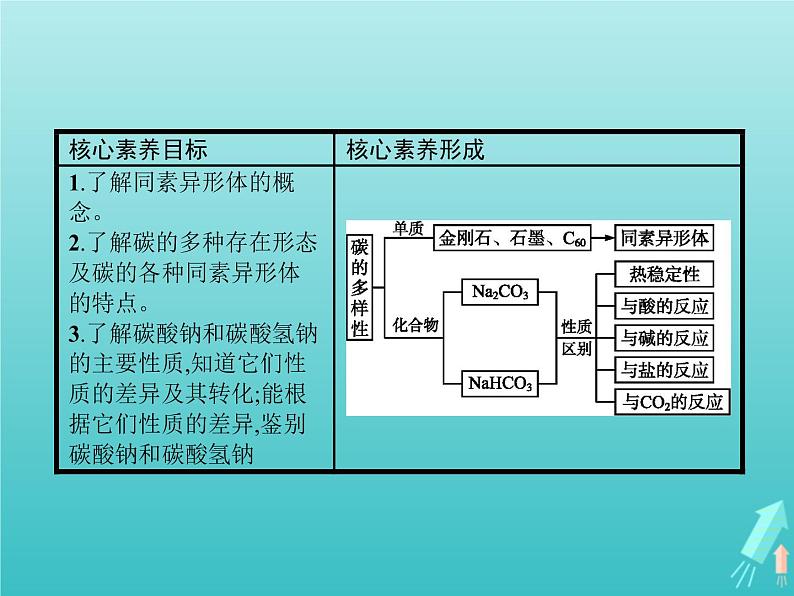
展开一、多种多样的碳单质1.同素异形体由同一种元素组成的性质不同的几种单质。常见的同素异形体,碳元素:金刚石、石墨、C60;氧元素:氧气、臭氧等。
3.碳的化学性质碳在参与化学反应时,一般表现为还原性。(1)与O2反应:
2.碳酸钠和碳酸氢钠
1.小苏打是常用的食品添加剂,其化学式是( )A.Na2CO3D.NaCl解析:Na2CO3的俗名是纯碱或苏打,小苏打是碳酸氢钠的俗名,其化学式为NaHCO3。答案:B
2.下列说法中正确的是( )A.金刚石、石墨和C60性质不同的根本原因是所含碳原子的数目不同B.金刚石、石墨和C60在氧气中完全燃烧都生成二氧化碳C.C60和P4互为同素异形体D.H2O和H2O2互为同素异形体解析:金刚石、石墨和C60性质不同的根本原因是结构不同,与所含碳原子数目的多少无关。答案:B
3.下列有关Na2CO3和NaHCO3的说法中不正确的是( )A.Na2CO3比NaHCO3易溶于水B.Na2CO3比NaHCO3稳定C.石灰水能与Na2CO3反应,而不能与NaHCO3反应D.与足量盐酸反应要得到相同质量的CO2,用Na2CO3比NaHCO3的质量要多
解析:石灰水也能与NaHCO3反应,使酸式盐变成正盐,Ca(OH)2+2NaHCO3 CaCO3↓+Na2CO3+2H2O。制取相同质量的CO2,如都制取44 g CO2,在盐酸足量的情况下,需NaHCO3 84 g,需Na2CO3 106 g。
4.碳酸钠和碳酸氢钠在日常生活中都有着广泛的应用,现知碳酸钠水溶液的碱性远远强于碳酸氢钠水溶液的碱性。试从反应物的性质或者用量角度说明在下列用途中应选用碳酸钠还是碳酸氢钠,并说明原因。(1)做面条时,为防止面粉长时间放置出现酸味,常加入适量的碱面,选用 ,因为 。 (2)做面包时,为了使面包更加松软可口,常常加入一种发泡剂,应选用 ,因为 。 (3)已知泡沫灭火剂中使用的是盐酸和供气剂,这种供气剂是 ,因为 。
答案:(1)碳酸钠 与等量的H+反应,碳酸钠比碳酸氢钠的用量少(2)碳酸氢钠 碳酸氢钠受热易分解,产生CO2气体(3)碳酸氢钠 若要产生一样多的CO2,碳酸氢钠消耗盐酸较少,且反应较快
Na2CO3和NaHCO3与酸反应的区别
(1)如上图所示,同时向盛有足量等浓度的盐酸的试管中加入等物质的量的Na2CO3和NaHCO3固体粉末,开始哪个装置中气球先变大了?(2)如上图所示,如果向足量盐酸中加入相等质量的NaHCO3和Na2CO3,最后哪个装置中的气球体积大?为什么?
(2)甲装置气球体积大。盐酸均过量,NaHCO3和Na2CO3均完全反应产生CO2;由于Na2CO3和NaHCO3等质量且NaHCO3的相对分子质量小,因此n(NaHCO3)>n(Na2CO3),V甲(CO2)>V乙(CO2)。
Na2CO3、NaHCO3与盐酸反应的过程1.Na2CO3溶液与盐酸Na2CO3溶液与盐酸反应时,滴加顺序不同,实验现象不同,产生的CO2的量也可能不同。
2.NaHCO3溶液与盐酸无论将NaHCO3溶液滴入盐酸中,还是将盐酸滴入NaHCO3溶液中,都只发生反应:NaHCO3+HCl NaCl+CO2↑+H2O,即一滴加就有CO2气体放出。
【例题1】 有关NaHCO3和Na2CO3的性质,以下叙述错误的是( )A.等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积小B.等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍C.等质量的NaHCO3和Na2CO3与盐酸完全反应,前者消耗盐酸较多D.等物质的量的NaHCO3和Na2CO3与足量盐酸反应产生的CO2一样多
解析:根据反应的化学方程式Na2CO3+2HCl==2NaCl+CO2↑ +H2O,NaHCO3+HCl==NaCl+CO2↑+H2O可知,106 g碳酸钠完全反应生成1 ml二氧化碳,84 g碳酸氢钠完全反应生成1 ml二氧化碳,故A正确;同样由化学方程式可知,等物质的量的两种盐与同浓度的盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍,故B正确;等质量的NaHCO3和Na2CO3与盐酸完全反应,Na2CO3消耗盐酸较多,故C错误;等物质的量的两种盐与同浓度盐酸完全反应,生成的二氧化碳一样多,故D正确。答案:C
跟踪训练1有相同质量的两份NaHCO3粉末,第一份加入足量的盐酸,第二份先加热使其完全分解,冷却后,再加入足量的相同质量分数的盐酸,两者所消耗的盐酸中氯化氢的质量之比是( )A.2∶1B.1∶1C.1∶2D.4∶1
由以上分析可知,两份物质的量相等的NaHCO3消耗HCl的物质的量相等,即等质量的两份NaHCO3消耗HCl的质量相等。本题也可从另外一个角度来分析:NaHCO3受热时,钠元素完全转化到Na2CO3中,NaHCO3和Na2CO3分别与HCl反应时,都得到NaCl,由于钠元素的质量相等,则生成的NaCl的质量相同,消耗HCl的量也相同。故正确答案为B。答案:B
Na2CO3和NaHCO3的鉴别与转化
能否用Ba(OH)2[或Ca(OH)2]溶液来鉴别Na2CO3与NaHCO3?
探究提示不能,因为碳酸钠和碳酸氢钠溶液均能与它们反应产生白色沉淀。
1.碳酸钠和碳酸氢钠的鉴别方法(1)利用热稳定性不同进行鉴别。分别加热少量固体,若发生分解反应,将产生的气体通入澄清石灰水中,石灰水变浑浊的原试剂是NaHCO3,不能发生分解反应的为Na2CO3。(2)利用与酸反应生成气体的速率不同进行鉴别。分别取一定量的固体,加入等浓度等体积的盐酸,反应快、产生气体多的为NaHCO3,另一种为Na2CO3。(3)利用阴离子性质不同进行鉴别。分别取其稀溶液,滴加氯化钡稀溶液或CaCl2溶液,能使其产生沉淀的原试剂为Na2CO3,另一种为NaHCO3(特别注意:该方法必须取稀溶液)。
【例题2】 可以用来判定碳酸氢钠粉末中是否混有碳酸钠的实验方法是( )A.加热时有无气体放出B.滴加盐酸时有无气泡放出C.溶于水后,滴加氯化镁稀溶液有无白色沉淀生成D.溶于水后,滴加澄清石灰水,有无白色沉淀生成
解析:加热时,碳酸氢钠易分解:2NaHCO3 Na2CO3+CO2↑+H2O,碳酸钠不分解,A项错误。碳酸钠、碳酸氢钠都能与盐酸反应,且都有CO2生成,B项错误。碳酸钠与氯化镁反应时,生成白色沉淀,碳酸氢钠与氯化镁不反应,反应现象不同,C项正确。碳酸钠、碳酸氢钠都能与澄清石灰水反应,生成白色沉淀,反应现象相同,D项错误。
规律方法点拨Na2CO3和NaHCO3热稳定性不同,加热条件下NaHCO3易分解。
跟踪训练2下列关于Na2CO3、NaHCO3说法正确的是( )A.受热时Na2CO3较NaHCO3更不稳定,更易分解产生CO2B.等质量的Na2CO3、NaHCO3与足量盐酸反应,前者产生的CO2更多C.常温下相同物质的量浓度的Na2CO3、NaHCO3溶液与盐酸反应,前者消耗的盐酸多D.向Na2CO3、NaHCO3溶液中分别滴加澄清石灰水,两者都产生白色沉淀
解析:受热时NaHCO3不稳定,易分解产生CO2,故A错误;等质量的Na2CO3、NaHCO3与足量的盐酸反应,后者产生的CO2更多,故B错误;常温下相同物质的量浓度的Na2CO3、NaHCO3溶液与盐酸反应,由于溶液体积未知,因此无法判断消耗盐酸量的多少,故C错误;向Na2CO3、NaHCO3溶液中分别滴加澄清石灰水,分别发生反应: Na2CO3+Ca(OH)2==CaCO3↓+2NaOH;2NaHCO3+Ca(OH)2==CaCO3↓+Na2CO3+2H2O,故D正确。答案:D
1.下列物质互为同素异形体的是( ) A.CaCO3和MgCO3B.CO2和COC.O2和O3D.Na和Na+解析:由同种元素组成的性质不同的单质是同素异形体。答案:C
2.金刚石、石墨、C60性质有所不同,是由于( )A.构成原子不同B.原子的排列方式不同C.具有不同的几何外形D.硬度不同解析:金刚石、石墨、C60三者是碳元素的单质,构成原子完全相同,只是其内部碳原子的排列方式不同,才导致它们的结构不同,所以性质存在差异。答案:B
4.下列实验能成功的是( )①用水鉴别Na2CO3和NaHCO3固体 ②用观察法区别Na2O和Na2O2 ③用MgCl2溶液鉴别Na2CO3溶液和NaOH溶液 ④用稀盐酸鉴别Na2CO3溶液和NaHCO3溶液A.①③④B.①②C.②③D.①②④
5.如图,在两支相同的试管中,盛有浓度和体积均相同的盐酸,试管口系两个相同的气球,内盛有质量相同的碳酸钠、碳酸氢钠。同时将气球中的固体倒入盐酸中,产生的现象是 。由此得出的实验结论为 。
鲁科版 (2019)必修 第一册第3章 物质的性质与转化第1节 铁的多样性教学演示课件ppt: 这是一份鲁科版 (2019)必修 第一册第3章 物质的性质与转化第1节 铁的多样性教学演示课件ppt,共60页。PPT课件主要包含了分点突破1,亚铁盐和铁盐,分点突破2,铁的单质,分点突破3,分点突破4,氢氧化亚铁的制备等内容,欢迎下载使用。
高中化学鲁科版必修1第4节 海水中的化学元素评课课件ppt: 这是一份高中化学鲁科版必修1第4节 海水中的化学元素评课课件ppt,共33页。PPT课件主要包含了自主阅读,自主检测,2化学性质,问题探究,知识点拨,典例引领,探究一,探究二,海水提镁,海水提镁的方法等内容,欢迎下载使用。
化学必修1第3节 硫的转化图片课件ppt: 这是一份化学必修1第3节 硫的转化图片课件ppt,共35页。PPT课件主要包含了自主阅读,自主检测,问题探究,知识点拨,典例引领,探究一,探究二,答案B等内容,欢迎下载使用。













