





高中化学鲁科版必修1第4节 海水中的化学元素评课课件ppt
展开一、海水——化学元素宝库1.常量元素每升海水中的含量均大于1 mg的元素,有氯、钠、镁、硫、钙、钾、碳、锶、溴、硼、氟共11种。 其含量占海水所溶解物质总量的99.9%。人类已发现和合成的110多种元素中,有80多种能在海水中找到。海水中的元素90%是由江河输入海洋的,10%是由冰和大气尘埃输入海洋的。
2.微量元素及其作用每升海水中的含量低于1 mg的元素称为海水中的微量元素。如锂可用于热核反应的重要材料;铀可作为核燃料;碘用于制药,如碘酒,人缺碘易患甲状腺肿,我国规定食盐中加入碘酸钾。 3.海水元素对人体的重要性(1)食盐(NaCl)是人体的必需物质,并对人体的血液循环和新陈代谢都有着重要作用。(2)人体缺碘会使人感到头晕、倦怠、全身无力,学习和工作效率降低,长期缺碘会导致大脖子病,甚至会导致心脏病。
二、海水中提镁和氯碱工业1.海水提镁
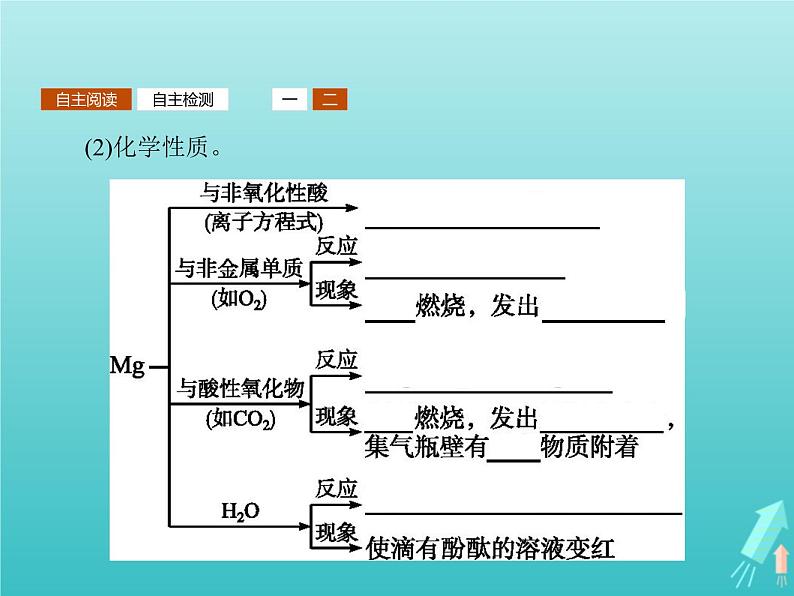
2.镁(1)物理性质。
(3)用途。镁是一种轻金属,它的密度只有铝的密度的 ;另外,镁合金的强度高、机械性能好。这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉。3.氯碱工业食盐不仅是调味品,而且是人体必需品。食盐被称为“化工之母”,大部分食盐被用于化工生产。这样,就形成了一个重要的化学工业分支——氯碱工业。下图为氯碱工业的有关化工产品示意图。
1.下列叙述不正确的是( )A.海水中含有碘、镁、铀等微量元素B.在每升海水中含量低于1 mg的元素称为海水中的微量元素C.海水是锂元素的一个重要来源D.世界上生产的镁大部分来自海水解析:A项海水中的镁属于常量元素;B项中海水中微量元素是每升海水中含量低于1 mg;C项碘、锂元素的重要来源是海洋;D项中世界上60%的镁来自海水。答案:A
2.铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装饰材料,主要用于制作窗框、卷帘门、防护栏等,下列与这些用途无关的性质是( )A.不易生锈B.导电性好C.密度小D.强度高解析:建筑装饰材料属于长期使用的材料,要求其不易生锈、密度小、强度高,没有必要要求导电性好,所以B项错误。答案:B
3.海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法,正确的是( )A.海水中含有钾元素,只需经过物理变化就可以得到钾单质B.海水蒸发制海盐的过程只发生了化学变化C.海水中含有大量NaCl,电解饱和NaCl溶液可制备Cl2和NaOHD.利用潮汐发电是将化学能转化为电能解析:海水中的钾元素是以化合态形式存在的,由化合态转化为游离态一定发生氧化还原反应,A项错误;海水蒸发制海盐发生了物理变化,B项错误;电解饱和NaCl溶液可制备H2、Cl2和NaOH,C项正确;潮汐发电是将动能转化为电能,D项错误。答案:C
(1)海水提镁中涉及的基本反应类型有哪些?没有涉及的基本反应类型有哪些?(2)结合海水提镁的工业流程,讨论在从海水中提取镁的过程中,采用哪些措施来提高经济效益?
探究提示(1)海水提镁涉及分解反应、化合反应、复分解反应,没有涉及置换反应。(2)①就地取材——利用海滩上的贝壳生产氧化钙;②提高原料利用率——循环利用氯元素,电解MgCl2可得Cl2,Cl2用于制取盐酸,盐酸再与Mg(OH)2反应进入循环。当然,一个真实的化学工业流程所考虑的问题远比我们想象的复杂。它不仅考虑化学反应,还要考虑经济效益、环境保护等问题。
【例题1】 下列有关海水提镁的说法中不正确的是( )A.贝壳在海水提镁的生产流程中,主要经历了CaCO3→CaO→Ca(OH)2的过程B.从海水中经过过滤网后的Mg2+,利用OH-将其转化为Mg(OH)2沉淀,然后电解Mg(OH)2制备纯镁C.工业生产中是利用电解MgCl2制备镁D.在海水提镁的工业流程中,氯气可以循环利用,用于制备盐酸,再溶解Mg(OH)2
解析:从海水中提取金属镁,是利用贝壳,将贝壳转化为Ca(OH)2,然后转化为Mg(OH)2,将Mg(OH)2转化为MgCl2,并电解熔融的MgCl2,从而制得金属镁,所以A、C选项都是正确的,而B选项错误;在电解氯化镁时,不仅得到了金属镁,同时也得到了氯气,这些氯气可以循环使用,所以D也是正确的。答案:B
规律方法点拨MgO熔点很高,加热熔化时能耗大,故制镁时电解熔融MgCl2,而不电解MgO。电解熔融MgCl2的化学方程式为MgCl2(熔融) Mg+Cl2↑。
跟踪训练1从化学原理和经济利益角度分析下列从海水中提取镁单质的方法最可行的是( )
解析:Mg(OH)2难熔不易电解,且A项中使用NaOH做沉淀剂不经济,故A、C项不可行;B项中蒸发所得主要为NaCl而不是MgCl2,只有D项是经济可行的提取镁单质的方法。答案:D
点燃镁条前,为什么用砂纸擦亮?探究提示由于镁性质较活泼,在空气中久置易在镁条表面形成氧化膜(MgO),因而在用镁条进行有关实验前,先将表面的MgO擦干净。
镁及其化合物的相互转化
【例题2】已知镁在空气里点燃可以燃烧,放出大量的热并发出耀眼的白光,生成白色的氧化镁,同时,镁在这样的高温条件下,还可与空气中的另一种主要成分反应,生成少量的物质A,气体C能够使湿润的红色石蕊试纸变蓝。已知A有下列一系列变化:
(1)写出A、C、D的化学式:A 、C 、D 。 (2)写出下列变化的化学方程式:① , ② 。
解析:Mg3N2与水或酸的反应:本质上是阴阳离子相互结合生成电中性的物质。(1)与水反应:Mg3N2+6H2O 3Mg(OH)2↓+2NH3↑(2)与盐酸反应:Mg3N2+8HCl 3MgCl2+2NH4Cl镁在空气中燃烧时,主要与氧气反应生成MgO,还可以与氮气反应生成Mg3N2,所以A为Mg3N2。Mg3N2与盐酸反应得到的溶液B中一定含有Mg2+和Cl-,所以沉淀D是Mg(OH)2,能够使湿润的红色石蕊试纸变蓝的气体是氨气, 能够与NaOH溶液反应放出NH3,所以溶液B中还含有 ,即它为MgCl2和NH4Cl的混合物。
答案:(1)Mg3N2 NH3 Mg(OH)2(2)①Mg3N2+8HCl 3MgCl2+2NH4Cl②MgCl2+2NaOH Mg(OH)2↓+2NaCl,NH4Cl+NaOH NaCl+H2O+NH3↑
规律方法点拨镁是活泼的金属元素,能与多种非金属单质和化合物发生反应,反应时镁失电子变成+2价,镁元素无变价。
跟踪训练2下列关于镁的叙述正确的是( )A.镁条失火可以用CO2进行扑灭B.镁不能与水反应放出H2C.镁制容器可以盛放浓硝酸D.镁在空气中燃烧产物并不全是MgO解析:镁在高温下能和CO2、H2O发生反应,镁和H2O反应会生成H2,A、B项错误;镁还能与浓硝酸发生反应,C项错误;镁在空气中燃烧除了生成MgO,还会生成Mg3N2等,D项正确。答案:D
解析:海水中H、O元素含量高,但不属于常量元素,常量元素指的是Cl、Na、Mg、S、K、Ca、Sr、Br、B、F、C这11种元素,而Li、I属于海水中的微量元素。答案:B
2.许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是( )A.氯、钾B.钠、镁、铝C.NaCl、氢气D.食盐、淡水解析:海水中元素是以化合态的形式存在的,而A项、B项、C项中均有单质,需要通过化学变化获得,所以错误;D项的食盐和淡水可以通过加热蒸馏等物理方法获得,所以正确。答案:D
解析:海水中含有Mg2+,加入HCl或通入Cl2,都不能使MgCl2分离出来,C、D项被排除;加入碱可生成Mg(OH)2沉淀:Mg2++2OH- Mg(OH)2↓,因为Ca(OH)2比NaOH廉价得多,考虑经济效益,应选B。
4.下列关于镁的叙述不正确的是( )A.在空气中燃烧时发出耀眼的白光B.由于镁与空气中的氧气反应,故要密封保存C.能与盐酸反应放出氢气D.能与沸水反应放出氢气解析:镁在空气中可与氧气反应生成致密的氧化膜,无需密封保存。答案:B
5.镁是一种活动性较强的金属,它不仅能在氧气、氮气中燃烧,还可以在二氧化碳中燃烧。请回答下列问题:(1)写出镁在氮气中燃烧的化学方程式,并注明其氧化剂。化学方程式: ,氧化剂: 。 (2)与二氧化碳的反应类似,镁也能在二氧化硫中燃烧,假设反应在集气瓶中进行,请预测其反应现象: ,并写出该反应的化学方程式: 。
鲁科版高考化学一轮复习第3单元自然界中的元素第4节海水中的元素课件: 这是一份鲁科版高考化学一轮复习第3单元自然界中的元素第4节海水中的元素课件
高中化学鲁科版必修1第4节 海水中的化学元素备课课件ppt: 这是一份高中化学鲁科版必修1第4节 海水中的化学元素备课课件ppt,共33页。PPT课件主要包含了自主阅读,自主检测,3碘的特性,问题探究,知识点拨,典例引领,探究一,探究二,例题1,答案A等内容,欢迎下载使用。
化学必修1第3节 硫的转化图片课件ppt: 这是一份化学必修1第3节 硫的转化图片课件ppt,共35页。PPT课件主要包含了自主阅读,自主检测,问题探究,知识点拨,典例引领,探究一,探究二,答案B等内容,欢迎下载使用。













