
第八单元 海水中的化学 A卷 基础夯实——2021-2022学年鲁教版九年级下册化学单元测试AB卷
展开第八单元 海水中的化学 A卷
一、选择题
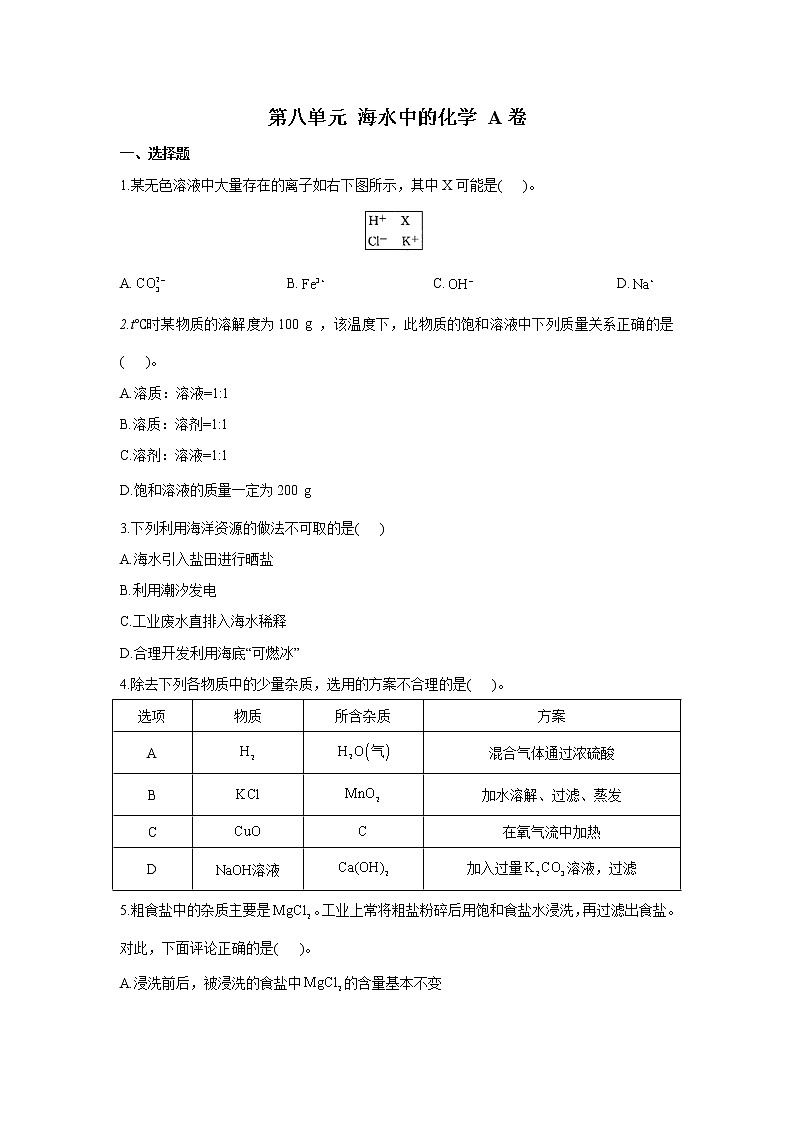
1.某无色溶液中大量存在的离子如右下图所示,其中X可能是( )。
A. B. C. D.
2.t℃时某物质的溶解度为100,该温度下,此物质的饱和溶液中下列质量关系正确的是( )。
A.溶质:溶液=1:1
B.溶质:溶剂=1:1
C.溶剂:溶液=1:1
D.饱和溶液的质量一定为200
3.下列利用海洋资源的做法不可取的是( )
A.海水引入盐田进行晒盐
B.利用潮汐发电
C.工业废水直排入海水稀释
D.合理开发利用海底“可燃冰”
4.除去下列各物质中的少量杂质,选用的方案不合理的是( )。
选项 | 物质 | 所含杂质 | 方案 |
A | 混合气体通过浓硫酸 | ||
B | 加水溶解、过滤、蒸发 | ||
C | 在氧气流中加热 | ||
D | 加入过量溶液,过滤 |
5.粗食盐中的杂质主要是。工业上常将粗盐粉碎后用饱和食盐水浸洗,再过滤出食盐。对此,下面评论正确的是( )。
A.浸洗前后,被浸洗的食盐中的含量基本不变
B.浸洗前后,食盐水中的浓度基本不变
C.浸洗用的饱和食盐水可以无限次地使用下去
D.粉碎颗粒的大小影响浸洗后食盐中的含量
6.“可燃冰”是一种沉睡在海底和高寒冻土的独特能源。下列有关说法正确的是( )
A.“可燃冰”给我们提供了水可以变油的证据
B.属于氧化物
C.“可燃冰”是燃烧值低,没有污染的新能源
D.“可燃冰”燃烧后,几乎不产生残渣或废气
7.下列对“20℃时的溶解度为31.6g”的解释正确的是( )
A.20℃时,31.6g溶解在水中
B.20℃时,100g溶液中含有31.6g
C.31.6g溶解在100g水中达到饱和状态
D.20℃时,31.6g溶解在100g水中达到饱和状态
8.粗盐中难溶性杂质的去除过程中,涉及称量、溶解、过滤、蒸发等过程。下列说法不正确的是( )
A.称量时粗盐放在天平左盘的称量纸上
B.粗盐溶解时,要用玻璃棒不断搅拌
C.蒸发时,在恰好蒸干时停止加热
D.过滤时漏斗下端尖嘴处紧靠烧杯内壁
9.夏季,鱼虾养殖池内常设置一些水泵,把水喷向空中,从化学角度分析,喷水的目的是( )
A.降低养殖池内水的温度
B.增大与空气的接触面积,便于氧气溶解
C.增加观赏性
D.便于太阳照射,杀灭水中的病菌
10.下列说法正确的是( )
A.检验食盐中是否含有碳酸钠,可通过加稀盐酸的方法检验
B.取少量溶液于试管中,滴加氯化钡溶液,有白色沉淀生成,再滴加稀硝酸,沉淀不溶解,证明该溶液中一定含有硫酸根离子
C.向某固体中滴加稀盐酸,有气泡产生,则该固体中肯定含有碳酸根离子
D.氢氧化铜能使无色酚酞溶液变红
11.实验室有两瓶失去标签的无色溶液,一瓶是氢氧化钠溶液,另一瓶是碳酸钠溶液,下列试剂不能将它们鉴别开来的是( )
A.无色酚酞试液
B.稀盐酸
C.澄清石灰水
D.氯化钡溶液
12.“”是著名的“侯氏制碱法”的重要反应。下列有关叙述正确的是( )。
A.是纯碱
B.析出晶体后剩余溶液中溶质只有
C.配制饱和食盐水时,可通过搅拌来提高食盐的溶解度
D.向饱和食盐水中先通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收
13.下列实验中,根据有关现象得出的结论合理的是( )。
| 实验操作 | 现象 | 结论 |
A | 向盛有少量无色溶液的试管中滴加酚酞试液 | 溶液变红 | 该溶液一定呈碱性 |
B | 向盛有少量无色溶液的试管中滴加氯化钡溶液 | 出现白色沉淀 | 该溶液中定含有硫酸根离子 |
C | 向盛有少量固休的试管中滴加稀盐酸 | 产生气泡 | 该固体一定含有碳酸盐 |
D | 点燃某气体,在火焰上方罩一个干冷的烧杯 | 烧杯内壁出现水珠 | 该气体一定是氢气 |
A.A B.B C.C D.D
14.如下图所示,其中甲、乙、丙、丁、戊分别是氧化铜、稀盐酸、氢氧化钙溶液、碳酸钠溶液、二氧化碳中的一种。图中相连的两圆表示相应物质能发生反应,已知甲和丁反应有气泡出现。则下列说法正确的是( )。
A.甲与丙反应属于中和反应
B.乙和戊都是氧化物
C.丙与丁反应会生成白色沉淀
D.丁和戊反应属于化合反应
15.25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是( )。
编号 | ① | ② | ③ | ④ |
水的质量/ | 50 | 50 | 50 | 50 |
加入固体质量/ | 5 | 10 | 15 | 20 |
现象 | 固体完全溶解 | 固体完全溶解 | 剩余少量固体 | 剩余较多固体 |
A.实验①所得溶液质量分数为10%
B.实验说明25℃时该物质的溶解度是20
C.实验③④所得溶液质量分数相同
D.实验④所得溶液中含溶质20
二、填空题
16.现有①熟石灰、②小苏打、③食盐、④纯碱、⑤生石灰几种物质,请选择合适的物质,将其成分的化学式填在横线上:
(1)可用作食品干燥剂的是_____________;
(2)常用作厨房调味品的是_____________;
(3)可改良酸性土壤的是_____________;
(4)常用作焙制糕点发酵粉的主要成分的是_____________;
(5)常作洗涤剂的盐_____________;
17.甲、乙、丙三种物质的溶解度曲线如图所示。
(1)℃时甲、乙、丙三种物质的溶解度由大到小的顺序为____________;
(2)℃时乙物质的溶解度为____________;
(3)将℃时180甲的饱和溶液降温到℃,析出晶体的质量为____________,所得的甲溶液的溶质质量分数为____________;
(4)取等质量的甲、乙、丙三种物质,分别配成℃时的恰好饱和溶液,所得三种溶液的质量由大到小的顺序为____________。
18.化学是认识、改造和应用物质的科学。从海水中提取镁、制“碱”,都体现了人类改造物质的智慧。结合下列流程图(其中部分操作和条件已略去),请回答相关问题:
(1)提纯物质常用转化的方法,就是将杂质转化为沉淀或气体而除去。粗盐中含有氯化镁、硫酸钠氯化钙等可溶性杂质,通过步骤Ⅰ,再利用过滤操作进行除杂。步骤Ⅰ加入下列三种溶液的先后顺序为_________(填字母序号)。
a.稍过量的溶液
b.稍过量的溶液
c.稍过量的NaOH溶液
(2)母液中有,却经历了步骤Ⅳ、Ⅴ的转化过程,其目的是_________。
(3)步骤Ⅱ中先向饱和食盐水中通入氨气,有利于二氧化碳的吸收,这样做的目的是_________,写出该反应的化学方程式:_________。
(4)化学变化是改造物质的重要途径。上述流程图中没有涉及的基本反应类型是______________________。
三、实验探究题
19.化学实验课上同学们用碳酸钠溶液、稀硫酸、氢氧化钠溶液和氯化钡溶液进行实验探究。实验结束后学校环保监测小组取废液缸中废液进行如下探究,请你和他们一起完成探究报告。
【提出问题】该废液缸中废液含有什么物质呢?
【探究报告】
实验步骤、操作 | 实验现象 | 实验分析 |
取少量废液于试管中,向其中加入足量的氯化钡溶液;过滤,得白色沉淀和滤液①,向沉淀中加入足量稀硝酸 | 部分白色沉淀消失,产生无色气泡 | 根据实验现象可知,废液中含有_____________ |
取滤液①于试管中,滴加___________ | ___________ | 根据实验现象可知,废液中含有氢氧化钠 |
【实验结论】同学们通过分析推理,得出结论:废液中含有的溶质有____________(填溶质的化学式,有几种填几种)。
【实验反思】向废液中加入足量的氯化钡溶液的目的是____________。
【实验处理】应将废水____________处理,检测达标后再排放。
四、计算题
20.实验室用碳酸钠溶液与氯化钙溶液反应制取髙纯度碳酸钙粉末,烧杯中现有100碳酸钠溶液,将150氯化钙溶液分四次加入,充分反应,四次测量所得数据如下表所示:
次数 | 累计加入氯化钙溶液的质量/ | 烧杯中溶液的总质量/ |
一 | 40 | 134 |
二 | 80 | 168 |
三 | 120 | 202 |
四 | 150 | 232 |
(1)恰好完全反应时,生成沉淀的总质量为__________。
(2)第四次测量时,所得溶液中的溶质有__________(填化学式)。
(3)计算氯化钙溶液的溶质质量分数(写出计算过程)。
答案以及解析
1.答案:D
解析:不能与共存;溶液呈黄色,故选D。
2.答案:B
解析:该饱和溶液中溶质:溶剂:溶液=1:1:2,饱和溶液的质量不固定。
3.答案:C
解析:工业废水常常含有有毒、有害物质,直接排入海水会引起海水的污染,故C项做法不可取。
4.答案:D
解析:氢气中含有水蒸气,通过浓硫酸,浓硫酸具有吸水性,可以除去,A合理;氯化钾可溶于水,二氧化锰难溶于水,通过加水溶解、过滤、蒸发,可以除去二氧化锰,B合理;在氧气中加热碳和氧气反应,可以达到目的,C合理;氢氧化钙和碳酸钾反应,会生成碳酸钙和氢氧化钾,过滤除去碳酸钙,但是引入新的杂质氢氧化钾,D错误。
5.答案:D
解析:饱和食盐水不能继续溶解,但能溶解;当多次使用后溶液中的也达到饱和,就不能再使用粉碎颗粒过大,在盐粒内部的不易溶出。
6.答案:D
解析:“可燃冰”是甲烷水合物,水是由氢、氧两种元素组成的,因此水不可能变油,故A错误;氧化物是指由两种元素组成,且其中一种元素是氧元素的化合物,可燃冰是混合物,故B错误;“可燃冰”的燃烧值高,故C错误;可燃冰完全燃烧生成二氧化碳和水,几乎不产生残渣或废气,故D正确。
7.答案:D
解析:A项中没有指明溶剂质量以及是否达到饱和状态,故A错;131.6g饱和溶液中含有31.6g硝酸钾,故B错;C项中没有指明温度,故C错;20℃时,31.6g溶解在100g水中达到饱和状态,故D正确。
8.答案:C
解析:称量时粗盐放在天平左盘的称量纸上,故A正确;粗盐溶解时,要用玻璃棒不断搅拌,故B正确;蒸发时,待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余液体蒸干,故C错误;过滤液体时,要注意“一贴、二低、三靠”的原则,过滤时漏斗下端尖嘴处紧靠烧杯内壁,故D正确。
9.答案:B
解析:鱼虾养殖池内常设置一些水泵,把水喷向空中,目的是增加水与空气的接触面积,便于氧气溶解,故B正确。
10.答案:A
解析:碳酸钠能与酸反应生成二氧化碳气体,检验食盐中是否含有碳酸钠,可通过加稀盐酸的方法检验,故A正确;取少量溶液于试管中,滴加氯化钡溶液,有白色沉淀生成,再滴加稀硝酸,沉淀不溶解,不能证眀该溶液中一定含有硫酸根离子,也可能含有银离子,故B错误;向某固体中滴加稀盐酸,有气泡产生,不能证明该固体中一定含有碳酸根离子,也可能含有活泼金属,故C错误;氢氧化铜难溶于水,不能使无色酚酞溶液变红,故D错误。
11.答案:A
解析:氢氧化钠、碳酸钠溶液都呈碱性,都能使无色酚酞试液变红,因此无法鉴别,故A符合题意;盐酸与氢氧化钠反应无明显现象,与碳酸钠反应有二氧化碳气体生成,因此可以鉴别,B不符合题意;氢氧化钙与氢氧化钠不反应,无明显现象,与碳酸钠反应有白色沉淀碳酸钙生成,因此可以鉴别,C不符合题意;氯化钡与氢氧化钠不反应,无明显现象,与碳酸钠反应有白色沉淀碳酸钡生成,因此可以鉴别,D不符合题意。
12.答案:D
解析:碳酸氢钠的俗名是小苏打,纯碱是碳酸钠,A错误;在相同条件下,由于碳酸氢钠的溶解度比氯化铵的溶解度小,所以碳酸氢钠先结晶析出,过滤后的滤液中一定有碳酸氢钠和氯化铵,B错误;配制溶液的过程中玻璃棒的作用是搅拌加速溶解,不能提高物质的溶解度,C错误;向饱和食盐水中通入氨气,制成饱和氨盐水,饱和氨盐水显碱性,更易于吸收二氧化碳,D正确。
13.答案:A
14.答案:B
15.答案:C
解析:实验①中固体完全溶解,所得溶液质量分数,A错误;实验②中不能确定恰好完全溶解,实验③④无法确定剩余固体的质量,即无法确定50水最多能溶解多少溶质,不能确定25℃时该物质的溶解度,B错误;实验③④中溶剂的质量相同,溶解溶质的质量相同,所以所得溶液中溶质的质量分数相同,C正确;实验④中加入的20固体没有完全溶解,溶液中含溶质的质量小于20,D错误。
16.答案:(1)CaO
(2)NaCl
(3)
(4)
(5)
解析:(1)生石灰能与水反应生成氢氧化钙,可以用作干燥剂;
(2)食盐是厨房中常用的调味品;
(3)熟石灰是氢氧化钙的俗称,是一种碱,可以与酸反应,所以可用于改良酸性土壤;
(4)小苏打是碳酸氢钠的俗称,受热能分解生成二氧化碳,使糕点疏松多孔,因此可用来作焙制糕点的发酵粉;
(5)纯碱是碳酸钠的俗称,其水溶液显碱性,可用来作洗涤剂。
17.答案:(1)乙>甲=丙(或乙>丙=甲)
(2)80
(3)55;20%
(4)丙>甲=乙(或丙>乙=甲)
解析:(1)在℃时甲和丙的溶解度曲线有交点,说明此时溶解度相等,乙的溶解度高于甲、丙;
(2)由溶解度曲线可知,t℃时乙的溶解度为80;
(3)由溶解度曲线可知℃时甲的溶解度为80,此温度下,180甲的饱和溶液中含水100含甲物质为80,在℃时甲的溶解度为25,降温到℃时,溶剂的质量不变,此时只能溶解25甲物质,则析出固体的质量为55,溶液中溶质的质量分数为;
(4)由于℃时甲、乙的溶解度相等,大于丙物质的溶解度,取等质量的甲、乙丙三种物质,分别配成℃时的恰好饱和溶液,甲、乙需要的水相同,比丙的少。
18.答案:(1)cba(或bca或bac)
(2)富集、提纯
(3)促进碳酸氢钠的生成与析出;
(4)置换反应
解析:(1)粗盐水中主要含有和等可溶性杂质,加稍过量的NaOH溶液除去,加稍过量的溶液除去,加稍过量的溶液除去和过量的,顺序不唯一,只要把稍过量的溶液放在稍过量的溶液前面加入就行。
(2)母液中的氯化镁浓度低,经历步骤Ⅳ、Ⅴ的转化过程的目的是富集、提纯。
(3)步骤Ⅱ中先向饱和食盐水中通入氨气使溶液呈碱性,有利于二氧化碳的吸收,这样做的目的是促进碳酸氢钠的生成与析出;反应物是氯化钠、水、二氧化碳和氨气生成物是氯化铵和碳酸氢钠。
(4)Ⅰ、Ⅳ和Ⅴ中发生的反应都是复分解反应;Ⅲ、Ⅵ中发生的反应和贝壳在高温下生成二氧化碳和氧化钙的反应是分解反应;氧化钙和水反应生成氢氧化钙的反应是化合反应;没有涉及的基本反应类型是置换反应。
19.答案:【探究报告】碳酸钠、硫酸钠;酚酞试液(合理即可);溶液变红(合理即可)
【实验结论】
【实验反思】检验并且除去碳酸钠,防止对检验氢氧化钠产生影响
【实验处理】加酸
解析:【探究报告】根据部分白色沉淀消失,产生无色气泡可知,白色沉淀为碳酸钡和硫酸钡,说明废液中含有碳酸钠和硫酸钠;取滤液①于试管中,滴加酚酞试液,溶液变红,说明溶液中含有氢氧化钠。
【实验结论】通过分析推理,可以得出废液中含有的溶质有。
【实验反思】向废液中加入足量的氯化钡溶液的目的是检验并且除去碳酸钠,防止对检验氢氧化钠产生影响。
【实验处理】由于废水呈碱性,因此应向废水中加酸处理,以除去碳酸钠和氢氧化钠,检测达标后再排放。
20.答案:(1)18
(2)
(3)解:设第一次加入的氯化钙溶液中溶质质量为。
氯化钙溶液的溶质质量分数
答:氯化钙溶液的溶质质量分数为16.7%。









