

所属成套资源:_2022学年新教材高中化学同步作业含解析新人教版必修第二册
- 2021_2022学年高中化学第6章化学反应与能量第2节化学反应的速率作业含解析人教版必修第二册 练习 试卷 0 次下载
- 2021_2022学年高中化学第6章化学反应与能量第2节10化学反应的限度化学反应条件的控制作业含解析人教版必修第二册 练习 试卷 0 次下载
- 2021_2022学年高中化学第7章有机化合物第4节蛋白质油脂作业含解析人教版必修第二册 练习 试卷 0 次下载
- 2021_2022学年高中化学第7章有机化合物第3节基次时15乙醇作业含解析人教版必修第二册 练习 试卷 0 次下载
- 2021_2022学年高中化学第7章有机化合物第4节糖类作业含解析人教版必修第二册 练习 试卷 0 次下载
人教版 (2019)必修 第二册第二节 化学反应的速率与限度同步练习题
展开这是一份人教版 (2019)必修 第二册第二节 化学反应的速率与限度同步练习题,共7页。试卷主要包含了对于密闭容器中的反应等内容,欢迎下载使用。
1.已知FeCl3和MnO2都可作H2O2分解制O2的催化剂,为了探究温度对化学反应速率的影响,下列实验方案可行的是( )
A.
B.
C.
D.
D [当探究温度对化学反应速率的影响时,必须保证在其他条件相同的情况下,再改变温度观察反应速率的变化。]
2.把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示。下列因素中,影响该反应速率的主要因素是( )
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A.①④ B.③④ C.①③ D.②③
C [镁与盐酸反应的离子方程式为Mg+2H+===Mg2++H2↑,与H+有关,与Cl-无关。在镁与盐酸的反应中,刚开始时H+的浓度最大,反应速率应最大,但由于此反应为放热反应,温度升高,化学反应速率还会增大,随着化学反应的进行,H+浓度逐渐减小,化学反应速率又逐渐减慢。镁条的表面积在此反应中不是主要因素。]
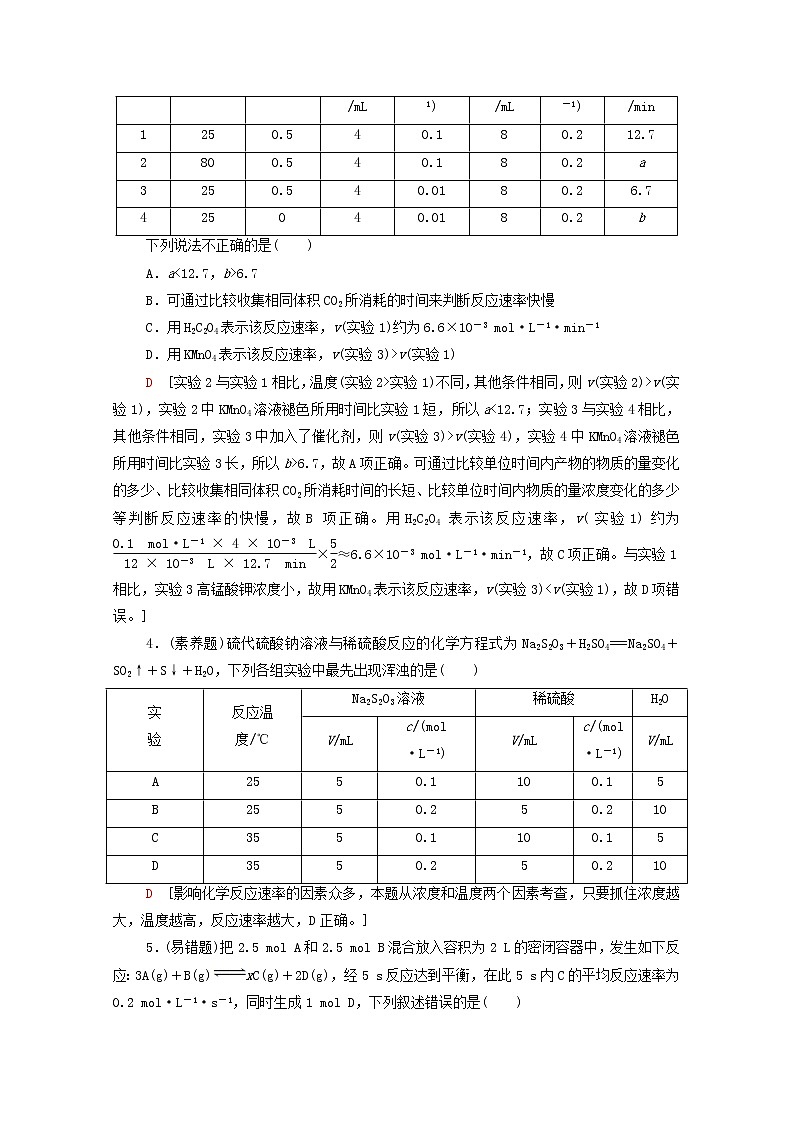
3.已知反应2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O,探究其反应速率的影响因素,有关实验数据如表所示。
下列说法不正确的是( )
A.a<12.7,b>6.7
B.可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢
C.用H2C2O4表示该反应速率,v(实验1)约为6.6×10-3 ml·L-1·min-1
D.用KMnO4表示该反应速率,v(实验3)>v(实验1)
D [实验2与实验1相比,温度(实验2>实验1)不同,其他条件相同,则v(实验2)>v(实验1),实验2中KMnO4溶液褪色所用时间比实验1短,所以a<12.7;实验3与实验4相比,其他条件相同,实验3中加入了催化剂,则v(实验3)>v(实验4),实验4中KMnO4溶液褪色所用时间比实验3长,所以b>6.7,故A项正确。可通过比较单位时间内产物的物质的量变化的多少、比较收集相同体积CO2所消耗时间的长短、比较单位时间内物质的量浓度变化的多少等判断反应速率的快慢,故B项正确。用H2C2O4表示该反应速率,v(实验1)约为eq \f(0.1 ml·L-1×4×10-3 L,12×10-3 L×12.7 min)×eq \f(5,2)≈6.6×10-3 ml·L-1·min-1,故C项正确。与实验1相比,实验3高锰酸钾浓度小,故用KMnO4表示该反应速率,v(实验3)
D [影响化学反应速率的因素众多,本题从浓度和温度两个因素考查,只要抓住浓度越大,温度越高,反应速率越大,D正确。]
5.(易错题)把2.5 ml A和2.5 ml B混合放入容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5 s反应达到平衡,在此5 s内C的平均反应速率为0.2 ml·L-1·s-1,同时生成1 ml D,下列叙述错误的是( )
A.x=4
B.达到平衡状态时容器内气体的压强与起始时压强之比为6∶5
C.5 s内B的平均反应速率v(B)=0.05 ml·L-1·s-1
D.达到平衡状态时A的转化率为50%
D [根据C的平均反应速率可以算出5 s内C的物质的量的变化量为2 ml。根据“三段式”法进行分析:
3A(g)+B(g)xC(g)+2D(g)
起始量/ml 2.5 2.5 0 0
转化量/ml 1.5 0.5 2 1
平衡量/ml 1 2 2 1
根据C和D的物质的量的变化量之比为2∶1,可以确定x=4,A项正确;同温同体积下,气体的压强之比等于其物质的量之比,起始时气体的总物质的量为5 ml,达到平衡时气体的总物质的量为6 ml,所以达到平衡时容器内气体的压强与起始时压强之比为6∶5,B项正确;5 s内物质B消耗了0.5 ml,用B表示的化学反应速率为eq \f(0.5 ml,2 L×5 s)=0.05 ml·L-1·s-1,C项正确;达到平衡时A的转化率为eq \f(1.5 ml,2.5 ml)×100%=60%,D项错误。]
6.在某容积为2 L的密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(ml)随时间t(min)的变化曲线如图所示:
下列说法正确的是( )
A.前2 min内,v(A)=0.2 ml·L-1·min-1
B.在2 min时,图像发生改变的原因只可能是增大压强
C.其他条件不变,4 min时体系的压强不再发生变化
D.增加气体D的浓度,A的反应速率随之降低
C [从前2 min看,A、B、C、D改变的物质的量分别为0.4 ml、0.5 ml、0.6 ml、0.4 ml,且A、B的物质的量减少,应为反应物;C、D的物质的量增加,应为生成物。故反应方程式为4A(g)+5B(g)6C(g)+4D(g)。选项A,前2 min内,v(A)=eq \f(0.4 ml,2 L×2 min)=0.1 ml·L-1·min-1,错误。选项B,从图像看,2~3 min时的图像斜率变大,说明化学反应速率加快,增大压强、升高温度、加入催化剂等均可加快反应速率,错误。选项C,4 min时反应达到平衡状态,体系压强不再改变,正确。选项D,增加生成物D的浓度,A的浓度随之增大,故A的反应速率加快,错误。]
7.在一定的条件下,向2 L密闭容器中进行一定量MgSO4和CO的反应:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)。反应时间与残留固体的质量关系如图所示。下列说法正确的是( )
A.升高温度时,正反应速度增大,逆反应速率减小
B.随着反应的进行,混合气体的平均相对分子质量增大
C.增加硫酸镁的质量时,正反应速率将增大
D.在0~10 min内,v(CO)=0.01 ml·L-1·min-1
B [A项,升温,v正、v逆均增大,错误;C项,增加固体的量,v不变,错误;D项,
MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g) Δm
120 g 1 ml 40 g 80 g
12.0 g n(CO) 4.0 g 8.0 g
n(CO)=0.1 ml,v(CO)=eq \f(0.1 ml,2 L×10 min)
=0.005 ml·L-1·min-1,错误。]
8.对于密闭容器中的反应:N2(g)+3H2(g)eq \(,\s\up10(高温、高压),\s\d10(催化剂))2NH3(g)(正反应是放热反应),在673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如图所示。
请回答下列问题:
(1)a点时正反应速率________(填“>”“<”或“=”下同)逆反应速率;c点时正反应速率________逆反应速率。
(2)d点处n(N2)________(填“>”“<”或“=”)e点处n(N2),原因是___________________________。
(3)起始时加入氢气的物质的量为________ml。
(4)若温度、压强不变,反应在加入催化剂条件下进行,在上图的基础上画出n(NH3)和n(H2)随时间变化的关系图。(已知催化剂不影响反应限度)。
[解析] a、b、c三点反应都没有达到平衡状态,故正反应速率大于逆反应速率,但d、e点反应都处于平衡状态,正、逆反应速率相等,各组分的含量保持不变。平衡时生成了0.6 ml氨气,则消耗0.9 ml氢气,故起始时加入氢气的物质的量为0.4 ml+0.9 ml=1.3 ml。若加入催化剂,反应达到平衡的时间缩短,但平衡时各物质的物质的量不变。
[答案] (1)> > (2)= 当反应处于平衡状态时,混合物中各组分的含量保持不变 (3)1.3 (4)如图虚线所示(只要体现出达到平衡的时间缩短,且平衡时NH3和H2的物质的量与原平衡一样即可)
9.草酸与高锰酸钾在酸性条件下能够发生如下反应:MnOeq \\al(-,4)+H2C2O4+H+―→Mn2++CO2↑+H2O(未配平),用4 mL 0.001 ml·L-1 KMnO4溶液与2 mL0.01 ml·L-1 H2C2O4溶液研究不同条件对化学反应速率的影响。改变的条件如下:
(1)该反应中氧化剂和还原剂的物质的量之比为________。
(2)如果研究催化剂对化学反应速率的影响,使用实验________和________(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验________和________。
(3)对比实验Ⅰ和Ⅳ,可以研究________对化学反应速率的影响,实验Ⅳ加入1 mL蒸馏水的目的是_______________________。
[解析] 与实验Ⅰ相比,实验Ⅱ外加了MnSO4溶液,因此实验Ⅰ和Ⅱ是研究催化剂对反应速率的影响;与实验Ⅰ相比,实验Ⅲ中,温度由20 ℃升至30 ℃,因此实验Ⅰ和Ⅲ是研究温度对反应速率的影响;与实验Ⅰ相比,实验Ⅳ中外加蒸馏水后溶液总体积不变,但c(H+)(或H2SO4浓度)减小,因此实验Ⅰ和Ⅳ是研究c(H+)(或H2SO4浓度)对反应速率的影响。
[答案] (1)2∶5 (2)Ⅰ Ⅱ Ⅰ Ⅲ
(3)c(H+)(或硫酸的浓度) 确保实验中KMnO4浓度、H2C2O4浓度和溶液总体积不变
10.(素养题)(1)一定温度下,在密闭容器内进行某化学反应,气体X、Y的物质的量随反应时间变化的曲线如图所示。
①写出该反应的化学方程式:___________________________。
②在t1和t2时正反应速率分别为v1和v2,则二者大小关系为v1________v2(填“>”“<”或“=”)。
③在t1、t2和t3三个时刻中,反应程度最大的是_______________________ (填“t1”“t2”或“t3”)。
(2)将一定量N2和H2(体积比为1∶3)的混合气体通入合成塔,反应达到平衡后,氨的体积分数为16%,则平衡时混合气体中N2的体积分数为________,H2的转化率为________。
(3)已知2NO2(g)N2O4(g) ΔH<0。现将NO2和N2O4的混合气体通入容积为2 L的恒容密闭容器中,恒温条件下反应体系中物质浓度随时间的变化关系如图所示。
①平衡时NO2的转化率为______________。
②起始压强与平衡时压强之比为________。
[解析] (1)①随着时间变化,Y的物质的量减少、X的物质的量增加,即Y为反应物、X为生成物,依据物质的量变化量之比等于化学计量数之比,可得化学方程式为3Y(g)2X(g)。
②随着反应的进行,反应物的浓度降低,正反应速率减慢,即v1>v2。
③反应正向进行,t3时刻达到化学平衡,即t3时刻反应程度最大。
(2)设起始时充入1 ml N2、3 ml H2,转化的N2为x ml,则
N2 + 3H2eq \(,\s\up10(高温、高压),\s\d10(催化剂))2NH3
起始量/ml 1 3 0
转化量/ml x 3x 2x
平衡量/ml 1-x 3-3x 2x
平衡时混合气体的总物质的量为(4-2x)ml,
依题意有eq \f(2x,4-2x)×100%=16%,得x=eq \f(8,29),
N2的体积分数为eq \f(1-x,4-2x)×100%=eq \f(1-\f(8,29),4-2×\f(8,29))×100%=21%,
H2的转化率为eq \f(3x ml,3 ml)×100%=eq \f(8,29)×100%≈27.6%。
(3) 2NO2(g)N2O4(g) ΔH<0
初始浓度/(ml·L-1) 0.6 0.2
反应浓度/(ml·L-1) 0.4 0.2
平衡浓度/(ml·L-1) 0.2 0.4
①平衡时NO2的转化率为eq \f(0.4 ml·L-1,0.6 ml·L-1)×100%=66.7%。
②恒温恒容条件下,起始压强与平衡时压强之比等于物质的量之比,则起始压强与平衡时压强之比为
(0.8 ml·L-1×2 L)∶(0.6 ml·L-1×2 L)=4∶3。
[答案] (1)①3Y(g)2X(g) ②> ③t3
(2)21% 27.6% (3)①66.7% ②4∶3编
号
温
度
/℃
催化
剂质
量/g
酸性KMnO4溶液
H2C2O4溶液
KMnO4溶液褪色所用时间/min
体
积
/mL
浓度/
(ml·L-1)
体
积
/mL
浓度/
(ml·L-1)
1
25
0.5
4
0.1
8
0.2
12.7
2
80
0.5
4
0.1
8
0.2
a
3
25
0.5
4
0.01
8
0.2
6.7
4
25
0
4
0.01
8
0.2
b
实
验
反应温
度/℃
Na2S2O3溶液
稀硫酸
H2O
V/mL
c/(ml
·L-1)
V/mL
c/(ml
·L-1)
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
实验编号
10%硫酸溶液的体积/mL
温度/℃
其他物质
Ⅰ
2
20
—
Ⅱ
2
20
10滴饱和MnSO4溶液
Ⅲ
2
30
—
Ⅳ
1
20
1 mL蒸馏水
相关试卷
这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度达标测试,文件包含623反应条件的调控与速率平衡的有关计算解析版docx、623反应条件的调控与速率平衡的有关计算原卷版docx等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。
这是一份人教版高中化学必修第二册能力课时落实4反应条件的调控与速率、平衡的有关计算含答案,共8页。
这是一份人教版 (2019)必修 第二册第一节 化学反应与能量变化课堂检测,共4页。













